条文本
摘要
背景阻塞性睡眠呼吸暂停(OSA)是一种异质性疾病,需要进一步了解其生理表型及其临床意义。我们的目的是确定常规多导睡眠图数据是否可用于识别OSA表型(集群),并评估表型与心血管结局之间的关系。
方法我们对一个多地点、观察性的美国退伍军人(n=1247)队列进行了横断面和纵向分析。采用基于主成分的聚类方法识别OSA的四个病理生理领域(睡眠结构障碍、自主神经调节障碍、呼吸障碍和缺氧)的多导睡眠特征。利用这些特征,通过聚类分析(K-means)识别OSA表型。Cox生存分析用于评估组群与短暂性缺血发作、中风、急性冠状动脉综合征或死亡的综合结局之间的纵向关系。
结果根据多导睡眠特征,我们确定了7个患者群:“轻度”、“睡眠中的周期性肢体运动(PLMS)”、“非快速眼动和觉醒”、“快速眼动和缺氧”、“睡眠不足和缺氧”、“觉醒和睡眠不良”和“合并严重”。在调整后的分析中,“PLMS”(2.02(1.32 - 3.08)、“睡眠不足和缺氧”(1.74(1.02 - 2.99)和“合并严重”(1.69(1.09 - 2.62)的合并结果(HR (95% CI))的风险(与“轻度”相比)显著增加。常规的呼吸暂停-低呼吸指数(AHI)严重性分级为中度(15≤AHI<30)和重度(AHI≥30),与轻度/无分级(AHI <15)相比,与风险增加无关。
结论在转到OSA评估的患者中,常规多导睡眠描记术数据可以识别生理表型,捕捉到不良心血管结局的风险,否则传统的OSA严重程度分级会遗漏这些风险。
- 阻塞性睡眠呼吸暂停(OSA)
- 聚类分析
- 表型
- 非均质性
- 心血管疾病
- 死亡率
统计数据来自Altmetric.com
关键信息
关键问题是什么?
常规多导睡眠描记术数据和无监督学习方法能否用于识别阻塞性睡眠呼吸暂停(OSA)患者的亚组(“表型”),以及这些亚组是否与不良心血管结局或死亡的风险增加有关?
底线是什么?
在转到OSA评估的患者中,我们确定了生理表型,捕捉了不良心血管结局的风险,否则传统的OSA严重程度分级使用呼吸暂停-低呼吸指数遗漏了。
为什么要继续读下去?
我们发现,在不同的传统OSA严重程度类别中,存在生理上不同的患者群体(例如,睡眠时肢体周期性运动、觉醒、缺氧等发生率较高),这些群体可能对治疗和心血管事件或死亡的风险有影响。
简介
阻塞性睡眠呼吸暂停(OSA)越来越被认为是一种复杂和异质性的综合征。1将这些疾病分类为更小、更同质的类别(“表型”)有助于促进对病理生理学的理解,开发有针对性的治疗方法,并改善临床试验的预测和风险分层。多导睡眠描记术能够收集到多种类型的生理数据,从而产生大量的指标,通过这些指标可以确定OSA患者的特征。以前认为的OSA表型主要基于特定睡眠状态下呼吸事件的发生,2 3体位4或缺氧。5这些先前的研究使用的方法是基于单一或少数特征先验地识别表型,因此可能遗漏了更复杂和(到目前为止)未确认的OSA亚组。6
这种多导睡眠表型的临床相关性,包括预后意义,在很大程度上仍不确定。OSA是众所周知的心血管疾病(CVD)和死亡的独立危险因素。7号到9号然而,许多将OSA和CVD结果联系起来的流行病学研究主要集中在呼吸暂停-低呼吸指数(AHI)上,10这只是多导睡眠描记术产生的生理数据的一小部分。最近的研究表明,单独的AHI可能无法完全捕捉到生理过程(如低氧血症负担,11睡眠破碎12或周期性睡眠肢体运动(PLMS))13与不良心血管结果的发展有关。
聚类分析是一种无监督学习方法,可以整合多个特征(如多导睡眠指标),而无需先验分组来识别独特的患者类别。14在其他异质性疾病,如哮喘,COPD和心力衰竭,表型与不同的预后和治疗反应性通过聚类分析确定。15 - 17日在OSA中,使用无监督学习方法基于多导睡眠指标来识别患者亚组的研究很少。18 19这类亚组与心血管结局的关系在很大程度上仍未被探索。
我们的目的是利用常规多导睡眠描记术数据来捕捉OSA的生理异质性与临床相关心血管结局的关系。具体来说,我们假设,通过将无监督学习方法应用于多导睡眠图数据,可以识别出患者的独特集群(表型),并且集群与不良心血管结局(急性冠状动脉综合征(ACS)、短暂性缺血发作(TIA)、中风或死亡的风险存在差异。
方法
对方法细节的全面描述在网上提供补充文件.
补充文件1
参与者和措施
通过呼吸暂停监测(DREAM)确定血管事件风险的研究包括来自三个退伍军人事务中心(西黑文,康涅狄格州;俄亥俄州克利夫兰;以及印第安纳州的印第安纳波利斯)在2000年至2004年期间进行了OSA评估,并随访到2012年20..在入组时(即多导睡眠描记术的时间),收集人口学和人体测量学特征、心血管风险因素、医疗共病和其他指标的数据,如前所述。20.心血管风险通过Framingham风险评分(FRS;包括年龄、性别、是否吸烟、是否有糖尿病、是否服用降压药、收缩压、总胆固醇和高密度脂蛋白水平)21以Charlson共病指数(CCI)计算共病负担。22在线描述了多导睡眠描记评分、变量定义、分类和持续气道正压(CPAP)治疗依从性(常规vs非常规)补充文件.所有的多导睡眠描记评分都是在单一中心(西黑文,康涅狄格州)进行的。主要结局是急性冠脉综合征、TIA、中风或任何原因的死亡的综合。复合结果选择的基本原理及其判定在前面已经描述过20.在网上补充文件.
多导睡眠描记变量选择与分析样本
65个多导睡眠变量被分为4个领域,代表了先前报道的OSA和CVD之间的因果通路中的病理生理过程:呼吸障碍、自主神经调节障碍、低氧血症和睡眠障碍。10日23如果其他包含的变量反映了类似的生理参数(如总睡眠时间和效率),则排除多余的变量(如卧床时间)。类别变量(如打鼾)和数据缺失5%的变量,由于聚类分析的要求被排除在外(见在线)补充文件详情)。29个多导睡眠描记变量(见网上)补充表E1)进行变量约简分析。
从源总体(n=2041)中,得到最终分析样本(n=1247)。由于聚类分析的要求,缺失任何多导睡眠变量数据的患者(n=482)被排除在外。多导睡眠图提取不一致或评分差异的患者(n=308)或睡眠时间<15分钟的患者(n=4)也被排除。
统计分析
采用两步变量缩减分析来识别每个域内独特的多导睡眠图特征。首先,采用基于主成分的聚类方法识别与本聚类高度相关且与其他聚类不相关的变量组。24其次,选择多导睡眠图特征以在每个区域内保留75%的总方差,使用被判断为临床可解释的特征的最少数量(见在线)补充图E1和表E2).
基于多导睡眠特征评分,我们采用k均值分析生成聚类。轮廓宽度(一种聚类质量度量)25以临床可解释性来选择组簇数量(详细描述见网上补充文件).采用自举聚类样本的Jaccard系数评价聚类稳定性。26
我们使用方差分析或X来评估组间的横断面对比2测试。使用未调整的Cox比例风险模型和调整了FRS和CPAP使用的模型评估OSA集群和主要转归之间的关系。使用累积危害函数(H(t)=−logS(t))评估将每一组与“轻度”组进行比较的模型的比例危害假设。敏感性分析包括分组和CPAP使用(1)CCI和(2)基线时的家庭氧气使用(所有的敏感性分析都在网上报告补充文件).同时还将cvd特异性死亡率作为综合结果的一部分进行了分析。我们使用AHI严重性分类(轻度/无:AHI <15;中度:15≤AHI<30;严重性:AHI≥30),以代替聚类成员,以评估传统的OSA严重性分类是否捕捉到了风险。为了评估分析样本和排除患者之间的差异,我们比较了这些组之间的基线风险(FRS和CCI)和主要结果(在线)补充文件).所有分析均采用SAS V.9.3。各中心的机构审查委员会批准了该研究(WHVA HIC #0001)。
结果
研究人群以男性为主,平均年龄为58.3±11.7岁,平均AHI为25.0±29.7次/小时,CVD患病率为29% (表1).29个多导睡眠图变量被简化为17个特征,保留了83%的总方差(见在线)补充表E3),并被判断为可临床解释。患者水平的聚类分析结果为7个OSA亚组(聚类A - G)补充簇A-G),根据最显著的特征进行标记(表2).特征分布在网上显示补充图E1和表E6.鉴于OSA的严重程度传统上是根据基于ahi的类别(无/轻度、中度和严重)来表示的,为了突出每个类别的异质性,下面的聚类描述是根据传统的OSA严重程度进行分组的。
无/轻度阻塞性睡眠呼吸暂停综合症
最大的(n=533)组被标记为“轻度”,基于很少的呼吸紊乱事件(中位数AHI (IQR)为4(9)),高睡眠效率,正常的快速眼动睡眠和接近正常的夜间氧饱和度(表3).“PLMS”聚类(n=119), AHI中位数为10(19),与其他聚类的区别主要是显著较高的PLMS指数(PLMI)。与“轻度”组相比,“PLMS”组在氧饱和度<90% (T<90%)时睡眠时间更长。
“轻度”组的患者最年轻,共病(CCI)和CPAP使用最低(表4).“PLMS”组的患者比“轻度”组的患者平均老8岁,并表现出更高的共病,包括高血压和糖尿病(表4,在线补充表E1).
中度阻塞性睡眠呼吸暂停综合症
“非快速眼动和睡眠不良”(n=186)和“快速眼动和缺氧”(n=168)组的AHIs中位数是相等的,但多导睡眠测量结果显著不同。NREM相关的呼吸暂停、低呼吸相关的和自发觉醒是“NREM和睡眠不良”集群的特征(表3,在线补充表E6).这些患者表现出睡眠不良(效率为55%;41%的第一阶段快速眼动睡眠不足)。“REM和缺氧”组的患者出现REM相关呼吸暂停的频率最高,氧饱和度最低(72.8%),缺氧负担增加(中位(IQR) T<90% ~ 9% (23%),表3).
与“轻度”组相比,“非快速眼动和睡眠不良”组和“快速眼动和缺氧”组的患者更肥胖,表现出更高的CPAP或家庭氧气使用量,高血压和糖尿病的患病率更高(表4,在线补充表E7).
严重的阻塞性睡眠呼吸暂停综合症
标记为“低呼吸和缺氧”的聚类(n=75,中位AHI为44(39))显示伴有低呼吸和低氧负担的患者居多(T<90%, 14%(36%)),且睡眠结构相对保留(表3,在线补充表E6).伴有觉醒但无去饱和的呼吸暂停的优势,以及明显的睡眠结构紊乱,区分了“觉醒和睡眠不良”类群(n=42,中位AHI为68(30))。其低氧负荷(T<90% 0% (4%);氧饱和度最低点为87.1%)与AHIs明显较低的簇相似。“合并严重”组(n=126, AHI中位数为84(28))表现为合并呼吸暂停(伴有低饱和度和觉醒)、严重缺氧负担、高唤醒指数和1阶段睡眠的高百分比。
与严重阻塞性睡眠呼吸暂停(OSA)类别的其他组相比,“觉醒和睡眠不良”组的患者往往年龄更大、睡意更少、使用CPAP的频率更低(表4).这一群体的黑人和西班牙裔患者比例也最高。尽管“严重阻塞性睡眠呼吸暂停”组的基线共病负担相似,但与“轻度”组相比,“觉醒和睡眠不良”组的患者有更高的心肌梗死、房颤和慢性肺部疾病患病率的趋势(在线)补充表E7).
临床结果
在平均4.9±1.9年的随访后,271例患者经历了ACS、TIA、中风或任何原因的死亡补充表E8).主要转归的Kaplan-Meier曲线根据患者群的不同有显著的统计学差异(日志级别,p值<0.001,图1).在未经调整的分析中(表5),聚类成员与不良心血管事件或死亡相关(p值0.002)。与“轻度”组相比,“PLMS”组表现出两倍以上的主要转归风险(风险比(HR) 2.36;95% CI 1.61 ~ 3.46)。在其余组中,只有“快速眼动和缺氧”组的主要结局风险在统计学上没有高于“轻度”组(HR 1.34, 95% CI 0.91 - 1.99)。总体而言,定期使用CPAP与主要结局风险降低36%相关(p值为0.0015,表5),这种衰减随聚类的不同而不同(图2).在对年龄、性别和基线心血管风险的FRS进行调整后,“PLMS”、“低呼吸和缺氧”和“合并严重”集群与主要结局的相关性仍然显著,“觉醒和睡眠不良”组的HR为1.79,95% CI为0.97至3.29 (表6).由于大多数合并转归事件为死亡,使用CCI代替FRS进行敏感性分析,以及添加家庭氧气使用,结果相似(在线补充表E9和E10).最后,将心血管疾病死亡率与全因死亡率作为综合结果的一部分进行敏感性分析,得出了类群的等效风险关联(数据未显示)。
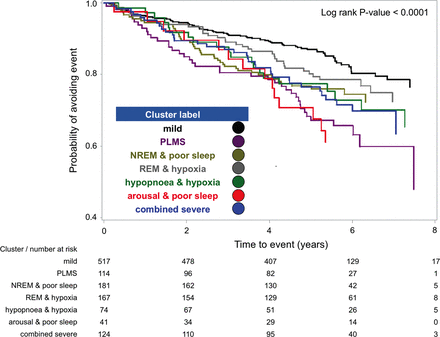
急性冠状动脉综合征、短暂性缺血发作、中风或死亡风险的Kaplan-Meier生存概率曲线NREM,非快速眼动;PLMS,周期性睡眠肢体运动;快速眼动,快速眼球运动。
每组定期与不定期使用CPAP的患者发生ACS、TIA、中风或死亡的风险(比值比,OR)。ACS,急性冠状动脉综合征;CPAP,持续气道正压;NREM,非快速眼动;PLMS,周期性睡眠肢体运动;快速眼动,快速眼球运动;短暂性缺血发作。p值为ORs检验的brreslow - day同质性。定期使用CPAP与不定期使用CPAP的患者的OR和95% CI报告。
在调整后的模型中,基于AHI的传统OSA严重程度分类与主要转归无相关性(p值为0.49),无论参照组规格如何(无(AHI <5)或无/轻度(AHI <15),表6).
讨论
利用多导睡眠图数据和无监督分析方法(如聚类分析),我们在每一种传统的、基于ahi的OSA严重程度类别中确定了多个平均AHIs患者表型。这些集群捕获了不同的现象,包括与PLMS的共同发生,呼吸事件与觉醒的关联,缺氧负荷和特定的睡眠状态。为了强调由集群描述的生理异质性的临床相关性(但不是创建一个预后工具),我们评估了它们与心血管事件或死亡的相关性。我们发现,聚类成员独立预测不良CVD或死亡,而传统的基于ahi的严重程度分类则不能。
PLMS是“轻度”和“PLMS”的主要区别特征,这两个集群的中位AHI <15。PLMS在OSA患者中患病率较高(28%-48%),尤其是AHI <20的患者,27支持我们的发现,“PLMS”集群作为一个具有明显的OSA生理障碍的群体。尽管PLMS很常见,但除了年龄较大和共病负担增加外,对于OSA患者中与PLMS起源相关的因素知之甚少。27也可以在“PLMS”集群中找到。PLMS对心血管系统不利影响的证据正在出现。与单纯OSA患者相比,伴有PLMS的OSA患者的基础自主神经调节向交感神经主导转移。28PLMS与日间血压升高有关29进展为持续性心房纤颤。30.在控制了基线心血管风险后,我们发现与“轻度”组相比,“PLMS”组的综合结果增加了两倍,而使用CPAP可能会降低这一风险(图2).在另一个OSA队列中,PLMI独立预测了CVD的发生率或任何原因的死亡。13结合我们的研究结果,证据表明PLMS对CVD或死亡风险增加的患者的识别是重要的。
在中度阻塞性睡眠呼吸暂停严重程度范围内(15≤AHI<30),“非快速眼动和睡眠不良”组的多导睡眠描记学特征表明,较低的唤醒阈值(加上较高的通气环增益)可能导致氧饱和度较低的碎片化睡眠。31虽然我们没有直接测量唤醒阈值,但该簇显示出最低氧饱和度为>82.5%,这是先前报道的低唤醒阈值的预测指标。32相比之下,“快速眼动和缺氧”组,以快速眼动相关的呼吸事件、严重缺氧为主,但睡眠相对不间断,与快速眼动相关的OSA类似,这是之前公认的表现型。2 33在我们的研究中,“非快速眼动和睡眠不良”组组与复合转归的增加无关,而且据我们所知,与“非快速眼动和睡眠不良”组组相似的多导睡眠特征患者的CVD或死亡发生率尚未被描述。“快速眼动和缺氧”组与较高(未经调整的)高血压患病率相关(在线)补充表E7),但没有增加ACS、TIA、中风或死亡的发生率。先前一项rem相关OSA的研究发现,与非阶段特异性OSA相比,高血压患病率较低,2而另一项研究则发现REM AHI >的OSA患者高血压患病率和继发性增加15。33研究设计、结果和队列特征(例如,以男性为主)的差异使直接比较变得困难。
我们的研究结果表明AHI≥30的患者有相当大的病理生理变异性。一些患者可能在低强度气道阻塞下出现缺氧(“低呼吸和缺氧”),而另一些患者可能需要直接呼吸暂停来降低饱和度(“合并严重”)。具有相同AHIs和常规唤醒指数的患者可能表现出明显不同程度的缺氧(“唤醒和睡眠不良”vs“合并严重”)。有些唤醒发生在气道打开之前,作为“安全阀”来防止缺氧/高碳酸血症的恶化,而另一些则发生在气道打开之后。31对于在觉醒前或未觉醒时打开气道的患者,自发觉醒可能增强通气不稳定,干扰进入深度睡眠并增加循环频率(缺氧较少,事件更频繁)。31测量因素,如唤醒时间,呼吸暂停和低呼吸时长,事件前氧饱和度,通气环增益和咽部肌肉反应34可能有助于细化集群之间的差异,并提供对这些风险类别的洞察。
与以ahi为基础的严重程度分类相比,我们研究中的“低呼吸和缺氧”和“合并严重”集群均与复合结局风险增加有关。尽管许多研究报告了AHI与心血管事件或死亡之间的联系,7号到9号最近的一项系统综述显示,这种关联并没有始终被发现。10和,如T<90%或多次觉醒,已被确定为独立预测因子。7 11 13不同的生理特征可能在某些病人身上起着重要作用,而在其他病人身上则没有。例如,对于“低呼吸和缺氧”和“合并严重”集群的患者,缺氧的持续时间和深度(而不是简单的去饱和频率)可能会增加风险。相比之下,对于其他患者(“觉醒和睡眠差”),更多的非白人和老年人,与觉醒和碎片化睡眠相关的快速循环呼吸暂停,但没有明显的缺氧,可能是重要的。当单独使用AHI对患者进行分类时,我们可能会根据不同的生理特征和风险情况对患者进行分组(在线补充图E3),可能会错失降低风险的机会。
我们的研究结果可能对选择OSA患者进行治疗和临床试验具有重要意义。例如,在目前的实践指南中,对无症状的轻度OSA (AHI <15)的治疗建议是可选的,PLMS不包括在风险分层中。35只关注AHI可能会忽略一个患心血管疾病或死亡风险更高的亚组患者。在我们的研究中,CPAP对“PLMS”集群使用降低风险的方法。关于CPAP治疗的证据有限没有选择AHI <15的患者对致死性或非致死性心血管事件无影响。36我们的研究结果也可以作为OSA治疗临床试验招募的指南,因为不良结果风险最大的患者可能获得最大的益处。
在传统上被归类为严重阻塞性睡眠呼吸暂停的患者中,我们的结果提示睡眠呼吸障碍的不同生理机制。因此,基于主要致病生理因素的针对性治疗可能对这些患者更好(例如,使用镇静剂和/或氧气通气驱动降低唤醒倾向)。34而不是单一的PAP疗法。此外,并非所有严重的阻塞性睡眠呼吸暂停患者都能从治疗中获益(图2).使用这些方法对心血管结果的影响尚不清楚,这是未来研究的一个重要领域。
虽然聚类分析已用于OSA,18 19 37-40只有两项研究18 19包括除AHI外的多导睡眠测量。Joosten等18在1064例轻度或中度OSA患者中确定了6个集群,与先天定义的多睡眠睡眠描图OSA组(REM为主、仰卧分离、仰卧为主和REM/仰卧重叠)相似。在睡眠结构、觉醒和缺氧领域的大多数指标被排除在外。Lacedonia分析等结合AHI、T<90%和氧饱和度指数,在198例OSA患者中确定了三个集群。19AHI >55的两个组在T<90%时差异显著,类似于我们分析中的“合并严重”和“觉醒和睡眠不良”组。在心血管疾病或糖尿病的患病率方面,这些集群没有差异。两项研究都没有以聚类的方式关注或模拟临床结果,这限制了研究结果的预后意义。
我们的研究有几个局限性,值得考虑。我们分析了来自单个先前研究的数据(尽管来自多个退伍军人医疗中心),和大多数聚类分析一样,我们的结果最好用于生成假设。我们需要在其他人群中验证我们的发现,以识别不同的多导睡眠图特征。尽管我们的总体分析样本相对较大,因为聚类分析中的单个组可能较小,但我们选择(先验地)不进行分离队列验证,以避免“遗漏”潜在的临床相关但数量较少的患者类别(例如,“低呼吸和缺氧”,n=75)。同样,需要更好地理解集群的影响。例如,“PLMS”聚类是否代表不宁腿综合征合并阻塞性睡眠呼吸暂停综合征,还是阻塞性睡眠呼吸暂停综合征合并PLMS的独特实体,以及其对心血管结局和死亡的意义,都需要进一步研究。考虑到我们的研究中包含大量的多导睡眠变量(n=29),以及聚类分析不遗漏数据的要求,我们预计源人群中的相当一部分参与者将被排除在我们的分析样本之外。这些组间人口统计学因素、基线心血管危险共病和主要结局的比较显示无差异(在线补充表E11).此外,我们的数据不包括症状测量、中间OSA表型(如颅面结构和生理特征)或心血管风险生物标志物数据。目前的研究也不是为了研究CPAP对心血管结局的客观依从性或有效性。尽管如此,尽管经常使用CPAP,我们还是证明了不良事件的风险增加,这表明对于某些组,即使治疗也存在风险。最后,在我们的队列中缺乏性别和种族多样性可能会限制我们的研究结果对女性或少数族裔的普遍性。
我们的研究优势包括使用结构化的、数据驱动的方法来确定OSA每个病理生理领域的临床可解释的多导睡眠图特征,以及严格的定量方法(即聚类分析),整合多个多导睡眠图特征来识别独特的患者亚组。我们的方法很容易跨中心翻译,因为它是基于标准的多导睡眠描记术和评分。另一个优点是评估集群的事件心血管结局或死亡,同时使用经过验证的措施调整基线心血管风险。我们还纳入了睡眠呼吸暂停严重程度的所有患者,因为一些AHI <5的患者之前已被证明心血管事件的风险增加。33我们的研究结果强调了需要对OSA进行多维特征描述,以改善预测和试验设计,特别是当来自多个研究人群的大型多领域数据集可用时。
总之,我们的研究增加了新的证据,表明在传统的OSA严重程度分类中存在多导睡眠图异质性,并且可以利用现有的无监督学习方法将患者划分为反映不同病理生理过程的亚组。其中一些亚组捕获了不良心血管事件或死亡的风险,否则传统的AHI分类会遗漏,这表明额外的措施——如PLMS或伴有缺氧或觉醒的呼吸事件——可能对风险分层和治疗选择很重要。未来的研究需要评估无监督学习方法是否可以应用于其他人群和多维数据集,以更好地了解病理生理学,改善预后和确定OSA患者的靶向治疗方法。
致谢
作者感谢美国退伍军人、康涅狄格州退伍军人事务医疗中心临床流行病学研究中心的工作人员以及耶鲁大学肺部、重症监护和睡眠医学部门的教员和研究员,他们为制定这项工作提供了宝贵的反馈。
参考文献
脚注
贡献者所有作者都对本研究数据的概念、设计、分析或解释做出了重大贡献。AVZ, SJ和HKY有权访问研究中的所有数据,并对数据分析的完整性和准确性负责。AVZ、SJ、BBK、NSR、JC和HKY参与数据解释。AVZ, BBK和HKY起草了手稿,所有作者都对重要的知识内容进行了批判性的修改。所有作者最终同意提交这个版本。
资金本研究得到了VA临床科学研究与发展(CSR&D)绩效评估计划(CSRDS07)、VA合作研究计划、NIH的NRSA机构培训拨款(5T32HL07778)、耶鲁急性和慢性睡眠障碍研究中心(P20NRO14126)和美国银行临床研究Robert E. Leet和Clara Guthrie Patterson信托奖学金计划的支持。JC受到VA合作研究计划的支持。
相互竞争的利益没有宣布。
伦理批准西港湾退伍军人事务机构审查委员会。
来源和同行评审不是委托;外部同行评审。
发表于部分作品以海报讨论的形式呈现:Zinchuk AV, Jeon S, Koo BB,等.阻塞性睡眠呼吸暂停的临床相关表型。J呼吸危重症护理医院2016; 193: A6380。
请求的权限
如果您希望重用这篇文章的任何部分或全部,请使用下面的链接,它将带您访问版权清除中心的RightsLink服务。您将能够快速获得价格和以多种不同方式重用内容的即时许可。



