条文本
抽象的
基本原理呼吸道感染在肺纤维化患者中很常见。细菌感染和纤维化之间的相互作用的特点很差。
目标观察革兰氏阳性细菌感染对小鼠纤维化加重的影响。
方法纤维化进展对肺炎链球菌肺炎料在两种不同的肺纤维化小鼠模型中进行了检测。
测量和主要结果我们证实野生型小鼠暴露于腺病毒载体递送的活性转化生长因子-β1 (TGFß1)或白喉毒素(DT)处理下,表达DT受体(DTR)的转基因小鼠在表面活性蛋白C (SPC)启动子(SPC-DTR)的控制下诱导肺纤维化,随后发生进行性纤维化感染Spn,肺保护免疫无损伤。抗生素治疗消除了感染诱导的纤维化进展。Spn的细胞毒素肺炎溶素(Ply)以tlr4不依赖的方式引起了这一现象,因为Spn缺乏Ply (SpnΔply)未能触发进行性纤维化,而纯化的重组Ply可以触发。adtgf β1暴露于ply激活的TLR4 KO小鼠中也观察到进行性纤维化。在多激adtgf β1暴露小鼠中,发现肺泡上皮细胞凋亡细胞死亡增加,肺内抗纤维化前列腺素E2释放减弱,从而导致纤维化进展。重要的是,在adtgf β1暴露小鼠中,用非细胞毒性Ply衍生物B (PdB)接种小鼠可显著减轻Ply诱导的肺纤维化进展。
结论我们的数据揭示了Spn感染通过Ply释放诱导已建立的肺纤维化进展的新机制,该机制可以通过蛋白基础的小鼠免疫减轻。
- 特发性肺纤维化
- 呼吸道感染
- 细菌感染
来自Altmetric.com的统计
关键信息
关键问题是什么?
关于细菌感染是否会导致肺纤维化的加重,目前尚不清楚。
什么是底线?
研究表明,肺嗜热细菌可能通过释放明确的细胞毒性因子促进小鼠肺泡上皮细胞凋亡而引发进行性肺纤维化。
为什么要读吗?
目前的研究有助于更好地了解感染诱导的肺纤维化加重使用两种不同的临床前小鼠模型。
介绍
特发性肺纤维化(IPF)是最严重的间质性肺疾病,发病率为每10万人2-29例,中位生存期为3 - 4年。1该疾病方法的特征在于反复肺泡上皮微损伤,导致上皮细胞损伤,成纤维细胞和肌纤维细胞的积累以及增加的细胞外基质沉积。2这导致进行性组织瘢痕和蜂窝囊肿的形成,共同导致不可逆的肺功能丧失和呼吸衰竭。许多IPF患者的病情出现不可预测的急性恶化。这些可能由继发性并发症(如PE、细菌性和/或病毒性肺炎)或未知原因引起,称为IPF急性加重(AE-IPF)。3 - 5虽然没有直接证据表明AE-IPF患者存在病毒感染,6临床介绍与这些事件的传染性触发相一致。7号到9号先前的报道表明,γ疱疹病毒可介导小鼠肺纤维化的恶化。3.,10最近关于细菌在IPF进展中的作用的研究得出结论,IPF进展与细胞内特定成员的存在有关链球菌和葡萄球菌属,预示肺功能下降和死亡。11,12然而,目前还不清楚IPF中的细菌感染是否仅仅是高危患者组的继发性并发症,或者它们是否也会加重潜在的纤维化。考虑到IPF患者可能更容易发生细菌性肺炎,这是一个与临床高度相关的问题。8
在这项研究中,我们想(1)检查患有实验性肺纤维化的动物清除细菌感染的能力是否受损;(2)分析细菌感染是否能够引发肺纤维化的恶化。采用两种独立的小鼠肺纤维化模型。第一种模型由腺病毒载体将活性转化生长因子-β1 (TGFβ1)基因导入小鼠肺部诱导肺纤维化。13,14另一种小鼠模型由白喉毒素(DT)给转基因表面活性蛋白c -白喉毒素受体(SPC-DTR)小鼠造成重复的肺泡II型上皮细胞损伤和随后的肺纤维化组成。15作为第二次打击,已建立肺纤维化的小鼠接受原型社区获得性肺病原体Streptococcus肺炎(Spn)。16
方法
所有的动物实验都得到了当地政府部门的批准。在线补充资料中详细介绍了这些方法。
结果
小鼠ADTGFβ1诱导肺纤维化的表征及其对肺抗菌免疫的影响
经口气管(o.t)应用AdTGFβ1可导致支气管肺泡灌洗液(BALF)中活性TGFβ1蛋白水平在第5天升高,在第7天达到峰值,随后下降(图1A).应用AdTGFβ1后,第7天羟脯氨酸水平显著升高,第14天达到峰值,并持续升高至第28天(图1B).肺纤维化的形态学评估显示,adtgf β1处理小鼠的Ashcroft评分相对于对照组显著增加(图1C)。我们还观察到肺抗性显着增加(R.l)在第14天并减少动态遵守(C直流发电机),相对于对照组(图1d,e)。
adtgf β1诱导小鼠肺纤维化的特征。Naïve小鼠(条形条,第0天时间点)用对照载体AdDL70-3 (1×108PFU,白色条)或AdTGFβ1 (1×108PFU,黑色条)用于不同的时间点,如图所示。(A) TGFβ1活性蛋白在BAL液(BALF)中的动力学。(B)分析羟脯氨酸作为测量肺组织中肺胶原含量的方法。(C)组织形态测定法/Ashcroft评分法测定肺纤维化程度。(D和E) AdTGFβ1和对照载体暴露小鼠的肺功能(RlD)和动态顺应性(C)直流发电机数据显示为n=5只小鼠每个时间点和治疗组(n=10只小鼠每个治疗组在D和E)的均值±SD,代表了3 (A-C)或2个独立进行的实验(D和E)。数据通过学生的t检验进行分析。*p<0.05, ***p<0.001。PFU,点状单位。
接下来,我们检测了AdTGFβ1治疗14、21或28天小鼠的肺宿主防御肺炎链球菌(SPN)感染。在SPN感染的ADTGFβ1或对照载体处理的小鼠组之间观察到细菌载荷没有显着差异(图2a - c)。此外,AdTGFβ1暴露14天与Spn感染后对照组小鼠BALF细胞数量和促炎TNF-α水平无显著差异(图2D-F)。
AdTGFβ1对肺保护免疫的影响。(A-C)检测Spn感染后24、48和72 h肺组织的细菌载量(1×107从暴露于AdTGFβ1(黑色条)或控制载体(白色条)14天(A)、21天(B)或28天(C)的小鼠(CFU/小鼠),如图所示。在Spn感染后24h、48h和72h,从未处理的对照组小鼠(条纹条)和AdTGFβ1或对照载体暴露小鼠(14 D)采集BAL液(BALF),测定巨噬细胞(D)、中性粒细胞(E)和TNF-α蛋白水平(F)。数据显示为n=4只小鼠每个时间点和治疗组的平均±SD,并代表三个独立进行的实验。数据采用Mann-Whitney U检验。CL:未处理的对照组小鼠;那么,克隆形成单位。
感染肺炎链球菌诱发小鼠肺纤维化加重
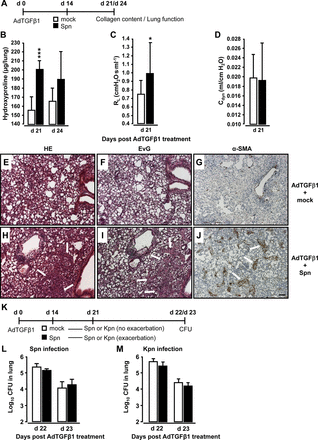
小鼠暴露于AdTGFβ1, 14 d后再感染Spn或mock 7或10 d (图3A). Spn感染小鼠adtgf β1后第21和24天,胶原沉积显著增加(图3b)。第21天的功能分析显示出SPN相对于被嘲弄的小鼠的肺抗性显着增加(图3C, D).肺组织切片的组织病理学检查显示,与模拟感染小鼠相比,暴露于AdTGFβ1后Spn感染的小鼠在治疗后21天出现更多的支气管和间质炎症、纤维化和肺泡上皮增生(图3由于激活的(肌)成纤维细胞,肺泡间隔明显增厚(比较α-平滑肌肌动蛋白(SMA)染色图3G, J)和胶原沉积增加(比较Elastica-van Gieson (EvG)染色图3F, I) AdTGFβ1 + Spn小鼠出现明显的肺细胞激活,但未见模拟感染小鼠。
细菌感染引发adtgf β1暴露小鼠的进行性肺纤维化。(一)实验资料。小鼠暴露于AdTGFβ1 (1×108PFU) 14天,然后是模拟感染(白色条)或spn感染(1×107CFU,黑色条),7或10天,如指示。(B) spn激发后第7天和第10天spn感染小鼠的肺胶原蛋白含量。(C和D)抗性评估(Rl动态顺应性(C直流发电机D) adtgf β1处理后,spn感染小鼠的肺中adtgf β1处理后第21天(对应于spn处理后第7天)。(E-J) adtgf β1处理小鼠的肺组织病理学,随后用mock (E-G)或Spn (H-J)刺激小鼠7天。肺组织切片用H&E (E和H)、Elastica-van-Gieson (EvG;F和I), α-平滑肌肌动蛋白(α-SMA;G和J)。注意H、I和J中胶原沉积和肌成纤维细胞聚集显著增加(白色箭头标记)。(K)测定spn诱导adtgf β1诱导的肺纤维化进展的小鼠肺保护免疫的实验谱。adtgf β1后第14天(1×108PFU),小鼠或模拟感染(白色条)或spn感染(1×107CFU,黑色条)持续7天,导致纤维化进展。随后,小鼠再次感染Spn (1×107CFU, L)或Kpn (5×106CFU, M),并测定细菌负荷,分别为(L和M)。数据以n=5只小鼠每个时间点和治疗组的平均±SD表示。这个实验重复了两次,得到了相似的结果。数据通过学生t检验(B-D)和Mann-Whitney U检验(L和M)进行分析。与模拟小鼠相比,*p<0.05, ***p<0.001。(E-J)比例尺,100µm。那么,克隆形成单位;PFU,点状单位。
我们进一步研究了spn诱导的肺纤维化恶化是否可能损害肺对细菌感染的保护性免疫。adtgf β1后第14天,用Spn或mock感染小鼠7天,再用Spn或mock攻击小鼠肺炎克雷伯菌(Kpn排除以往Spn感染引起的免疫效应,见图3重要的是,adtgf β1暴露小鼠在第一次Spn攻毒后发生进行性肺纤维化,在第二次Spn或Kpn感染后未显示任何细菌杀伤缺陷(图3l,m)。
细菌性感染在dt诱导的肺纤维化模型中引发进行性肺纤维化
作为另一种肺纤维化模型,我们使用转基因SPC-DTR小鼠在AT II细胞上表达人DT受体,并对DT给予肺纤维化反应。15OroTracheal在转基因SPC-DTR小鼠中诱导肺纤维化的肺纤维化,但在第14天施用后的肺纤维化或在申请后第14天(图4a,b)。DT治疗后14天具有SPN的转基因SPC-DTR小鼠的挑战还引发了该模型的渐进式肺纤维化,而WT凋落物没有对DT和SPN治疗的渐进纤维化并没有反应(图4C, D)。
白喉毒素(DT)暴露的转基因SPC-DTR小鼠中,细菌感染引发进行性肺纤维化。(A和B)转基因SPC-DTR小鼠dt诱导肺纤维化的特征。转基因SPC-DTR小鼠及其野生型(WT)窝伴分别用PBS或DT处理,连续7天。(B) DT处理后第14天WT和转基因SPC-DTR小鼠肺胶原蛋白含量。(C)实验资料。SPC-DTR小鼠和它们的野生一窝同伴每天接受DT的ot应用,连续7天,然后在第14天,即确定肺纤维化的时间,用mock和Spn进行攻击。(D) DT后假感染或Spn感染WT和SPC-DTR小鼠的肺胶原蛋白含量,如(C)所示。数据显示为n=5只小鼠每个时间点和治疗组的平均±SD,代表了两个独立进行的实验。数据采用双向方差分析进行分析。**p<0.01,与对照组比较(B), ***p<0.001与对照组比较(D), +p<0.05与对照组比较(D)。职能治疗师,orotrachea; PBS, phosphate-buffered saline.
抗生素治疗对spn诱导的小鼠肺纤维化进展的影响
adtgf β1后第14天,小鼠被Spn-或mock感染,随后用生理盐水、克拉霉素或阿莫西林治疗(图5A).重要的是,在感染后24 h和48 h用克拉霉素或阿莫西林抗生素治疗可显著降低肺羟脯氨酸含量,与模拟感染小鼠相当(图5B, C)。
抗生素治疗对spn诱导的小鼠肺纤维化加重的影响。(一)实验资料。小鼠经AdTGFβ1预处理(1×108 PFU/mouse) for 14 days and were then either mock-infected (white bars) or Spn-infected (1×107CFU /鼠标)。随后,小鼠在感染后第1天和第2天(对应于adtgf β1后第15天和第16天)分别接受生理盐水(黑色条)、克拉霉素(CLR, 50 mg/kg b.w,条纹条)或阿莫西林(AMOX, 100 mg/kg b.w,点状条)。(B、C) adtgf β1后21天各治疗组小鼠肺胶原蛋白含量测定。数据以n=3只小鼠每个时间点和治疗组的平均值±SD表示,并代表了四个独立进行的实验。数据采用单因素方差分析。*p<0.05, **p<0.01, ***p<0.001与spn感染+盐水处理小鼠比较。ANOVA:方差分析;合著,体重;那么,克隆形成单位;PFU,点状单位。
溶肺素在spn诱导的肺纤维化进展中的作用
Spn可通过释放成孔细胞毒素肺炎溶酶(Ply)引起小鼠肺肺泡上皮损伤。17同时,Ply是一种细菌PAMP,已知可在巨噬细胞等肺效应细胞中诱导toll样受体4 (TLR4)信号。18因此,我们假设spn来源的Ply可能导致spn感染小鼠的纤维化加重。adtgf β1暴露小鼠的Spn多聚缺陷等位基因突变体SpnΔply刺激未导致纤维化加重(图6同样地,Spn缺陷的Spn刺激已建立肺纤维化的SPC-DTR小鼠也未能诱导纤维化加重,而dt预处理的Spn刺激SPC-DTR小鼠则相反,后者对Spn感染反应,羟脯氨酸水平显著增加(图6C, D)。
肺炎素对ADTGFβ1和SPC-DTR依赖性肺纤维化进展的影响。(一)实验资料。小鼠暴露于AdTGFβ1 (1×108 PFU/mouse) for 14 days and were then either mock-infected (white bars) or Spn-infected (1×107CFU/小鼠,黑色条)或感染同基因突变株肺炎链球菌肺炎料spnΔply(1×107CFU /鼠标,灰色酒吧)。(B)第21天,取肺,测定肺羟脯氨酸含量。(C)实验资料。SPC-DTR转基因小鼠每天经口气管注射DT,连续7天,然后模拟感染(白色条)或spn感染(1×107CFU/小鼠,黑色条)或感染同基因突变株肺炎链球菌spnΔply(1×107CFU/鼠标,灰色条)。(D)第21天,取肺,测定肺羟脯氨酸含量。(E)在naïve野生型(WT)小鼠(白条)或单层Ply攻毒后6小时测定的小鼠(黑条)肺通透性,如图所示。(F) Ply重复治疗adtgf β1暴露的WT小鼠的实验概况。小鼠暴露于AdTGFβ1 (1×108第14、15和16天,小鼠分别接受50µL PBS(白色条状)或50µL PBS(黑色条状)中的PdB、PdT或Ply(每只小鼠约50个溶血单位)。(G)第21天取肺,测定胶原蛋白含量。(H)实验资料。WT和TLR4 KO小鼠暴露于AdTGFβ1 (108在14、15和16天,小鼠连续3天接受PdB(白色条状)或Ply(每只小鼠约50个溶血单位,黑色条状)。(I)第21天取肺,测定胶原蛋白含量。数据显示为n=5只小鼠每个时间点和治疗组的平均值±SD,并代表了两个独立进行的实验。数据通过单因素方差分析(B, D, G)和双因素方差分析(I)进行分析。*p<0.05, **p<0.01与(B, D) mock和SpnΔply处理相比,与(G) mock或PdB或PdT处理相比,以及与PdB处理(I)相比。那么,克隆形成单位;职能治疗师,气管,仍PBS,磷酸盐;PdB:肺炎溶酶衍生物B;PdT:肺炎溶素衍生物T;PFU,点状单位。
为了证实Ply在触发纤维化进程中的关键作用,我们接下来滴定Ply以诱导上皮损伤而不导致死亡(图6E).应用100 ng Ply/小鼠肺在治疗后6小时引发了肺通透性的增加,没有任何死亡率,而125和150 ng Ply/小鼠肺引起了深刻的肺通透性,6小时内死亡率更高(125 vs 150 ng, Ply: ~ 50% vs 65%死亡率)。基于这些观察,我们用115 ng Ply(每只小鼠约50个溶血单位)或其非溶血衍生物肺炎溶素衍生物B (PdB)或其非溶血衍生物非补体激活肺炎溶素衍生物T (PdT),连续三天每天一次(图6F).应用Ply,而不是PdB或PdT触发adtgf β1诱导的小鼠肺纤维化进展(图6G)。
为了研究Ply是否会通过TLR4引发纤维化进展,18我们将adtgf β1暴露的WT和TLR4敲除小鼠重复Ply刺激(图6H).重要的是,adtgf β1暴露的TLR4 KO小鼠对重复Ply刺激的纤维化反应明显增加,这表明Ply诱导的纤维化进展与TLR4无关,并基于毒素的细胞毒性活性(图6一世)。
重复帘布层攻击在II细胞中触发凋亡细胞死亡
重复的肺泡上皮损伤可能使人体IPF的发病机制提出。19基于我们的观察,Ply通过tlr4独立通路触发小鼠纤维化进程,我们假设它可能通过其形成孔的功能,导致纤维化小鼠的进行性上皮损伤,从而加剧纤维化。因此,我们评估了从AdTGFβ1 + ply激发小鼠肺中收集的分类AT II细胞的早期凋亡诱导程度。MHC的FACS分类IIposAdTGFβ1 + ply激发小鼠的AT II细胞的分类纯度超过98% (图7模拟)。事实上,adtgf β1暴露小鼠的AT II细胞对重复Ply刺激反应显著增加凋亡,通过annexin V染色检测,在缺乏碘化丙啶染色的情况下(图7E)。
反复注射adtgf β1对小鼠细胞凋亡和PGE的影响2AT II细胞水平。(A-D)第21天从AdTGFβ1暴露14天小鼠肺部分离的AT II细胞的流分选门控策略,随后重复PdB或Ply刺激,如图6F所示。(模拟)Pre-enriched II细胞被染色和anti-MHCII anti-CD45 anti-CD16/32 Ab抗体存在,然后根据FSC-A封闭和SSC-A特征(A),其次是分层subgating根据FSC和MHC II (B)以及CD45和MHC II (C)表达式。(D)对分选后的AT II细胞进行排序分析,排序纯度为>98%,经改良的巴氏染色和片层体电镜检测证实(数据未显示)。(E)早期凋亡百分比(annexin Vpos碘化,propidium负的)从未处理小鼠(灰色条)或对照载体(白色条)或AdTGFß1(黑色条)刺激小鼠的肺部纯化AT II细胞14天,PdB或Ply 7天,如(E) PGE图示所示。(F) PGE2用对照载体(白色条)或Adtgfβ1(黑条)处理的未处理小鼠(灰色杆)或小鼠的水平为指示的时间间隔。(g)PGE2对照载体或AdTGFβ1治疗14天的小鼠BAL液中的水平,随后在载体治疗后的14、15和16天,用PdB和Ply进行重复治疗,如图所示。铂族元素2在病媒治疗后的第17天确定了水平。数据显示为n=3只小鼠每个时间点和治疗组(F中n=5只小鼠每个时间点和治疗组)的均值±SD,代表了两个独立进行的实验。数据通过双向方差分析(E和G)或学生t检验(F)进行分析。*p<0.05, ***p<0.001与对照载体、+PdB处理和+++p<0.001与对照载体+Ply处理相比。ANOVA:方差分析;FSC,向前散射;PdB:肺炎溶酶衍生物B。
接下来,我们探讨了ply诱导adtgf β1暴露小鼠AT II细胞凋亡的增加如何影响肺纤维化进展。一些报道已经证实了上皮细胞衍生的花生四烯酸代谢物前列腺素E的重要作用2(铂族元素2)通过抗纤维化作用调节肺成纤维细胞和肌成纤维细胞的增殖和细胞外基质的沉积,抑制血清反应因子依赖的细胞外基质转录。20 - 22因此,我们研究了重复的Ply挑战对纤维化肺装载PGE的能力有什么影响2响应。所示图7F, AdTGFβ1暴露导致PGE显著增加2在治疗后14-21天小鼠BALFs中释放。adtgf β1暴露小鼠重复注射可显著降低BALF PGE2与多普莱处理的对照病媒暴露小鼠(图7G),提示已建立肺纤维化的小鼠已经失去了对继发性Ply挑战产生适当抗纤维化反应的能力。
肺炎球菌蛋白疫苗对多层诱导纤维化进展的影响
研究表明,Ply是一种重要的致病因子肺炎链球菌为了在两个独立的纤维化模型中导致已建立的肺纤维化的进展,我们接下来检查了基于蛋白质的疫苗是否是一种预防策略,以抑制ply诱导的小鼠纤维化加重。作为一种免疫原,我们选择了无细胞毒性的Ply衍生物PdB,并根据上述免疫方案应用于小鼠图8A.如图8B-D和pdb -明胶对adtgf β1暴露小鼠的初次和二次免疫(即adtgf β1治疗后的第7和21天),相对于辅助剂(明胶)对已建立肺纤维化小鼠的影响,均显著提高了ply特异性IgG1和IgA抗体滴度。重要的是,与使用明矾治疗的肺纤维化小鼠相比,pdb免疫小鼠对重复Ply激发并纤维化加重无应答(图8这些数据表明,以肺炎球菌蛋白为基础的疫苗接种针对关键的肺炎球菌毒力因子可能对spn诱导的小鼠纤维化加重有重要的预防作用。
接种疫苗对多层诱导纤维化进展的影响。(一)实验资料。第7天腹腔注射PBS、明矾或pdb -明矾(10µg/小鼠)。第0天,将小鼠暴露于AdTGFβ1,然后在载体处理后第7天用pdb -明矾(20µg/小鼠)再免疫或只注射明矾或PBS。AdTGFβ1暴露后第14、15和16天,小鼠分别接受PdB或Ply治疗。(B - d)血浆特异性IgG1抗体滴度(B;1:3000稀释)或IgG2A (C;1:30稀释)或IgA (D;(E)实验组小鼠的肺羟脯氨酸水平,如(A)所示。数据显示为n=9只小鼠每个时间点和治疗组的均值±SD,并代表三个独立进行的实验。采用Mann-Whitney U检验(B-D)或单因素方差分析(E)对数据进行分析。*p<0.05与组2比较,***p<0.001与组3比较,+p<0.05与组3比较。 ANOVA, analysis of variance; o.t., orotrachea; PBS, phosphate-buffered saline; PdB, pneumolysin derivative B.
讨论
临床表现提示IPF患者更容易发生呼吸道细菌感染。肺炎是IPF中最常见的死亡原因之一。1,23然而,没有机制证据来解释这一临床观察。在这里,我们表明,与对照组小鼠相比,已建立肺纤维化的小鼠同样能够清除远端肺间隙的细菌负荷,同时肺中性粒细胞和巨噬细胞募集程度相似,TNF-α释放水平相似。这些数据表明,肺纤维化的严重程度本身并不影响肺对细菌的保护性免疫。即使在更严重的由spn诱导的纤维化加重引起的实验性纤维化中,我们也没有发现肺保护性免疫对继发性细菌感染的不利影响。
我们着重阐明细菌感染对感染后1周纤维化加重的影响,假设感染诱导纤维化加重的发展需要一段时间。因此,我们采用了19型血清肺炎链球菌在我们的实验中,它是引起局灶性肺炎的主要原因。在这些实验中,不允许使用毒性更强的肺炎球菌菌株迅速导致免疫小鼠侵袭性肺炎球菌疾病进展,因为由此产生的严重感染会在几天内造成高死亡率,并在所需终点之前终止实验。
我们的研究也证明了抗生素对阻断小鼠spn诱导的纤维化加重的治疗效果。由于克拉霉素和阿莫西林在减轻spn诱导的纤维化加重方面具有相似的疗效,大环内酯类抗生素可能具有免疫调节作用24,25可能在很大程度上被排除在外。这一发现具有重要的临床意义,因为AE-IPF患者最有可能受益于标准化的抗生素治疗方案。然而,根据ATS/ERS/JRS/ALAT官方声明中的建议,目前治疗AE-IPF的做法集中于免疫抑制大剂量皮质类固醇,1但不是用抗菌药物。根据我们和其他数据,26一旦这些患者获得了病毒和/或细菌感染,应考虑给COPD和IPF患者使用抗生素,以支持抗细菌宿主防御,防止加速纤维化和潜在的慢性肺病恶化。最近的一项研究报告进一步支持了这一观点,该研究报告称,每天服用两次复方新诺明(960 mg)的IPF患者,只要坚持治疗,迅速恶化的事件明显更少。27考虑到Ply是由肺炎链球菌在细胞裂解或死亡时,进一步考虑到此处显示Ply可导致纤维化加重,非溶解性抗生素将是IPF患者抑制感染诱导纤维化加重的首选药物。
利用两个独立的小鼠肺纤维化模型,我们在这里首次证明,Spn感染已建立肺纤维化的小鼠可导致实质性的纤维化进展,这在临床上可能类似急性加重发作。在两种肺纤维化模型中,感染Ply缺陷的Spn同种基因突变体小鼠均不会引起纤维化加重,而重复应用重组纯化Ply可引起纤维化加重。早期的研究也报道了由于肺炎溶酶缺乏菌株Spn感染引起的炎症减少。28,29由于报道的Ply治疗引起的纤维化加重是TLR4独立的,该研究结果支持Ply通过其细胞毒性而非病原体相关分子模式(PAMP)信号特性发挥作用。
越来越多的证据支持在肺纤维化发病机制中的II细胞的作用。我们在连续三天施用了Ply以模仿重复的肺泡上皮微损伤,这被认为有助于人类IPF的发病机制。30.使用这种建模方法,重复的Ply刺激增加adtgf β暴露小鼠AT II细胞的早期凋亡。我们和其他人已经证明,由于Ply的成孔活性,它可能对肺泡上皮细胞产生毒性作用。17,31对于在当前的纤维化模型中观察到的Ply诱导加重效应,一个可能的解释可能与Ply诱导的AT II细胞和成纤维细胞之间前列腺素依赖的串扰有关。由于AT II细胞具有产生PGE的能力,因此在抑制成纤维细胞增殖和细胞外基质沉积方面发挥作用232重要的是,ply诱导的肺纤维化加重以显著降低BALF PGE为特征2水平,相对于ply处理的对照病媒暴露小鼠。这些数据支持这样一种观点,即与正常肺相反,纤维化肺在重复的多层诱导的上皮损伤后,抗纤维化反应的能力大大降低,这可能是由于细胞毒素诱导的上皮细胞凋亡增加。由于肺中性粒细胞征募在纤维化加重小鼠中没有受损,因此先前报道的ply依赖性PGE2中性粒细胞的释放不太可能解释所观察到的PGE减弱2在纤维化小鼠中的水平。33
最后,我们首次证明,以蛋白为基础的免疫小鼠肺纤维化建立与非细胞毒性ply衍生物pdb保护小鼠对ply诱导的纤维化加重。我们使用PdB作为蛋白免疫原34在具有成立的肺纤维化的小鼠中抵抗普利特异的粘膜抗体反应,以评估这种预防措施对纤维化进展的重要性。所选择的基于蛋白质的疫苗接种方法具有在免疫宿主中安装粘膜免疫应答的主要优点,其特征在于抗原特异性分泌IgA反应,从而将保护免受细胞毒素的保护,例如帘布层,与上皮细胞的已知的覆盖性肺粘膜表面。通过孔径形成诱导的上皮屏障的瞬态分解也可以促进孔隙腔的底层特异性抗体,从而能够中和肺泡释放的层。目前研究的数据强烈支持疫苗接种以最大限度地降低肺纤维化等慢性肺病患者感染诱导的恶化风险的重要性。
最近,有人认为革兰氏阴性细菌病原体,铜绿假单胞菌而γ疱疹病毒则不能导致小鼠肺纤维化加重。10在将该研究与我们的发现进行比较时,需要考虑几个方面。首先,相对于肺炎链球菌,铜绿假单胞菌不是典型的社区获得性病原体。由于大多数IPF患者在出现急性加重时没有住院,铜绿假单胞菌不太可能在IPF患者细菌感染诱导的纤维化加重中发挥作用,因此可能是在小鼠中检测细菌感染诱导的纤维化加重的一种相关性较低的病原体。其次,采用不同的小鼠肺纤维化模型来检测细菌感染诱导的肺纤维化加重,即博莱霉素与AdTGFβ1-和spc - dtr诱导的肺纤维化。第三,我们在这里使用了临床血清型19肺炎链球菌已知菌株导致小鼠的局灶性肺炎未进展于菌血症和败血症,从而核实所有小鼠在感染后第7天达到纤维化加剧分析的终点,而最近就业铜绿假单胞菌感染模型也可引起小鼠菌血症,但终点死亡率数据未见报道。值得注意的是,被使用的病原体之间的另一个重要区别是革兰氏阴性铜绿假单胞菌不会产生帘布层,这是一种特异性细胞相关的毒力因子。35
综上所述,通过使用两个独立的肺纤维化模型,我们首次证明了革兰氏阳性细菌感染肺炎链球菌导致小鼠肺纤维化的进展。肺炎球菌毒力因子肺炎溶血素被证实以tlr4独立的方式导致实验性纤维化纤维化增加,从而支持其在介导小鼠spn诱导纤维化加重中的中心作用。抗生素治疗和疫苗接种可消除小鼠感染诱导的纤维化加重。目前的数据强烈支持对肺纤维化患者进行标准化抗生素治疗和肺炎球菌疫苗接种,以防止感染引起的肺纤维化急性加重。
致谢
我们感谢M Blaess和A-K Janze以获得优秀的技术援助。
参考文献
补充材料
-
补充数据
这个web唯一的文件已经由BMJ出版集团从作者(s)提供的电子文件产生,并没有为内容进行编辑。
- 数据补充1——在线补充
脚注
SK、BU、MK和UAM是本文的联合第一或高级作者。
贡献者SK和BU进行实验,分析数据,撰写手稿。RM、JB、ND、MTT、H-GH、DJ、NI、JCP、ADO、SL和MB进行实验。TW, WS, AG, THS, JG, MK和UAM设计了研究,分析了数据并撰写了手稿。
资金这项工作得到了德国研究基金会(DFG)的资助,A12基金,UAM和TW,以及德国联邦教育和研究部(BMBF)的资助,德国肺研究中心(DZL)和脓毒症控制和护理中心的资助。MK和JG获得了加拿大卫生研究所(CIHR)的资助。
相互竞争的利益没有宣布。
伦理批准所有的动物实验都得到了当地政府部门的批准。
出处和同行评审不是委托;外部同行评议。
请求的权限
如果您希望重用本文的任何或全部,请使用下面的链接,它将带您到版权许可中心的RightsLink服务。您将能够获得一个快速的价格和即时许可,以许多不同的方式重用内容。