条文本
文摘
背景:持续的炎症过程导致气管和血管重塑描述慢性阻塞性肺疾病(COPD)。血管内皮生长因子(VEGF)及其受体VEGFR-1 (Flt-1)和VEGFR-2 (KDR / Flk-1)可以扮演一个角色在慢性阻塞性肺病组织改造和血管生成。
方法:细胞VEGF的表达模式,Flt-1和KDR / Flk-1由中部的免疫组织化学检查,周围肺组织获得人与慢性阻塞性肺病(在1秒用力呼气量(FEV1)< 75%的预测;n = 14)或无慢性阻塞性肺病(FEV1> 85%的预测;n = 14)。每个分子的免疫组织化学染色法是使用视觉量化评分法分数从0(没有)3(强烈的)。
结果:Flt-1, VEGF和KDR / Flk-1疣状是局部的血管和气管平滑肌细胞(VSM和ASM),支气管、细支气管和肺泡上皮细胞和巨噬细胞。肺动脉内皮细胞表达Flt-1但不是VEGF和KDR / Flk-1丰富的工具。支气管VEGF高表达微血管特点细胞和ASM细胞COPD患者的慢性阻塞性肺病的患者,比(p < 0.01, 1.7和1.6倍,分别)。在内膜和中VEGF表达特点1.7和1.3倍,p < 0.05)的外周肺动脉与细支气管相关航空公司在慢性阻塞性肺病更强烈,就像VEGF表达在肺泡肺小血管区域(1.5和1.7倍,p < 0.02)。在COPD患者,KDR / Flk-1表达增强内皮细胞和内膜和中VSM(1.3、1.9和1.5倍,p < 0.02),而内皮Flt-1表达高1.7倍(p < 0.03)。VEGF表达明显增加细支气管和细支气管肺泡上皮细胞以及巨噬细胞(1.5倍,p < 0.001)。支气管中VEGF的表达特点和粘膜微血管与FEV细支气管上皮呈负相关1(r<−0.45;p < 0.01)。
结论:VEGF及其受体Flt-1和KDR / Flk-1可能参与外周血管和气道重塑过程以自分泌和/或旁分泌的方式。这个系统也可能与上皮细胞生存能力在COPD气道壁改造。
- ASM,气道平滑肌
- 慢性阻塞性肺病,慢性阻塞性肺疾病
- FEV1,在1秒钟用力呼气量
- TGF-β1转化生长因子β1
- 血管内皮生长因子VEGF
- 扫描仪,血管平滑肌
- 慢性阻塞性肺疾病
- 血管内皮生长因子
- 血管生成
来自Altmetric.com的统计
慢性阻塞性肺疾病(COPD)是一种疾病状态的特点是不完全可逆的气流限制,通常进步,与异常相关的肺部炎症反应的有害微粒和气体。1慢性阻塞性肺病是一个主要的健康问题与吸烟的主要原因。慢性阻塞性肺病的一个重要病理特征是慢性气道炎症的特点是大量的炎性cells-predominantly中性粒细胞、巨噬细胞、CD8 + T淋巴细胞腔和墙的支气管和细支气管航空和实质。2 -4此外,几项研究已经报道的细支气管壁增厚和气道重塑peribronchiolar纤维化增加气道平滑肌(ASM)质量,和肺气肿。3,5,6
血管异常与慢性阻塞性肺病的发展有关。7,8莱特等发现增加墙面积小(< 500μm)肺血管内膜的增厚的轻度至中度COPD患者和内侧增厚在严重的情况下,这是与1秒钟用力呼气量下降(FEV1)。7,9此外,最近的观察表明,肌肉肺和细支气管动脉外膜增加CD8 + T淋巴细胞的浸润,内膜的增厚,与总胶原沉积的量。8日,10此外,肺气肿可能导致损失的肺血管床和诱导血管生成。11所知甚少,然而,这些过程分子机制在慢性阻塞性肺病的背景下。
的一个强有力的蛋白质参与血管重塑是血管内皮生长因子(VEGF)。VEGF家族目前由六名成员(VEGF-A F),最初的VEGF-A识别165年是主要的变体形式的五个额外的拼接变体。12vegf在肝素结合蛋白,并通过高亲和力跨膜受体VEGFR-1 (Flt-1)和VEGFR-2 (KDR / Flk-1)。酪氨酸激酶受体属于家庭和所表达的主要是内皮和上皮细胞。12数组VEGF促进内皮细胞的反应包括研究进展,内皮细胞增殖和血管生成新船管体内形成。12日,13VEGF表达可以诱导一系列的病理生理条件下包括肺缺氧肺动脉高压和纯粹的压力增加。13日,14缺氧和肺动脉高压病理特征往往在晚期慢性阻塞性肺病患者。2我们假设,VEGF表达增加,可能在缺氧诱导转录因子的影响下,可能导致增加,内皮异常增殖和血管平滑肌(VSM)细胞在肺血管导致血管重塑。
虽然VEGF的作用在血管生物学研究,它已成为明显,VEGF及其受体系统也参与其他各种细胞活动包括上皮增生和肥大细胞的存活和招聘,中性粒细胞和巨噬细胞的纤维化。13日,15日,16最近的研究表明,VEGF表达于肺细支气管,粘膜下,腺体和肺泡I和II型上皮细胞,肺泡巨噬细胞,ASM和VSM细胞,以及myofibroblasts肺纤维化病变。14日,17日,18
为了评估VEGFR-1 VEGF及其受体的作用(Flt-1)和VEGFR-2 (KDR / Flk-1)在慢性阻塞性肺病的病理生理学,我们首先检查VEGF-A的表达,Flt-1和KDR / Flk-1中部和周围肺组织与慢性阻塞性肺病或没有抽过烟。我们也调查了肺功能的关系与VEGF及其受体的表达。
方法
选择的病人
中央和周围肺组织从当前或获得过烟进行肺叶切除或全肺切除术治疗肺癌。慢性阻塞性肺病患者14 FEV1< 75%)和14个科目没有慢性阻塞性肺病(FEV1> 84%)包括如前所述。19 -21日,23肺总能力(TLC)不低于正常水平(TLC预测> 80%)。没有一个病人有上呼吸道感染,他们没有收到围手术期抗生素。没有病人接受糖皮质激素在3月前切除;四个患者接受糖皮质激素围手术期。基于所有这些标准,学科与慢性阻塞性肺病患者不能分为慢性支气管炎或肺气肿。临床数据表1中给出。受试者排除如果中央支气管阻塞是由于肿瘤,如果弥漫性肺部炎症或纤维化在场,或如果没有组织从肿瘤可以获得自由。患者两组参加了一个更大的研究项目,以前已经发表的一部分。19 -21LUMC医学伦理委员会批准了这项研究。
本研究中使用的肺组织标本从档案收集获得的病理(LUMC莱顿,NL)。标本常规固定在10%由inflation-immersion中性缓冲福尔马林固定和嵌入在石蜡组织病理学和免疫组织化学。
免疫组织化学
石蜡切片(4μm厚)肺组织的切割和安装在硅烷镀膜玻璃幻灯片。免疫组织化学进行了描述使用方法。20.22日,23短暂,在二甲苯和补液deparaffinisation后通过分级酒精、幻灯片和磷酸缓冲盐水冲洗(PBS)。内源性过氧化物酶被0.3%的氢过氧化物酶。VEGF、VEGFR-1 VEGFR-2和ki - 67染色,幻灯片被沸腾在柠檬酸缓冲进行预处理(10毫米,pH = 6.0) 10分钟在一个微波炉。部分是preincubated正常山羊血清稀释10% 5%牛血清白蛋白(BSA)在PBS (pH = 7.4),然后孵化30分钟在室温下与亲和纯化兔多克隆VEGF抗体的稀释1:200 v / v。使用的VEGF抗体是针对20个氨基酸合成肽与氨基酸的残基1 - 20人VEGF(圣克鲁斯生物技术公司,圣克鲁斯、钙、美国)。一系列不同的幻灯片是孵化兔多克隆抗体对合成肽对应人类Flt-1 aa 1312 - 1328 (Neomarkers rb - 1526,弗里蒙特、钙、美国)的稀释1:10 0 v / v。VEGFR-2,兔多克隆抗体对氨基酸1326 - 1345鼠标KDR / Flk-1 (Neomarkers rb - 1527)的稀释1:200使用了v / v。研究细胞的增殖航空抗体对ki - 67(斯特鲁普Dako公司、丹麦)1:400 4 v / voC在一夜之间被用作标记。连续组织切片也沾染了单克隆鼠标反alpha-smooth肌肉肌动蛋白(α-SMA)抗体(克隆1 a4;美国圣拉蒙Biogenex)的稀释1:1000 v / v。第一抗体的最佳稀释通过检查染色强度,获得一系列的稀释的抗体1:1000 1:50。消极的控制由遗漏的主要抗体。
洗后Tris-base缓冲盐水(TBS, pH = 7.4)的测试和控制幻灯片是孵化15分钟Powervision post-antibody屏蔽解决方案(Immunovision技术,戴利城、钙、美国)。幻灯片被清洗和孵化Powervision聚合辣根过氧化物酶的轭合物(Immunovision技术)和部分沾3,3′-diaminobenzidine tetrahydrochloride(σ,Zwijndrecht NL)发色体,与迈耶的苏木精复染色,视觉效果与光学显微镜。
免疫组织化学的定量评分分析
在筛选之前,部分编码,以便临床的观察人士不知道细节的情况下学习。VEGF的表达、Flt-1和KDR / Flk-1分析使用视觉评分法半定量的分数从0到3(0 =没有染色;1 =适度染色;2 =强烈染色;3 =非常强烈的染色)如前所述。8日,19日,20.23整个组织块的研究,取得了在同一放大。VEGF的染色强度、Flt-1和KDR / Flk-1支气管和细支气管气道和肺泡实质是由两个独立的观察者盲目得分都不知道的情况下研究的临床资料。错误之间的内部和观察员检查相关表达式使用皮尔逊的成绩分析和相关性非常高,从0.8到0.9。
支气管的气道染色评估支气管上皮,粘膜微脉管系统,支气管壁黏膜下血管,ASM细胞,巨噬细胞在支气管气道壁。周围肺组织中VEGF及受体的染色分析细支气管和肺泡上皮细胞,细支气管ASM细胞,细支气管和肺泡巨噬细胞。脉管系统的外围肺进一步细分为更大的肺血管与细支气管相关航空公司和小血管位于肺泡内的实质。在每个的VEGF及受体染色内皮,内层的,内侧VSM细胞评估。由于转换增长factor-β1(TGF-β1)也可能导致上皮细胞VEGF的表达,25日,26我们检查了上皮VEGF表达之间的相关性在这项研究中,上皮TGF-β1表达式从我们先前的研究之一。20.研究使用的相同的病人组和染色进行相邻或附近区域。
统计分析
数据分析使用未配对的双尾学生的统计学意义t在适当的地方测试和非参数Mann-Whitney测试。VEGF及其受体的表达数据表示为(SE)的意思。VEGF及其受体的染色不同的隔间与FEV相关1利用皮尔森相关分析。差异与p⩽值0.05被认为是具有统计学意义。
结果
临床特点
所有受试者的临床和肺功能特点包括在研究如表1所示。定义,FEV COPD组减少了1和FEV1/ FVC值(p < 0.001),如前面描述的那样。19 -23受试者在两组在年龄和吸烟状况没有显著差异(包年)或使用类固醇。
Immunolocalisation的VEGF、Flt-1和KDR / Flk-1
支气管气道
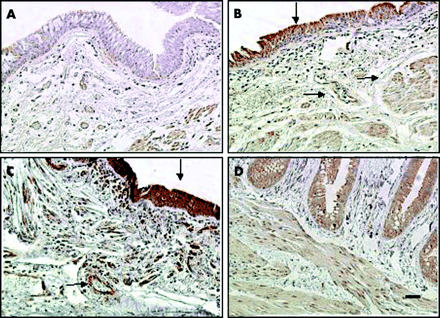
VEGF表达non-COPD中央航空公司的例子和COPD受试者如图1所示a和B,而图1 c和D(取自COPD受试者)显示,VEGF受体和KDR / Flk-1 Flt-1分别。在航空公司、VEGF、KDR / Flk-1和Flt-1在支气管上皮局部和ASM细胞,支气管黏膜和黏膜下层的微脉管系统、炎症细胞(主要是巨噬细胞)的所有课程模拟(图1)。在血管壁,VSM细胞VEGF阳性,Flt-1和KDR / Flk-1虽然内皮细胞VEGF蛋白但没有染色阳性Flt-1和KDR / Flk-1(图1)。
免疫组织化学的本地化(A, B) VEGF、KDR (C) / Flk-1,和(D) Flt-1支气管组织从non-COPD (ex)吸烟对象(A)和慢性阻塞性肺病患者(B, C, D)。免疫反应性的VEGF、KDR / Flk-1和Flt-1局部支气管上皮细胞、气道平滑肌(ASM)细胞,巨噬细胞,内皮细胞和血管平滑肌细胞(VSM)。颜色是3,3-diaminobenzidine tetrahydrochloride(涂)色原布朗(颜色)和迈耶的苏木精复染色。箭头表示网站VEGF的积极性,Flt-1或KDR / Flk-1。原来放大×100;酒吧= 50μm规模。
评估VEGF的强度、Flt-1和KDR / Flk-1表达各种支气管气道隔间,一个视觉评分方法如前所述。8日,19日,20.23VEGF表达在慢性阻塞性肺病患者的支气管ASM细胞高于那些non-COPD科目(1.6倍,p < 0.01),但不是在支气管上皮细胞和巨噬细胞(图2)。在中央航空公司的COPD患者,VEGF染色更强烈的VSM微脉管系统的支气管粘膜固有层)(1.7倍,p < 0.001)和支气管VSM黏膜下层(1.4倍,p < 0.01,图2)比non-COPD科目。没有观察到显著差异水平的KDR的表达/ Flk-1和Flt-1慢性阻塞性肺病和non-COPD科目之间(图2 b和C,分别)。在所有科目VEGFR-2 (KDR / Flk-1)表达式比VEGFR-1更强烈(Flt-1)表达,除了支气管微血管的内皮细胞和巨噬细胞在支气管可比(图2 b和C)。
VEGF的表达(A)、(B) KDR / Flk-1和(C) Flt-1蛋白质在不同类型的细胞在支气管航空公司使用视觉评分。免疫染色分数范围从0(无染色)到3(非常强烈的染色)。开启和关闭酒吧从对象表示的意思是数据没有和慢性阻塞性肺病,分别。数据意味着(SE)。星号表示差异显著(p < 0.05,学生的t测试)与non-COPD科目。Epi、支气管上皮细胞;MV,支气管粘膜微血管;VSM出生,支气管黏膜下层血管平滑肌细胞;ASM,气道平滑肌;Mφ,巨噬细胞。
细支气管气道
图3展示了从non-COPD周围肺组织,COPD受试者对VEGF染色(图3 a和B) KDR / Flk-1(图3 c和D)和Flt-1(图3 e和F)。在细支气管上皮细胞VEGF(1.5倍,p < 0.001,图4)和Flt-1表达式(1.4倍,p < 0.04,图4 c)增加COPD患者与non-COPD主题而染色KDR / Flk-1持平在病人组(图4 B)。ASM细胞显示略细支气管地区VEGF表达增加(1.3倍,p < 0.05),而两个受体的表达在两组病人保持不变。然而,KDR的表达/ Flk-1比Flt-1更强烈的在所有的病人(图4 b和C)。增加较大的肺动脉中VEGF的表达与细胞内膜和中细支气管气道的特点是1.7倍和1.3倍,分别(p < 0.05,图4),慢性阻塞性肺病和控制对象,而内皮细胞不表达VEGF。KDR / Flk-1表达增强的细胞内皮细胞和内膜的内侧VSM(分别为1.3、1.9和1.5倍,p < 0.02,图4 b);Flt-1表达内皮细胞中对应的值为1.7倍(p < 0.03,图4 c)。在两个病人组内膜的VSM细胞染色少2 - 3倍比内侧VSM细胞VEGF,强烈Flt-1和KDR / Flk-1。此外,血管Flt-1低于KDR表达/ Flk-1和VEGF表达的研究血管壁区域(p < 0.002,图4)。在细支气管巨噬细胞VEGF染色(1.5倍,p < 0.001,图4),在COPD受试者高于non-COPD主题,而对巨噬细胞的染色Flt-1或KDR / Flk-1在细支气管气道和VEGF表达,Flt-1,或KDR / Flk-1肺泡地区保持不变(图5)。
免疫组织化学的本地化(A, B) VEGF、KDR (C, D) / Flk-1,和(E, F) Flt-1外围组织从non-COPD (ex)吸烟对象(A, C, E)和慢性阻塞性肺病患者(B, D, F)。免疫反应性的VEGF, Flt-1,和KDR / Flk-1局部细支气管和肺泡上皮细胞、气道平滑肌(ASM)细胞,巨噬细胞、内皮细胞和内膜/中血管平滑肌细胞(VSM)。颜色是3,3-diaminobenzidine tetrahydrochloride(涂)色原布朗(颜色)和迈耶的苏木精复染色。Flt-1,箭头表示网站的积极性VEGF和KDR / Flk-1。原来放大×100;酒吧= 50μm规模。
VEGF的表达(A)、(B) KDR / Flk-1和(C) Flt-1蛋白质在不同细胞类型的细支气管气道和相关肺动脉使用视觉评分。开启和关闭酒吧从对象表示的意思是数据没有和慢性阻塞性肺病,分别。数据意味着(SE)。星号表示差异显著(p < 0.05,学生的t测试)与non-COPD科目。Epi,细支气管上皮细胞;电子商务,内皮细胞;VSM int, VSM地中海,内层的内侧血管平滑肌细胞;ASM,气道平滑肌细胞;Mφ,细支气管巨噬细胞。
VEGF的表达(A)、(B) KDR / Flk-1和(C) Flt-1蛋白质在不同细胞类型在肺泡实质和肺血管使用视觉评分。开启和关闭酒吧从对象表示的意思是数据没有和慢性阻塞性肺病,分别。数据意味着(SE)。星号表示差异显著(p < 0.05,学生的t测试)与non-COPD科目。Epi,细支气管上皮细胞;电子商务,内皮细胞;VSM int, VSM地中海,内层的内侧血管平滑肌细胞;Mφ,细支气管巨噬细胞。
肺泡实质
染色的肺泡上皮细胞(I型和II)对慢性阻塞性肺病更强烈比non-COPD控件(1.5倍,p < 0.0001,图5)。KDR / Flk-1和Flt-1表达式没有改变在肺泡上皮细胞(图5 b和C)。VEGF表达增加的细胞内膜和中VSM(1.5和1.7倍,p < 0.01,图5)肺泡肺小血管的区域;KDR / Flk-1对应的值分别为2.0和1.8倍,分别(p < 0.02,图5 b)。KDR的表达/ Flk-1和Flt-1增加小肺血管内皮细胞在肺实质(分别为1.7和2.1倍,p < 0.001,图5 b和C)。
染色和临床数据之间的相关性
我们检查了FEV之间的关系1值两组病人和VEGF染色分数,Flt-1和KDR / Flk-1在调查地区。支气管气道FEV1值呈负相关,VEGF染色分数在粘膜微脉管系统(r=−0.65;p < 0.001,图6 a)和ASM细胞(r=−0.45;p < 0.01,图6 b)如果所有对象进行分析。细支气管上皮VEGF染色分数(r=−0.67;p < 0.001,图6 c)和内侧VSM细胞较大的肺动脉与细支气管相关航空公司(r=−0.50;p < 0.01,图6 d)也显示一个FEV的负相关1总组值。此外,在内侧VSM细胞VEGF表达与KDR / Flk-1表达式肺动脉内皮细胞(r= 0.41;p < 0.01)以及小肺泡血管(r= 0.48;p < 0.01)。此外,我们发现相关性KDR的表达模式/ Flk-1和Flt-1肺动脉内皮细胞(r= 0.67;p < 0.001)以及肺泡血管(r= 0.80;p < 0.0005)。
相关性与FEV1预测(%)(A)微血管的VEGF蛋白表达(MV)支气管粘膜,(B)支气管气道平滑肌细胞(ASM), (C)细支气管上皮细胞(Epi),和(D)内侧血管平滑肌细胞(VSM)肺动脉与细支气管相关航空公司。相关评估的患者组(non-COPD和慢性阻塞性肺病)相结合。相关系数(r)获得了使用线性回归(Pearson)的分析。
我们还研究了上皮VEGF表达之间的相关性从当前研究和上皮TGF-β1表达式从我们先前的研究之一。20.在细支气管上皮皮尔森的分析揭示了VEGF水平之间存在显著的正相关蛋白质和TGF-β1蛋白(r= 0.55;p < 0.004)和VEGF蛋白水平和TGF-β之间1信使rna表达(r= 0.45;p < 0.02)。在肺泡上皮VEGF蛋白水平与TGF-β显著相关1只mRNA表达(r= 0.58;p < 0.002),但不是TGF-β1蛋白质含量(r= 0.31;p < 0.12)。
讨论
这项研究的结果表明,慢性阻塞性肺病与VEGF的表达增加有关支气管、细支气管,在细支气管和肺泡上皮细胞和巨噬细胞以及ASM和VSM细支气管和肺泡细胞区域。KDR / Flk-1和Flt-1增加COPD患者与non-COPD受试者在内皮细胞相比,内膜和中VSM细胞较大的肺动脉和较小的口径肺泡血管。有趣的是,我们观察到存在显著负相关关系VEGF和FEV1在支气管粘膜微血管和ASM细胞,细支气管上皮,内侧VSM细胞较大的肺动脉与细支气管相关航空公司。TGF-β1细支气管上皮细胞的染色也与VEGF在同一病人如我们之前所述的研究。20.
我们的研究结果表明,VEGF及其受体Flt-1和KDR / Flk-1局部在航空公司和血管内皮和上皮细胞以及平滑肌细胞,此外,在各种炎症细胞(巨噬细胞为主)。VEGF及其受体在肺部的本地化的病人组与先前的报告中描述了一个类似的染色模式在人类发展中肺,正常成人的肺,肺气肿。17日,27日,28与笠原等28谁表明,VEGF及其受体VEGF-R2减少肺总提取物的气性肺以ELISA和免疫印迹分析,我们发现,在肺泡上皮和内皮细胞空间和远航空公司大部分都是非常积极的VEGF和KDR / Flk-1在慢性阻塞性肺病患者。在我们的研究中,病人可以被视为有轻度至中度慢性阻塞性肺病而笠原研究的肺部等完全是气肿。
我们的发现活细胞VEGF表达增加的数量显示在一定程度上成功的尝试修复持续损伤,并可能对血管重塑的贡献和参与建立和维护功能的血液气体接口,成熟,生存和毛细血管内皮细胞的增殖。29日在成人肺VEGF及其受体系统的维护可能导致内皮和上皮细胞生存能力以应对伤害。31日
有趣的是,免疫反应性在内膜和中VEGF VSM细胞和Flt-1和KDR / Flk-1肺动脉内皮细胞和肺泡血管在COPD患者增加。VEGF表达的最高水平在内侧扫描仪观察肺血管细胞和内皮细胞的KDR / Flk-1动脉直径大约200μm,扮演着一个重要的角色在肺血压调节和血管阻力。14日,30.肺缺氧与绝对压力增加和高血压病理生理条件,已经被证明可以增加细胞VEGF的表达特点。13日,14KDR的封锁/ Flk-1与闭塞的血管内皮细胞增殖相关pre-capillary小动脉异常血管发展,与此同时,感应的毛细血管内皮细胞死亡的凋亡,导致死亡在老鼠胚胎相似主题原发性肺动脉高压。13日,18日,31日,32在后续的学习态度等33发现,VEGFR-2封锁后,细胞凋亡成为主流区域的氧化应激和细胞凋亡封锁广谱半胱天冬酶抑制剂显著降低氧化应激标志物的表达。33缺氧、氧化应激和肺动脉高压病理特征是经常会出现在晚期慢性阻塞性肺病患者,和VEGF表达增加可能导致增加甚至异常在肺血管内皮和VSM细胞扩散。这表明一个潜在作用内皮细胞分裂素在外围血管生成和血管重塑,可能结合其他平滑肌FGF-2等特定生长因子PDGF和TGF-β1。12日,34 -36
我们观察VEGF表达增加,不变Flt-1和KDR / Flk-1表达细支气管和肺泡上皮细胞以及在ASM细胞在慢性阻塞性肺病患者。之前就有报道称,VEGF的表达和受体KDR / Flk-1也可以刺激如缺氧、氧化应激诱导的细胞除了内皮细胞,上皮细胞和平滑肌细胞等。33岁的37岁的38在最近的一份报告中金泽和同事39表明,VEGF水平患者诱导痰中更高的支气管炎和肺气肿患者比正常对照组低。此外,支气管炎患者VEGF水平与FEV呈负相关1值。数据的逆相关各种气管和血管细胞的VEGF水平与本报告一致。在我们的研究对象与慢性阻塞性肺病患者不能分为慢性支气管炎或肺气肿。此外,人类物质的性质研究(痰)由金泽及其同事的研究不同于我们的肺组织免疫组织化学本地化和量化VEGF及其受体。
最近的研究表明,VEGF表达增加支气管和肺泡上皮细胞并诱导α-SMA积极(myo)成纤维细胞在博来霉素诱导纤维化在老鼠和人类的肺纤维化患者,这些纤维地区人口稠密,肥大细胞和巨噬细胞增加KDR / Flk-1表达式。15日,17我们先前已经表明,肥大细胞和巨噬细胞是增加细支气管气道上皮细胞和表达TGF-β的人数在增加1在细支气管和肺泡上皮细胞在慢性阻塞性肺病患者。20.21我们发现一个重要的VEGF表达在上皮细胞和TGF-β之间的相关性1言论发表之前在同一病人组,20.这表明VEGF / Flk-1制度可能结合TGF-β吗1代表一个分子myofibroblasts炎症细胞聚集和扩散之间的联系。
VEGF表达的增加和TGF-β1细支气管上皮细胞和巨噬细胞和KDR的存在/ Flk-1 Flt-1建议网站的启动机制,保持纤维化烟草引起的损伤导致COPD气道重塑。吸入糖皮质激素可能降低VEGF的表达水平,40但这并不是在我们的研究中,没有一个病人接受吸入皮质类固醇治疗,除了四个接受糖皮质激素围手术期。必须注意推断表达式的数据根据每组只有14个病人,但VEGF表达增加的趋势在支气管气道和KDR / Flk-1支气管和细支气管气道平滑肌可能达到意义如果更多的患者包括在内。
总的来说,这些发现强烈建议一个角色对VEGF及其受体在气管和血管重塑,从而在COPD气道阻塞的发展。目前我们所知的气管和血管重塑在慢性阻塞性肺病的发展远未完成。很可能,许多增长因素包括VEGF-play肺和血管生存能力的重要作用和修复组织损伤。航空公司增加肺VEGF表达,实质衬里和小直径在COPD肺血管可能反映了部分失败的尝试刺激组织修复机制由烟草引起的损伤引起的。
确认
作者感谢Drs J Stolk和J H M van Krieken帮助临床资料和病理的分析,分别为她和夫人Willems-Widyastuti技术援助。
引用
脚注
这项研究的部分支持由荷兰哮喘基金会(赠款# 97.73和95.49)。
柜和WIdB贡献了同样的工作。
相关的文章
- 电视广播