条文本
文摘
客观的肺炎占全球死亡人数最多的传染病。肠道微生物群支持局部粘膜免疫和日益被视为一个重要调制器的系统性免疫系统。肠道微生物群的精确作用在细菌性肺炎,然而,是未知的。在这里,我们调查的功能在宿主防御肠道微生物群链球菌引起的肺炎感染。
设计我们耗尽C57BL / 6小鼠肠道微生物群,随后他们鼻内感染肺炎链球菌。然后我们进行生存和粪便微生物群移植(FMT)实验和测量参数的炎症和肺泡巨噬细胞全基因组反应。
结果我们发现肠道微生物群保护主机在肺炎球菌肺炎、所反映的细菌传播,增加炎症、器官损伤和死亡率microbiota-depleted老鼠与控制。FMT在小鼠肠道microbiota-depleted正常化肺部细菌计数和肿瘤坏死factor-α肺炎球菌感染后6 h和白细胞介素- 10”水平。肺泡巨噬细胞的全基因组映射显示upregulation代谢途径的缺乏健康的肠道微生物群。这upregulation与一个改变细胞响应,反映在脂多糖和lipoteichoic酸减少响应能力。与控制相比,肺泡巨噬细胞来源于肠道microbiota-depleted老鼠显示吞噬能力降低肺炎链球菌。
结论本研究确定了肠道菌群作为一个保护中介在肺炎球菌肺炎。肠道微生物群主要提高肺泡巨噬细胞的功能。新的治疗策略可以利用gut-lung轴在细菌感染。
- 细菌感染
- 细菌的发病机理
- 免疫学
- 脓毒症
- 肠道微生物
这是一个开放的分布式条188滚球软件依照创作共用署名非商业性(4.0 CC通过数控)许可证,允许别人分发,混音,适应,建立这个工作非商业化,和其派生作品在不同的条款进行许可,提供了最初的工作是正确地引用和非商业使用。看到的:http://creativecommons.org/licenses/by-nc/4.0/
来自Altmetric.com的统计
本研究的意义
已知在这个问题上是什么?
肠道微生物群可以提高当地防御肠内的病原体,也被认为影响系统性免疫。
肠道微生物群的代谢膳食纤维影响小鼠过敏性炎症的严重程度。
肠道微生物群的作用在宿主反应细菌性肺炎是不明确的。
有什么新发现吗?
本研究描述了肠道菌群的作用在宿主防御细菌性肺炎。
老鼠在肠道微生物群增加了细菌传播,炎症、器官衰竭和加速死亡率相比,控制感染链球菌引起的肺炎,这表明肠道菌群作为宿主抵御肺炎球菌病的保护性因素。
粪便微生物群移植到小鼠肠道microbiota-depleted导致肺部细菌计数的正常化和肿瘤坏死factor-α肺炎球菌感染后6 h和白细胞介素- 10”水平。
肠道微生物群显著影响肺泡巨噬细胞内代谢途径,它与一个改变细胞的响应能力。microbiota-depleted小鼠巨噬细胞吞噬能力减弱肺炎链球菌并展示对lipoteichoic酸和脂多糖降低细胞反应。
它会如何影响临床实践在可预见的未来吗?
我们的数据确定一个gut-lung轴在感染和建立肺免疫调节机制通过肠道微生物群。这些结果强调,广谱抗生素和破坏肠道菌群可能减少先天免疫防御感染。新的治疗方法来治疗重症肺炎可能关注gut-lung轴在细菌感染。
介绍
肺炎占全球死亡人数最多的传染病。1,2据估计,每年近1200万名儿童单独对重症肺炎住院。2链球菌引起的肺炎革兰氏阳性细菌,它生活上呼吸道,是社区获得性肺炎的最常见原因,全球发病率和死亡率的一个重要原因。3,4日益严重的细菌耐药性有复杂的治疗肺炎球菌感染。因此,迫切需要扩大我们的知识引起的重症肺炎的发病机制这种常见的病原体。
多年来,这是假设在危重病人肠起着不利的作用通过促进全身炎症和感染。5最近,然而,细菌的肠道microbiota-consisting超过细胞的总数在人类身体成为积极的球员在宿主防御系统,支持粘膜免疫和潜在的系统性免疫调节。6-13的肠道菌群可能是深远的临床意义,特别是对于重症监护医学,因为那里的大多数病人使用抗生素治疗,具有普遍的和长期的对他们的肠道菌群的影响。9,14肠道微生物群在细菌性肺炎的作用是什么,然而,仍然是难以捉摸的。
我们假定的肠道微生物群支持主机防御肺炎链球菌。因此,我们减少小鼠的肠道微生物群,研究了随后的感染肺炎链球菌。我们提供的证据表明,肠道菌群作为宿主防御肺炎球菌肺炎和保护性因素表明,肠道微生物群主要提高肺泡巨噬细胞的功能。我们的研究提供一个新颖的治疗策略的基础,利用gut-lung轴在细菌感染。
结果
肺炎球菌肺炎期间肠道微生物群的保护作用
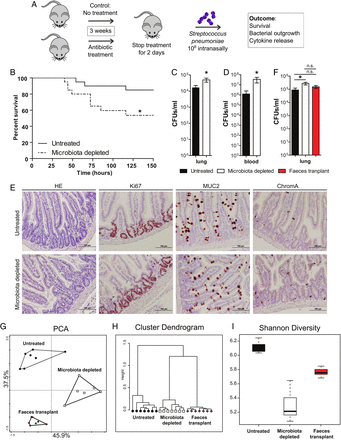
首先了解肠道微生物群在细菌性肺炎中所起的作用,我们首先野生型小鼠广谱抗生素治疗(氨苄青霉素、新霉素、甲硝唑和万古霉素)在他们的饮用水消耗肠道微生物群。7然后,我们给与他们的挑战肺炎链球菌(106集落形成单位(CFU);图1A)。Microbiota-depleted小鼠加速死亡率肺炎链球菌感染(图1B)。支持这一发现,肠道microbiota-depleted小鼠肺部细菌负荷增加后6 h肺炎链球菌挑战与同年龄组和肠道微生物群小鼠血液中有更多的细菌感染后48 h (图1C, D)。因为对抗入侵的病原体的能力很大程度上取决于当地的炎症反应的功效,15我们测量了大量的肺细胞因子和趋化因子。白介素(IL) 1β,IL - 6和处于增加,而肿瘤坏死因子(TNF) -α和IL - 10水平下降后6 h鼻内肺炎链球菌肠道感染microbiota-depleted老鼠与控制(表1)。在之后的时间点肺细胞因子水平之间的相似组(表1)。
肺炎球菌肺炎期间肠道微生物群的保护作用。(一)实验设计。八国集团野生型小鼠与广谱抗生素治疗3周(氨苄青霉素、新霉素、甲硝唑和万古霉素)在他们的饮用水与未经处理的控制。两天治疗后小鼠收到1×10的鼻内的挑战6集落形成单位(CFU)链球菌引起的肺炎。随后,老鼠生存,细菌产物和细胞因子释放测定在不同的时间点肺炎链球菌感染。(B)与广谱抗生素治疗组小鼠的生存与未经处理的对照相比在鼻内挑战1×106CFU的肺炎链球菌。(C)肺部细菌计数后6 h肺炎链球菌感染治疗(黑色)和microbiota-depleted老鼠(白色)。(D)血液细菌计数后48 h肺炎链球菌感染治疗(黑色)和microbiota-depleted老鼠(白色)。(E)代表的小肠部分未经处理(上层行)和microbiota-depleted(低行)小鼠展示完整的上皮完整性与他走时,Ki67(在地下扩散限制),MUC2杯状细胞分化和ChromograninA(神经内分泌细胞分化)染色两组。(F)的粪便微生物群在肺移植肠道microbiota-depleted老鼠细菌计数后6 h鼻内肺炎链球菌感染。(G)的大小抗生素协议减少肠道微生物群是由系统芯片中微生物群组成样本集群基于主成分分析(PCA), (H)皮尔森集群和香农多样性指数(I)。组大小是8 - 12 /组;结果显示为±SEM手段;n表示不重要;* p < 0.05。
粪便微生物群移植肠道microbiota-depleted老鼠恢复肺细菌清除率和TNF-α和il - 10水平后早期肺炎球菌感染
我们接下来旨在验证死亡,细菌负荷和细胞因子发现肠道微生物群的依赖。因此,我们研究了影响口头管理从健康小鼠肠道菌群microbiota-depleted小鼠在接受者的反应肺炎链球菌感染。我们首先建立了广谱抗生素治疗不影响肠道架构或上皮完整性(图1E)。此外,我们测试了肺障碍是否受损在缺乏健康的微生物群通过测量支气管肺泡灌洗液(BALF)蛋白质含量。没有观察到BALF蛋白质含量的差异后抗生素治疗(见在线补充图S1)。在与我们的假设的通信中,粪便微生物群移植(FMT)肠道microbiota-depleted老鼠可以恢复减少细菌清除后的肺癌早期肺炎球菌感染(图1F)。此外,FMT导致TNF-α正常化和il - 10水平在肺部感染后6 h,比得上non-depleted控制老鼠(表2)。然而,粪便移植的数量没有明显影响肺炎链球菌出现在血液与antibiotic-treated相比老鼠或控件(数据未显示)也没有显著影响il - 1、il - 6或处于水平(表2)。的大小来评估我们的抗生素7减少肠道细菌的数量,我们评估了小鼠粪便使用系统发育的微阵列分析16 000肠道小亚基核糖体RNA序列和多样性指数决定。16,17抗生素治疗导致了微生物多样性明显下降,显著逆转的移植正常粪便(图1胃肠道)。无监督聚类和主成分分析的样品之间显示一个明确的分区控制,antibiotic-treated和粪便移植组,这可以解释数据方差(总额的83.4%图1胃肠道)。综上所述,这些数据建立肠道微生物群的损耗会导致有害的主机对肺炎球菌肺炎所反映的细菌数量增加和减少的生存。
肠道微生物群中防止器官损伤肺炎链球菌全身败血症
确定肠道微生物群在肺的保护作用抗菌宿主防御扩展到器官损伤,我们半定量的得分肺组织学幻灯片从肠道microbiota-depleted老鼠和控制后在不同的时间点肺炎链球菌挑战。所有被感染的老鼠显示组织学证据严重的肺炎。符合观察到的细菌产物增加,感染后6 h microbiota-depleted老鼠显示早期肺和更多炎症与控制相比,通过增强间质炎症,endothelialitis和水肿(图2A)。这种差异在肺器官损伤更加明显在24和48 h (图2B, C)。因为招募白细胞传染性网站是一个重要的步骤在宿主的防御肺炎,3接下来我们分析Gr-1中性粒细胞在肺组织染色,发现增加流入肠道microbiota-depleted老鼠(见在线补充图S2)。损耗的肠道微生物群中肺炎链球菌感染也导致了一个增强的有害的系统性炎症反应。虽然没有系统性的细胞因子水平的差异(TNF-α、il - 6、il - 10、il - 12 IFN-γ和MCP-1)可以观察各组(请参见图S3)在线补充,48 h后感染肠道microbiota-depleted小鼠增强(肝组织炎症和损害图2D, E)和肝脏损伤所反映的血浆浓度的天冬氨酸转氨酶升高,丙氨酸转氨酶和乳酸脱氢酶(图2外:我)。肾脏功能,以尿素和肌酐,并不影响(图2F和看到在线补充图S4)。这些结果表明,肠道微生物群防止器官期间的伤害肺炎链球菌全身败血症。
肠道微生物群中防止器官衰竭链球菌引起的肺炎全身败血症。肺的幻灯片(a - c)代表未经处理(左)和microbiota-depleted(右)小鼠感染1×106集落形成单位(CFU)肺炎链球菌通过鼻内的路线和安乐死在表示时间点(6、24和48小时)之后评估肺部炎症和肺总组织病理学评分(见材料与方法)。他走时染色;原始的放大,×100。(D和E)肝脏和脾脏组织学显示感染后48 h。他走时染色;原始的放大,200×肝、脾×100。(F)系统性血尿素氮(BUN)、(G)天冬氨酸转氨酶(AST)、(H)丙氨酸转氨酶(ALT)和(I)乳酸脱氢酶(LDH)水平评估感染治疗后48 H(黑)和肠道microbiota-depleted老鼠(白色)。组每组大小是8;结果显示为±SEM手段;n表示不重要; *p<0.05 and **p<0.01.
肠道菌群的影响损耗的肺泡巨噬细胞转录组
因为它被描述的肠道菌群结构上主要来源于中性粒细胞的骨头可以杀死微生物,并提高自身的能力7我们进一步假定的肠道微生物群之间存在类似的轴和肺泡巨噬细胞,它们的主要协调器肺免疫反应后病原体入侵。4,15测试这个假设和定义肠道微生物群的机制发挥其保护作用肺炎期间,我们首先分析了全基因组转录在肺泡巨噬细胞反应。肺泡巨噬细胞与未感染但肠道microbiota-depleted老鼠和控制。损耗的肠道菌群有一个实质性影响肺泡巨噬细胞转录组:考虑多个comparison-corrected (Benjamini-Hochberg) p值,80个独特的基因被发现区分肺泡巨噬细胞来源于肠道microbiota-depleted老鼠和控件(图3)。创新路径分析发现浓缩superpathway的胆固醇生物合成和酵母甾醇生物合成标准信号通路(图3这些途径包括内B)基因Idi1、编码isopentenyl-diphosphate-delta-isomerise-1和Acat2、编码acetyl-Coenzyme-A-acetyltransferase-2。这些转录组差异表明显著改变肺肺泡巨噬细胞的代谢状态后肠道微生物群的损耗。
肠道菌群的影响损耗的肺泡巨噬细胞转录组。(A)无监督的层次聚类热图重大调整(多重比较p < 0.05)差异表达基因治疗控制和肠道之间microbiota-depleted肺肺泡巨噬细胞。红色表示表达增加;蓝色表示表达下降。(B)堆叠柱形图描绘了大大丰富了典型信号通路(独创性通路分析)和表达模式。日志(b - h) p,负对数转换Benjamini-Hochberg-adjusted费舍尔测试p值。比,比率输入通路基因的基因。红色表示肠道microbiota-depleted肺泡巨噬细胞表达增加;绿色表示降低肠道microbiota-depleted肺泡巨噬细胞表达。
肠道微生物群主要提高肺泡巨噬细胞的功能
胆固醇生物合成中起着重要作用的抗菌效应肺泡巨噬细胞的功能。18,19封锁的胆固醇合成显著抑制那些高胆固醇的功能膜筏和吞噬作用的结果铜绿假单胞菌肺泡巨噬细胞。19肺泡巨噬细胞吞噬作用的主要宿主防御机制在肺炎球菌感染和肺炎。4,15鉴于观察肠道微生物群的损耗对胆固醇生物合成途径的影响,我们接下来研究肠道微生物群的损耗是否改变的吞噬作用肺炎链球菌肺泡巨噬细胞。要做到这一点,我们收获主要从感染肠道microbiota-depleted肺泡巨噬细胞和控制相比,老鼠和内在化CFSE-labelled的能力肺炎链球菌。我们发现肺泡巨噬细胞来源于肠道microbiota-depleted小鼠吞噬能力减弱肺炎链球菌与控制相比,这可以解释的体内表型观察小鼠肠道microbiota-depleted (图4)。肚microbiota-dependent吞噬依赖隔间:遗传中性粒细胞(图4B),但不是腹膜巨噬细胞(图4C)源自microbiota-depleted老鼠相同的缺陷在其吞噬能力与控制。肺泡巨噬细胞的响应能力来源于肠道microbiota-depleted老鼠对lipoteichoic酸(LTA);图4D, E)和脂多糖(LPS;图4F, G)也显著减少与控制细胞因子的释放。肠道微生物群的观察效果依赖舱;全血(图4H),但不是腹膜巨噬细胞来源于肠道microbiota-depleted小鼠显示出减少响应向本公司或有限合伙人与控件(相比图4我)。综上所述,这些数据证实,肠道微生物群提高主要肺泡巨噬细胞功能和一个平静的肠道微生物群提高响应性细菌毒性因子和增加吞噬能力。
肠道微生物群主要提高肺泡巨噬细胞的功能。肺泡巨噬细胞(A)能力来源于肠道microbiota-depleted老鼠(白色)和控制(黑)小鼠吞噬链球菌引起的肺炎体外30分钟。(B)能力的遗传损伤中性粒细胞来源于肠道microbiota-depleted老鼠(白色)和控制(黑)小鼠吞噬肺炎链球菌体外30分钟。(C)容量腹膜巨噬细胞来源于肠道microbiota-depleted老鼠(白色)和控制(黑)小鼠吞噬肺炎链球菌体外10到30分钟。(D和E)响应性肺泡巨噬细胞来源于肠道microbiota-depleted老鼠(白色)和控制(黑)小鼠对lipoteichoic酸(LTA)和(F和G)脂多糖(LPS)白介素6 (IL)和肿瘤坏死因子(TNF) -α生产。(H) TNF-α生产全血来自肠道microbiota-depleted老鼠(白色)和控制(黑)小鼠与LPS刺激后。(我和J) LTA-stimulated腹膜巨噬细胞来源于肠道microbiota-depleted老鼠(白色)和控制(黑色)。(K和L) LPS-stimulated腹膜巨噬细胞来源于肠道microbiota-depleted老鼠(白色)和控制(黑色)。组每组大小是8;结果显示为±SEM手段;n表示不重要;* * * p < 0.05, p < 0.01, * * * p < 0.001。
讨论
每年350万人的死亡是由于肺炎,虽然这个数字可能低估,因为死于败血症和死亡归因于其他条件(如癌症和阿尔茨海默氏症),肺炎是终端事件分别编码。1,20.脓毒症和肺炎是最常见的原因肺炎链球菌是最经常孤立的病原体肺炎导致败血症。最近突破我们对肠道微生物的作用的理解健康和疾病都可以因此对呼吸道和危重病医学产生相当大的影响。9,11 - 13在这里,我们表明,肠道微生物群中起着保护作用肺炎链球菌肺炎就是明证增加细菌传播,炎症、器官衰竭和死亡microbiota-depleted老鼠与控制。FMT肠道microbiota-depleted老鼠导致肺部细菌计数和TNF-α和il - 10水平正常化后6 h肺炎球菌感染。肠道微生物群主要提高肺泡巨噬细胞功能的细胞响应LTA有限合伙人和吞噬能力肺炎链球菌。
我们的工作强调了概念,肠道微生物的大型社区不仅有利于本地主机防御感染,但同时调节免疫反应系统网站。7,9,11 - 13,21克拉克等是最早证明系统可以增强先天免疫反应易位肠microbiota-derived产品。骨骨髓来源中性粒细胞从肠道microbiota-depleted老鼠不太能够杀死肺炎链球菌和金黄色葡萄球菌体外。7同样,肠道microbiota-primed肺泡巨噬细胞显示增加了活性氧species-mediated杀害肺炎克雷伯菌。22在这条线,微生物群可以调节免疫防御呼吸道感染甲型流感病毒。23,24Trompette等11建立gut-lung轴在过敏性气道疾病的存在表明肠道微生物群的代谢的膳食纤维影响过敏炎症的严重程度。肺巨噬细胞、肺泡巨噬细胞,居民被认为形成时的第一道防线对肺病原体入侵。4,15我们研究肠道菌群的影响损耗的肺泡巨噬细胞转录组。这使我们能够证明人类肠道微生物群的显著影响肺泡巨噬细胞内代谢途径,它与一个改变细胞responsiveness-as反映吞噬能力减弱肺炎链球菌和降低细胞响应英国网球协会和有限合伙人。还有待建立,然而,肠道microbiota-derived负责这种效果的因素。此外,我们没有调查粪便移植能否扭转特定转录组变化,受损的免疫效应功能的肺泡巨噬细胞和中性粒细胞涌入我们的模型。最后,它还有待确定的观察影响肠道微生物群感染期间损耗肺炎链球菌也适用于其他重要病原体感染的肺炎。显然,需要建立这种独立的实验。
潜在的临床重要性是我们发现肠道微生物群中防止器官衰竭肺炎链球菌全身败血症。这是说明了加强肝脏和肝损伤小鼠肠道微生物群的鼻内感染前耗尽肺炎链球菌相比与控制。干预措施调节肠道中的微生物群组成取代微生物群或患者选择微生物产品有前途的新的治疗策略病危。9最近的一份报告描述了首次成功使用FMT治疗危重病人therapy-resistant败血症。25的发现乳杆菌危重病人管理是安全的和有效的与机械通气相关肺炎的预防进一步强调了针对肠道微生物群在pneumonia-derived脓毒症的治疗潜力。26
谨慎是必要的,当数据从老鼠实验推断人类疾病。这里使用小鼠模型的同质组实验动物的使用相同的基因型,性别和年龄(相对年轻的)暴露于一个控制细菌的挑战,而病人形成异质群体中多个因素修改疾病的结果,包括病原体暴露的程度、年龄、并发症、comedications和遗传组成。此外,需要注意的是,在肠道microbiota-depleted FMT老鼠没有反向细菌性肺炎的所有端点参数在我们的模型中。尽管有这些警告,现在目前的研究描述了一个可能的作用调节肠道微生物群的本地和系统性主机对肺炎的临床相关的模型。我们的工作表明,肠道微生物群在宿主防御中起着保护作用美国肺炎全身的肺炎肺泡巨噬细胞的启动。这些结果强调,广谱抗生素和破坏肠道菌群可能减少先天免疫防御感染。我们的数据确定一个gut-lung轴在感染和建立肺免疫调节机制的肠道微生物群。
材料和方法
老鼠
特定的无菌C57Bl / 6小鼠从哈伦购买实验室。已知的肠道菌群组成的变化之间的内在C57BL / 6小鼠来自一个商业供应商是非常有限的。27后代和饮食是人类肠道微生物群组成的主要决定因素。28,29日实验组年龄和性别匹配,动物研究所设在阿姆斯特丹(咏叹调)学术医疗中心的设施设备在标准治疗。所有实验小鼠10到12周的年龄。
实验研究设计
肺炎是由鼻内接种1×106CFU肺炎链球菌D39如前所述。30 -为生存实验,小鼠检查每6 h直到死亡发生。收集样本,测定细菌生长和分析(包括病理和免疫组织化学)在网上所描述的补充文件。为了消耗肠道微生物群,老鼠用广谱抗生素治疗(氨苄西林1 g / L,σ;硫酸新霉素1 g / L,σ;甲硝哒唑1 g / L,赛诺菲-安万特和万古霉素0.5 g / L, Sandoz)饮用水中描述为3周。7两天后停止抗生素饮用水、小鼠接种肺炎链球菌。RNA制备从肺泡巨噬细胞和微阵列分析在线补充文件中描述。
粪便移植
从未经处理的小鼠粪便颗粒resuspended在PBS(1粪便颗粒/ 1毫升的PBS)。对于每一个实验,一些从不同的未经处理的小鼠粪便颗粒resuspended在PBS。总共有200μL resuspended池的粪便物质是由口腔填喂法对小鼠肠道microbiota-depleted抗生素治疗停止后连续4天;控制老鼠能有水单在此期间。33
微生物群分析
新鲜粪便颗粒得到老鼠的安乐死。样本立即冷冻和储存在−80°C。DNA使用修改后的重复执行隔离跳动的方法。34,3516 s rRNA基因扩增,体外转录和标签和杂交如前所述。17数据分析使用微生物R-script包在线补充文件中描述。
道德声明
机构的动物保健和使用委员会学术医疗中心,阿姆斯特丹大学进行审核和批准所有实验(身份证号码:DIX100121AE)。动物保健和使用协议坚持2010年9月22日欧洲指令(2010/63 /欧盟指令)除了2009年5月6日的指令(2009/41 / EC指令)。
统计分析
对比组利用克鲁斯卡尔-沃利斯首次演出单向方差分析(方差分析)测试;在显著差异的情况下,群体之间的差异进行了测试使用Mann-Whitney U测试(GraphPad棱镜5)。我们使用kaplan meier生存率较比较组之间的生存。统计上显著的差异表示如下:* p < 0.05;* * p < 0.01;* * * p < 0.001。线性模型方差分析是用来定义肺泡巨噬细胞转录受广谱抗生素治疗的影响。除非另有说明,错误发现rate-corrected p值(核反应能量)是用于定义全基因组的意义。
确认
感谢Marieke十边缘和Joost Daalhuisen技术支持和吉斯教授van den边缘(美国胃肠病学、学术医学中心、阿姆斯特丹大学)的富有成果的讨论。
引用
补充材料
-
补充数据
仅这个web文件已经由英国医学杂志出版集团从一个电子文件提供的作者(年代)和没有对内容进行编辑。
- 数据补充1——在线补充
脚注
贡献者套设计并做了实验,分析数据和写论文;WJW构思的想法,写了论文和监督研究项目;个基点,JML JJTHR、JDdB AJH,难以和CB。设计实验和分析数据;RdB FdSeM做实验;套个基点进行了生物信息学分析;WMdV TvdP提供建议和监督工作的一部分。
资金这项工作是支持的荷兰科学研究组织(NWO)和荷兰卫生研究发展组织(ZonMw)。
相互竞争的利益没有宣布。
出处和同行评议不是委托;外部同行评议。
相关的文章
- 评论