摘要
背景
当前2019年大流行性冠状病毒病(COVID-19)的爆发加剧了对有效治疗方法的严重需求。近年来,药物再利用不仅缩短了开发时间,而且节省了研发过程中的成本和精力,成为药物开发的一个重要契机。
摘要的主体部分
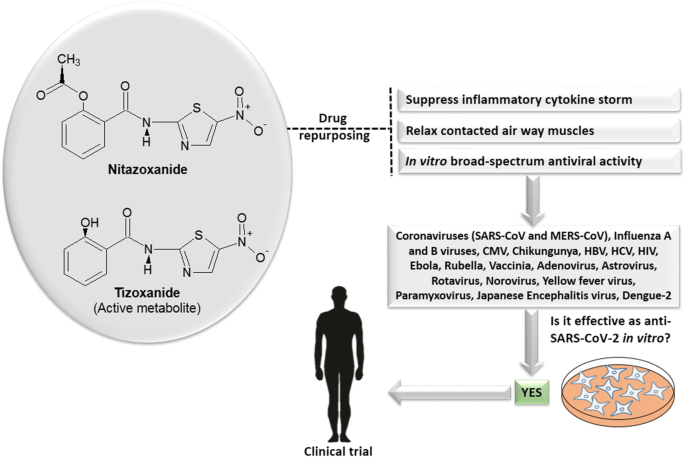
fda批准的抗寄生虫药物硝唑腈(NTZ)已被发现对不同的病毒感染具有抗病毒活性,如冠状病毒、流感病毒、丙型肝炎病毒(HCV)、乙型肝炎病毒(HBV)和其他病毒,这表明其作为广谱抗病毒药物的潜力。此外,最近有报道称NTZ展出了在体外在微摩尔浓度下抑制SARS-CoV-2。此外,NTZ抑制细胞因子的产生,这强调了其管理covid -19诱导的细胞因子风暴的潜力。此外,报道的NTZ对扩张极度收缩的气道的疗效可能有助于缓解covid -19相关症状。
简短的结论
所有这些发现,以及该药物的高安全性记录,使我们有兴趣敦促开展临床试验,以评估在COVID-19患者中使用该药物的潜在益处。因此,在这篇综述文章中,我们回顾了NTZ的抗病毒活性,并强调了其有前景的治疗作用,使药物值得临床试验。
背景
2019冠状病毒病(COVID-19)首次在中国武汉暴发[1,到2019年底。这种疾病的主要原因是一种新型乙型冠状病毒,被国际病毒分类委员会认定为严重急性呼吸综合征冠状病毒-2 (SARS-CoV-2) [2].冠状病毒属于冠状病毒目冠状病毒科。它们是包膜阳性单链RNA病毒。几种冠状病毒会感染人类和其他哺乳动物宿主。冠状病毒被分为四个不同的属(α、β、δ和γ),其中很少有α和β冠状病毒被认为会感染人类[3.].冠状病毒通常是人畜共患的;然而,SARS-CoV-2而非SARS-CoV和中东呼吸综合征冠状病毒(MERS-CoV)观察到有效的人际传播[4].截至2020年6月30日,世界卫生组织(世卫组织)记录的COVID-19病例超过1000万例,全球有近50万人死亡[5],表明COVID-19是一种严重威胁公共卫生的疾病。目前,既没有临床批准的抗病毒药物,也没有目前可用的抗病毒药物用于治疗冠状病毒。虽然瑞德西韦作为一种治疗COVID-19的抗病毒药物已进入人体临床试验,但仍迫切需要探索其他有效药物作为COVID-19的潜在治疗方法[6].近年来,药物再利用已成为药物开发的一个重要机遇,作为一种明智的策略,涉及识别目前批准或研究的超出其通常医学适应症范围的化合物的新适应症。该策略不仅节省了研发过程中的成本和精力,而且缩短了开发和安全评估的时间,具有重要意义。此外,它还提供了降低药物失效可能性的优势,特别是从安全性考虑,因为大多数药物在临床前或临床试验中证明其安全性后,会重新使用[7].Nitazoxanide (NTZ)在美国被批准作为一种抗寄生虫治疗腹泻和肠炎隐孢子虫种虫害和兰伯氏贾第虫2002年[8].它通过破坏线粒体呼吸作用来靶向宿主通路[9].关于NTZ的安全性,据报道,超过7500万患者(包括儿童)在上市后使用该药治疗寄生虫肠道感染,未观察到与该药相关的严重安全性问题。除了NTZ的抗寄生虫作用外,在体外对药物的评估显示,对广泛的厌氧革兰氏阳性和革兰氏阴性细菌以及复制和非复制菌株的抑制作用结核分枝杆菌[10].此外,NTZ的活性作为一种治疗艰难梭状芽胞杆菌疾病已被动物研究及临床试验证实[9].在治疗获得性免疫缺陷综合征(AIDS)合并乙型肝炎病毒(HBV)或丙型肝炎病毒(HCV)感染的隐孢子虫腹泻患者时,偶然怀疑NTZ的抗病毒作用[11].此后,人们对NTZ及其活性代谢物tizoxanide (TIZ)的抗病毒治疗潜力进行了广泛的研究。我们在这篇文章中的目的是列举NTZ的特殊抗病毒作用,并强调其对抗新型COVID-19的治疗潜力(图2)。1).
主要内容
硝唑胺和病毒感染
Nitazoxanide (NTZ)显示出对广谱病毒的活性,如表所示1.
硝唑腈和冠状病毒
冠状病毒是许多包膜、非分节的阳性RNA病毒,其特征是基因组大小非常大,约为27至34 kb。人类病毒HCoV-229E、HCoV-OC43、HCoV-NL63和HCoV-HKU1引起的呼吸道感染通常是轻度和自限性的,例如普通感冒。另一方面,当人类感染三种高致病性乙型冠状病毒,即SARS-CoV、MERS-CoV和最新的SARS-CoV-2时,就会导致流行和大流行的严重疾病[6].目前,由于缺乏有效的治疗方案,迫切需要发现新的药物来控制冠状病毒引起的感染。
在体外研究表明,tizoxanide (TIZ)能抑制肿瘤生长在体外犬冠状病毒S-378在受感染的A72细胞中的复制(报告的一半最大抑制浓度,IC50,为1 μg/ml [9])。Cao等报道NTZ可以有效抑制IC中培养的牛冠状病毒(L9)、小鼠冠状病毒、小鼠肝炎病毒(A59)和人肠冠状病毒(4408),这些病毒分别培养于小鼠星形细胞瘤(DBT)和成纤维细胞(17Cl-1)细胞系中50约0.3 μg/ml;这种效应包括抑制病毒N蛋白的表达[12].值得注意的是,NTZ及其活性代谢物(TIZ)通常具有可比性在体外对病毒的抑制作用;它们抑制在LLC-MK2细胞系中生长的MERS-CoV(据报道IC50分别为0.92和0.83 μg/ml)。
2020年,在COVID-19分解后,Wang等报道了NTZ在低微摩尔浓度(最大抑制浓度的一半为2.12 μM)下可以抑制感染SARS-CoV-2后Vero E6细胞(ATCC-1586)中的SARS-CoV-2 [1].最近,Kelleni建议使用NTZ联合阿奇霉素作为COVID-19早期病例的治疗方案[26].此外,Pepperrell等人回顾了关于NTZ的临床研究报告,以确定药物的安全性,并计算了药物生产的最低成本,以预期用于治疗COVID-19 [27].目前,NTZ单独或联合其他药物(伊维菌素或羟氯喹)治疗COVID-19患者的临床试验有14项;其中7项研究开始招募患者,如表所示2.其他临床试验尚未招募患者。开始NTZ临床试验的国家是埃及、美国、巴西和墨西哥[28].
硝唑腈和流感病毒
NTZ易于水解并在水缓冲液中作为细胞培养基转化为TIZ [28,29].几个在体外研究表明,TIZ可抑制16种不同的甲型流感病毒(IAV)的复制[A/Puerto Rico/8/34 (H1N1, A/H1N1- pr8), A/Wisconsin/33 (H1N1), A/Parma/24/09 (H1N1,耐奥司他韦),A/Goose/Italy/29624603 (H1N1), A/California/04/p2009 (H1N1), A/Ohio/88/2012 (H3N2v), A/Ohio/83/2012 (H3N2v), A/Washington/01/2007 (H3N2), A/Texas/12/2007 (H3N2), A/Firenze/7/03 (H3N2,耐烷胺),A/Canine/Colorado-1/224986/06 (H3N8),A/Canine/Colorado-3/3/06 (H3N8)、A/Canine/Colorado-4/2025974/07 (H3N8)、A/Chicken/Italy/9097/97 (H5N9, A/H5N9)和A/Turkey/Italy/RA5563/99 (H7N1)]和一种B型流感病毒(IBV) [B型流感/Parma/3/04]。TIZ对流感病毒的半最大抑制浓度为0.2 ~ 1.5 μg/ml [9].另据报道,IAV不太可能对TIZ产生耐药性,因为噻唑内酯对病毒RNA或蛋白质没有直接作用[30.],据报道,与病毒特异性抑制剂相比,病毒对靶向宿主细胞的抗病毒药物产生耐药性的预期较低[31].此外,NTZ与奥司他韦或扎那米韦联合使用对甲型H1N1-PR8流感病毒和甲型H5N9禽流感病毒有协同抗病毒作用[32].
Tilmanis等人报道了TIZ对210种季节性流感病毒以及对神经氨酸酶抑制剂(包括奥司他韦、扎那米韦、帕拉米韦和拉那米韦)表现出耐药性的病毒的有效抗病毒作用[33].
在一项涉及257例患者的人体临床试验中,与安慰剂相比,NTZ可以有效缩短每天两次口服600 mg的患者流感症状的持续时间。此外,与接受安慰剂的患者相比,这组患者的病毒滴度显著降低(p= 0.0006)。有趣的是,在接受药物治疗的流感病毒中,没有观察到对NTZ的抗病毒耐药性,在接受药物治疗的患者中,也没有报告体液免疫反应不良事件[34].
硝唑胺和轮状病毒
影响儿童的病毒性胃肠炎多为自限性感染,可能不需要使用抗菌药物;然而,使用抗微生物药物可能是合理的,因为在发展中国家,腹泻病每年造成100多万儿童死亡[35].在发展中国家,小儿肠胃炎主要由轮状病毒引起。此外,它还可能导致每年50万名5岁以下儿童死亡[36].据报道,TIZ可阻碍两株轮状病毒的复制,即人类Wa-G1P(8)和猴SA11-G3P(2)在IC内的复制50分别为1和0.5 μg/ml [9].
很少有临床试验揭示了使用NTZ治疗轮状病毒引起的胃肠炎的潜在益处。与安慰剂相比,NTZ的好处包括缩短住院儿童轮状病毒疾病的持续时间,这表明NTZ是轮状病毒引起的腹泻的重要治疗选择[37,38].
硝唑胺和诺如病毒
在免疫功能低下的病人中,诺如病毒逐渐被认为是病毒性肠胃炎的主要原因[39].2011年,全世界因诺如病毒感染而死亡的儿童估计人数为71,000人[40].在使用HG-23细胞的诺如病毒G1复制子检测体系中,TIZ的一半最大抑制浓度为0.5 μg/ml。此外,据报道,NTZ可治疗一例43岁的诺如病毒胃肠炎,该患者被诊断为白血病,除造血干细胞移植外,还接受了化疗;患者在治疗24小时后病情有所好转[13].
一项随机、两期、双盲临床研究纳入了200名由诺如病毒或轮状病毒感染引起的病毒性胃肠炎患者(包括50名成人和150名2个月至11岁的儿童),结果表明,与安慰剂相比,NTZ能够显著缩短疾病症状的持续时间(p= 0.0295) [41].Morris和Morris在一项纳入14例因诺如病毒而诊断为病毒性胃肠炎的患者的临床研究中报告,在NTZ治疗2天后,腹泻、恶心和腹痛得到改善[42].
Dang等报道了利巴韦林和TIZ联合治疗后对人诺如病毒复制的协同抑制作用和宿主细胞复制子的完全耗尽。简而言之,他们的结果揭示了TIZ通过刺激细胞抗病毒反应抑制病毒复制,特别是通过表达干扰素调节因子1。NTZ单独或联合利巴韦林治疗是一种很有前途的策略,主要用于免疫抑制患者对抗诺如病毒诱导的胃肠炎[14].
硝唑胺和星状病毒
已知人类星状病毒引起全球2%至9%的儿童急性非细菌性腹泻病例。人体星状病毒感染可致人死亡,特别是对免疫功能受损的患者,因为感染可引起坏死性小肠结肠炎和严重腹泻,此外还可引起其他致命疾病,如呼吸道疾病[43]、脑炎及脑膜炎[44].尽管星状病毒的发病率很高,并有罹患相关严重疾病的风险,但目前没有疫苗或药物疗法可用于对付这种病毒。Hargest等人最近报告了NTZ可引起的第一个证据在体外星状病毒感染土耳其家禽模型中几种星状病毒复制的抑制及体内病毒脱落和腹泻的减少[43].他们的结果表明,NTZ优于利巴韦林、磷甲酸和阿昔洛韦,因为它们即使在高浓度(250 μM)也不能抑制人星状病毒的复制。另一方面,NTZ能有效抑制病毒复制,且与IC浓度成正比501.47 μM。
硝唑胺和腺病毒
人腺病毒是具有二十面体衣壳的非包膜双链DNA病毒。人腺病毒感染通常导致严重的危及生命的疾病,特别是在免疫功能低下的受试者中。现时,本港缺乏针对腺病毒感染的抗病毒药物[6].Garrigos等报道了NTZ治疗一61岁免疫功能低下住院患者腺病毒相关肠炎的临床疗效;在开始500mg每日两次NTZ治疗方案2周后,作者检测到腹泻和病毒血症迅速恢复,PCR结果为阴性。有趣的是,患者在治疗48小时后从腹泻中恢复。值得注意的是,NTZ有限的毒性和病毒耐药性,以及很少的药物相互作用,使其成为这类感染的一个有前途的治疗选择[15].
硝唑胺和副粘病毒
副粘病毒是一组通过空气传播的病毒,可引起某些呼吸道疾病。它们包括麻疹、腮腺炎、呼吸道合胞病毒、家禽新城疫和人类副流感的病原体。这些病毒具有单链RNA基因组和聚合酶的特征。它们的包络直径在150到300纳米之间。据报告,某些种类的蛇体内有病毒可传染给人类[45].它们是高度传染性的病毒,可引致与人体呼吸道征有关的感染,并经由呼吸道分泌物传播[46].
Piacentini等人在研究中发现了NTZ的抗副粘病毒作用;他们发现NTZ通过作用于仙台病毒和RSV病毒细胞的f蛋白聚集物来阻止f向血浆的运输。他们进一步发现NTZ作为ERp57非竞争性阻滞剂;NTZ结合位点位于ERp57-b/b’非催化畴边界[16].
硝唑胺和埃博拉病毒
埃博拉病毒是一种包膜阴性单链RNA病毒。埃博拉病毒通过野生动物传播给人类,并可以通过人与人之间的传播进一步传播。埃博拉病毒感染被确定为埃博拉出血热;该病的死亡率很高(以前暴发时为25%至90%)[6].Jasenosky等近期报道NTZ可有效放大宿主先天免疫反应,抑制埃博拉病毒复制。报道的作用模式包括增强维甲酸诱导蛋白i样受体以及线粒体抗病毒信号蛋白。此外,NTZ刺激干扰素调节因子3的表达并促进抗病毒磷酸酶GADD34的转录,因此提出了一种有前途的方法作为埃博拉病毒易发疾病的治疗方法[17].
硝唑腈和丙型肝炎病毒
HCV是一种包膜阳性单链RNA病毒,属于黄病毒科。该病毒主要可通过血液传播,引起急性或慢性肝炎。丙肝病毒被认为是导致肝癌的主要原因[6].TIZ对HCV的活性主要是在AVA5细胞中培养的HCV复制子细胞的基因型1a和Huh7.5细胞系中复制的HCV复制子的基因型1b中进行研究。TIZ IC50基因型1a为0.09 μg/ml,基因型1b为0.06 μg/ml。TIZ与干扰素α或2'C甲基胞苷联合使用也有增效作用的报道[18].值得注意的是,HCV对TIZ的敏感性没有下降。此外,病毒基因组的测序没有经历突变来产生耐药性。因此,我们提出了一种宿主靶向作用机制[47].
临床试验评估了NTZ对HCV的疗效,患者在NTZ治疗后实现了持续的病毒学应答,血清中没有可追踪的病毒RNA,结果很有希望[11,48].尽管NTZ联合聚乙二醇干扰素(PegIFN)作为慢性丙型肝炎的双重治疗取得了改善的结果,但由于发现了新的直接作用抗病毒化合物,发展停止了。评估NTZ与抗病毒药物直接作用于联合感染HIV的慢性HCV患者的组合可能是未来进展的一个有趣的研究领域。
硝唑腈和乙型肝炎病毒
乙型肝炎病毒是重大进行性肝病的一个来源;据估计,全世界有20亿人感染乙肝病毒,其中约3.6亿人为慢性感染[49].Korba等人展示了NTZ及其代谢物TIZ如何抑制HBV DNA及其核心抗原。抗原有两种类型,HBeAg和HBsAg,它们在制备的细胞培养中被抑制。这两种分子被发现比其他抗病毒药物如拉米夫定(LMV)和阿德福韦酯(ADV)更有效,因为它们对六种对LMV和ADV耐药的HBV突变体发挥了活性[18].在最近的一项研究中,Sekiba等人研究了NTZ对HBV病毒DNA和RNA的抑制作用。他们已经证明NTZ靶向hbx -损伤特异性dna结合蛋白1 (DDB1)相互作用,从而抑制HBV cccDNA的表达和RNA转录[50].最近的一次在体外研究表明NTZ的作用是通过抑制血清HBV DNA来引导HBsAg的丢失。NTZ显示抗病毒药物抑制线粒体氧化磷酸化的原始机制[51].此外,12例成人乙型肝炎患者连续12个月每天服用500 mg NTZ的临床试验显示了其对HBV的作用。结果显示,12例患者中4例HBeAg阳性,8例HBeAg阴性。这些发生在平均3个月。这清楚地显示了NTZ对HBV患者的治疗潜力[11].
硝唑胺和基孔肯雅病毒
基孔肯雅病毒是一种阳性单链RNA病毒。基孔肯雅病毒引起基孔肯雅病,其表现为发热、结膜炎、关节炎和严重关节痛。这种感染是由感染病毒的雌性蚊子传播的。2005年,这种疾病在法国爆发,然后,感染蔓延到许多其他国家,造成数百人死亡,感染病例超过100万例[52].基孔肯雅病毒被确定为第3类危险病原体[53].这类病原体可通过受体依赖的内吞作用进入细胞。在进入过程中,病毒包膜糖蛋白E1和E2发生构象变化[54]从而形成三聚体,随后在病毒和核内体膜之间融合[55并将病毒基因组释放到细胞质中。现时,并没有获批准有效的抗病毒药物治疗基孔肯雅热感染[6].最近的一项研究表明,NTZ可以限制病毒的进入和释放,以及细胞间传播。此外,除Sindbis病毒和Semliki forest病毒两种甲型病毒外,该药还对两种临床基孔肯雅病毒分离株表现出广泛的抗病毒活性[19].
硝唑腈和风疹病毒
风疹病毒的特征是单链阳性RNA基因组。它很小,而且被包裹着[56].由风疹病毒引起的疾病具有传染性,其特征是皮疹,可通过疫苗预防。它会导致胎儿在怀孕期间持续感染,导致出生缺陷。NTZ在人脐静脉内皮细胞原代培养中以浓度依赖的方式抑制其复制,对风疹病毒具有显著的抑制作用500.35 μg/ml [20.].
硝唑胺和痘苗病毒
牛痘病毒被用作传递其他抗原的载体[57].然而,该病毒能够在免疫抑制的受试者和患有湿疹的患者中诱发严重疾病。Hickson等人研究了NTZ对牛痘病毒的潜在抗病毒作用。他们的研究表明NTZ可以抑制痘苗病毒与IC的复制502 μM [21].
硝唑胺与人体免疫缺陷病毒
艾滋病毒感染至少在30年内对人类造成毁灭性的影响。从那时起,艾滋病毒感染了6 000万受试者,造成2 500多万人死亡。高活性抗逆转录病毒疗法是获得性免疫缺陷患者的有效治疗策略;这种策略通常包括两种或两种以上类别的三种药物的组合。例如,两种属于核苷类逆转录酶抑制剂的药物与来自这些类的第三种药物联合使用:整合酶抑制剂、非核苷类逆转录酶抑制剂或蛋白酶抑制剂。由于现有药物成本高昂,而且可能产生严重的副作用,因此需要开发新的抗病毒药物[58].Tan等人发现NTZ和代谢物TIZ都能有效抑制HIV (IC50浓度约为0.5 μg/ml)。此外,NTZ与一些HIV药物联合使用时表现出协同抗病毒作用,包括整合酶抑制剂(雷替格拉韦)、核苷和非核苷逆转录,分别为叠氮胸嘧啶和依非韦伦[22].
硝唑胺和人巨细胞病毒
全球超过60%的人口易感染人类巨细胞病毒。高危人群包括获得性免疫缺陷患者和免疫功能低下者,因为巨细胞病毒感染可能导致严重和危及生命的并发症[59].Mercorelli等人最近报道NTZ特异性靶向病毒转录因子IE2功能,从而通过IC阻断病毒的复制503.2 μM。这些发现表明NTZ具有很有前景的抗病毒作用,可用于治疗先天性感染,并开发出能够抵抗当前抗dna聚合酶化合物的菌株[23].
硝唑腈和其他病毒
TIZ能有效抑制登革热-2和黄热病在Vero细胞中的复制,其一半最大抑制浓度分别为0.1和0.06 μg/ml [24].另一项研究描述了NTZ在具有IC的BHK-21细胞中抑制日本脑炎病毒复制的活性500.12 μg/mL;结果表明,经口服NTZ 25 d后,感染小鼠仍能存活。另一方面,所有未经治疗的小鼠都在实验的第九天死亡。小鼠的存活率与给药剂量成正比,在NTZ剂量为50、75和100 mg/kg/d时,观察到的存活率分别为30%、70%和90% [25].
硝唑腈和促炎介质
NTZ除具有抗病毒活性外,还能抑制PBMC(外周血单个核细胞)中促炎细胞因子的产生,包括TNFα、白细胞介素(IL)-2、IL-4、I-5、IL-6、IL-8和IL-10 [60].其他研究支持这些发现,在腹腔注射1 ml 4%巯基乙酸盐之前2小时给小鼠口服100 mg/kg NTZ可使血浆IL-6水平比对照降低90% [61].研究结果表明NTZ可以改善COVID-19重症患者可能经历的细胞因子风暴[62通过抑制促炎细胞因子的过度产生。
硝唑腈和支气管扩张
在最近的一项研究中,Miner和他的同事报告说NTZ是一种有效的Ca+ 2激活的氯−通道(TMEM16A)拮抗剂,导致气道平滑肌收缩和去极化的阻断。他们利用极度收缩的气道或受到细胞因子鸡尾酒作用的气道,评估了NTZ在恶劣条件下的疗效,结果显示该药物可以令人惊讶地扩张气道。他们的研究结果表明,在COVID-19患者中使用NTZ的潜在益处,因为它可能有助于缓解疾病相关症状[63].
讨论和未来展望
NTZ表现出非凡的广谱抗菌活性[64].在美国,NTZ作为一种抗寄生虫药物获得FDA批准,用于治疗隐孢子虫病和贾第虫病感染。由于其对多种病毒感染的安全性和活性,目前正在许多针对多种传染性病毒疾病的临床试验中进行评估[65,66].500mg NTZ的标准处理在给药后1小时内足以使TIZ血浆水平大于10 μM,并且在给药后约5小时内,血浆TIZ水平维持在该浓度以上,血浆最大浓度为~ 35 μM [67].给药10 h后,血浆TIZ水平开始下降至IC以下50这意味着NTZ的标准给药方案将足以在整个治疗过程中保持有效的抗病毒浓度。一项已发表的研究报告称,高剂量(4 g) NTZ在患者体内的最大血药浓度约为200 μM,即使是这种高剂量也具有良好的耐受性而无毒性[68].这些数据表明,有可能像报告的IC那样抗击COVID-1950对SARS-CoV-2的抑制作用仅为2.12 μM,而典型的NTZ剂量可以很容易地达到这一水平。
COVID-19疫情被认为是对公共卫生的威胁和全球紧急情况,因此迫切需要寻找新的有效治疗方案,以阻止致命的COVID-19的快速传播。药物再利用活动可以减少开发新分子所需的成本和时间。最近有报道称,一些筛选的现有药物,如NTZ、氯喹和瑞德西韦,在用IC培养的Vero E6细胞株中使用低浓度的药物被证明可以抑制致命的SARS-CoV-250值分别为2.12 μM、1.13 μM和0.77 μM。据报道,中国的一项研究表明,常用治疗甲型和乙型流感的药物奥司他韦作为治疗COVID-19的药物没有积极作用[69].然而,奥司他韦目前在一些临床试验中作为抗病毒药物进行研究[70].此外,伊维菌素具有强大的驱虫作用,最近显示出一种在体外IC在48小时内对SARS-CoV-2有抑制作用50约2 μM [71].使用这些改变用途的药物有一些局限性;例如,伊维菌素的使用可能包括一些安全性问题,因为在体重小于15公斤的儿童中使用该药物的安全性数据不充分[72].此外,伊维菌素在妊娠期的使用可能受到限制,因为它被归类为FDA C类药物,并且没有足够的数据证明其在妊娠期的安全使用[73].此外,氯喹用于老年患者或超过剂量限制时可能引起毒性;如果在怀孕期间使用氯喹,几种严重的副作用会在胎儿发育期间发生。此外,高剂量的氯喹或羟氯喹可加重视网膜病变[74].尽管FDA刚刚紧急批准氯喹和羟氯喹用于COVID-19 [75],该授权最近被撤销,原因是最新的临床试验结果显示,这些药物在降低死亡率或加速康复方面没有益处,这些结果与最近的数据显示,这些药物不太可能对SARS-CoV-2产生抑制作用一致。由于COVID-19是一种大流行疾病,治疗费用非常重要。治疗方案必须以负担得起的价格提供给特别是中低收入国家。同样在高收入国家,COVID-19的负担需要以最低成本提供药物[76].新开发的抗病毒药物,如瑞德西韦、法匹拉韦和洛匹那韦/利托那韦,价格更高,在筛查用于SARS-CoV-2感染的治疗方法时应考虑到这一点。另一方面,根据上市后的经验,NTZ是最有希望的治疗COVID-19的治疗方案之一,如上所述,在成人和儿童中都有很高的安全性。此外,NTZ被FDA列为怀孕B级药物[77].综合考虑所有这些数据,再加上NTZ的广谱抗病毒特性和合理的价格,这表明NTZ可以成为一种低成本、安全的抗SARS-CoV-2药物治疗方法。因此,我们设想,在快速临床试验中重新利用NTZ作为一种有效的抗病毒治疗方法,可能会对抗致命的COVID-19,并挽救大量患者的生命。
结论
综上所述,现有的报道数据表明NTZ在治疗sars - cov -2方面具有潜在的治疗作用,特别强调(i)在体外NTZ对SARS-CoV-2和其他冠状病毒的抑制作用,浓度易于达到,(ii)对促炎细胞因子的抑制作用,包括抑制IL-6的产生,(iii)支气管扩张作用,以及(iv)经临床试验和广泛的上市后经验验证的令人满意的安全记录。
数据和材料的可用性
不适用
缩写
- COVID-19:
-
2019年冠状病毒病
- 冠:
-
严重急性呼吸综合征冠状病毒
- MERS-CoV:
-
中东呼吸综合征冠状病毒
- 艾滋病:
-
获得性免疫缺陷综合症
- 乙肝病毒:
-
乙型肝炎病毒
- 丙肝病毒:
-
丙型肝炎病毒
- 艾滋病毒:
-
人类免疫缺陷病毒
- PBMC:
-
外周血单个核细胞
- IL:
-
白介素
- NTZ:
-
Nitazoxanide
- TIZ:
-
Tizoxanide
- 肿瘤坏死因子-α:
-
肿瘤坏死因子-α
- 聚合酶链反应:
-
聚合酶链反应
参考文献
- 1.
王敏,曹睿,张玲,杨鑫,刘娟,徐敏等(2020)瑞德西韦和氯喹对新出现的新型冠状病毒(2019-nCoV)有有效抑制作用在体外.细胞研究,30:269-271
- 2.
黄超,王勇,李霞,任玲,赵娟,胡勇等(2020)武汉市2019年新型冠状病毒感染患者临床特征分析。中国柳叶刀。395:497 - 506
- 3.
Fehr AR, Perlman S(2015)冠状病毒:其复制和发病机制的概述。方法Mol生物学1282:1-23
- 4.
陈建峰,袁绍,郭克杰,杜家凯,褚宏,杨杰等(2020)与2019年新型冠状病毒相关的家族性肺炎聚集性人际传播:家庭聚集性研究。柳叶刀。395:514 - 523
- 5.
谁。世卫组织冠状病毒疾病(COVID-19)仪表盘。
- 6.
徐娟,史鹏云,李华,周娟(2020)广谱抗病毒药物氯氯柳胺及其治疗潜力。美国传染病学会,6:909-915
- 7.
Pushpakom S, Iorio F, Eyers PA, Escott KJ, Hopper S, Wells A等人(2019)药物再利用:进展、挑战和建议。《自然》杂志评论药物发现。18:41-58
- 8.
Amadi B, Mwiya M, Musuku J, Watuka A, Sianongo S, Ayoub A等(2002)硝唑嗪对赞比亚隐孢子虫病儿童发病率和死亡率的影响:一项随机对照试验。柳叶刀。360:1375 - 1380
- 9.
Rossignol JF (2014) Nitazoxanide:一种一流的广谱抗病毒药物。抗病毒研究。110:94 - 103
- 10.
de Carvalho LP, Lin G, Jiang X, Nathan C (2009) Nitazoxanide杀死复制和非复制结核分枝杆菌并规避耐药性。药物化学杂志。52:5789 - 5792
- 11.
Rossignol JF, Keeffe EB(2008)噻唑内酯:治疗慢性乙型和丙型肝炎的一类新药物。3:539 - 545
- 12.
曹杰,Forrest JC,张旭(2015)美国国立卫生研究院临床收藏小分子文库筛选识别潜在的抗冠状病毒药物。抗病毒研究。114:1-10
- 13.
Siddiq DM, Koo HL, Adachi JA, Viola GM(2011)成功治疗诺如病毒胃肠炎。《感染杂志》63:394-397
- 14.
党伟,徐磊,马波,陈松,尹勇,张克欧等(2018)尼硝氧胺通过激活细胞抗病毒反应抑制人诺如病毒复制并与利巴韦林协同。抗菌剂和化疗。62: e00707-e00718
- 15.
Esquer Garrigos Z, Barth D, Hamdi AM, Abu Saleh OM, Sohail MR (2018) Nitazoxanide是免疫受损成人腺病毒相关肠炎的治疗选择。抗菌剂和化疗。62
- 16.
Piacentini S, La Frazia S, Riccio A, Pedersen JZ, Topai A, Nicolotti O等人(2018)Nitazoxanide通过靶向融合蛋白折叠抑制副粘病毒复制:糖蛋白特异性巯基氧化还原酶ERp57的作用。科学代表8:10425
- 17.
Jasenosky LD, Cadena C, Mire CE, Borisevich V, Haridas V, Ranjbar S等人(2019)fda批准的口服药物Nitazoxanide放大宿主抗病毒反应并抑制埃博拉病毒。iScience 19:1279 - 1290
- 18.
Korba BE, Montero AB, Farrar K, Gaye K, Mukerjee S, Ayers MS等(2008)Nitazoxanide, tizoxanide和其他噻唑内酯是乙肝病毒和丙型肝炎病毒复制的有效抑制剂。抗病毒研究。77:56 - 63
- 19.
王玉梅,陆景文,林春昌,陈玉峰,吴泰,林丽等(2016)氯硝柳胺和硝唑腈对基孔肯雅病毒进入和传播的抗病毒作用。抗病毒研究。135:81 - 90
- 20.
杨晓明,杨晓明,杨晓明,杨晓明,杨晓明,等。(2017)应用广谱药物硝唑嗪抑制风疹病毒在细胞培养和免疫缺陷患者中的复制。抗病毒研究。147:58 - 66
- 21.
Hickson SE, Margineantu D, Hockenbery DM, Simon JA, Geballe AP(2018)硝唑氧胺抑制痘苗病毒复制。病毒学。518:398 - 405
- 22.
谭欣,胡磊,Luquette LJ 3rd,高刚,刘勇,曲华等(2012)靶向HIV协同药物对的系统鉴定。自然生物技术。30:1125 - 1130
- 23.
Mercorelli B, Luganini A, Nannetti G, Tabarrini O, Palù G, Gribaudo G等人(2016)药物再利用方法确定了阻断人类巨细胞病毒复制的原型病毒转录因子IE2抑制剂。细胞化学生物学。23:340 - 351
- 24.
Botta L, Rivara M, Zuliani V, Radi M(2018)对抗登革病毒感染及相关疾病的药物再利用方法。生物科学前沿(里程碑版)23:997-1019
- 25.
史志,魏军,邓霞,李松,邱勇,邵东等(2014)硝唑氧胺抑制日本脑炎病毒在培养细胞和小鼠模型中的复制。病毒学杂志》上。11:10
- 26.
Kelleni MT (2020) Nitazoxanide/阿奇霉素联合治疗COVID-19:一种建议的早期管理新方案。药理学研究157:104874
- 27.
Pepperrell T, Pilkington V, Owen A, Wang J, Hill AM(2020)硝唑嗪治疗COVID-19的安全性和最低价格评价。病毒传播,6:52-60
- 28.
李志强,李志强,李志强,等(2000)尼硝唑胺在人体代谢中的作用。国际临床药理学和治疗学杂志。38:387 - 394
- 29.
杜斯恩斯基,Kvičerová J, Seville RS.第18章-肉食性球虫病的治疗和药物治疗。见:Duszynski DW, Kvičerová J, Seville RS,编辑。世界食肉动物球虫(Apicomplexa)生物学与鉴定:学术出版社;2018.p . 445 - 63。
- 30.
Stachulski AV, Santoro MG, Piacentini S, Belardo G, Frazia S, Pidathala C等(2018)第二代硝唑腈衍生物:噻唑内酯是甲型流感病毒的有效抑制剂。未来药物化学。10:851 - 862
- 31.
loregan A, Mercorelli B, Nannetti G, Compagnin C, Palu G(2014)针对流感病毒的抗病毒策略:面向新的治疗方法。细胞和分子生命科学:CMLS。71:3659 - 3683
- 32.
Belardo G, Cenciarelli O, La Frazia S, Rossignol JF, Santoro MG(2015)硝唑氮胺与神经氨酸酶抑制剂对甲型流感病毒的协同作用在体外.抗菌剂和化疗。59:1061 - 1069
- 33.
蒂尔曼尼斯D, van Baalen C, Oh DY, Rossignol JF, Hurt AC(2017)循环人流感病毒对硝唑氮胺活性代谢产物tizoxanide的易感性。抗病毒研究。147:142 - 148
- 34.
Haffizulla J, Hartman A, Hoppers M, Resnick H, Samudrala S, Ginocchio C等(2014)nitazoxanide对成人和青少年急性无并发症流感的影响:一项双盲、随机、安慰剂对照、2b/3期试验。《柳叶刀传染病》14:609 - 618
- 35.
Arun Babu T, Venkatesh C(2010)硝唑腈在轮状病毒性腹泻中的应用。治愈还是争议?印度儿科杂志77:1450
- 36.
谭em, Cawcutt KA, Zomok CD, Go RS, Sia IG (2017) nitazoxanide抗病毒性胃肠炎活性的系统综述。国际旅行医学与全球健康杂志,5:107-112
- 37.
Rossignol JF, Abu-Zekry M, Hussein A, Santoro MG (2006) nitazoxanide治疗严重轮状病毒腹泻的疗效:随机双盲安慰剂对照试验。柳叶刀。368:124 - 129
- 38.
Teran CG, Teran- escalera CN, Villarroel P (2009) Nitazoxanide vs.益生菌治疗儿童急性轮状病毒腹泻:玻利维亚儿童的随机、单盲、对照试验。国际传染病杂志:IJID:国际传染病学会正式出版物13:518-523
- 39.
Lopman BA, Steele D, Kirkwood CD, Parashar UD(2016)诺瓦克病毒巨大而多样的全球负担:预防和控制前景。《公共科学图书馆·医学》杂志上。13: e1001999
- 40.
van Beek J, van der Eijk AA, Fraaij PL, Caliskan K, Cransberg K, Dalinghaus M等(2017)2006-2014年荷兰三级护理医院固体器官接受者慢性诺如病毒感染。临床微生物学和感染:欧洲临床微生物学和传染病学会正式出版物23:265.e9-265e13
- 41.
Rossignol JF, El-Gohary YM (2006) Nitazoxanide治疗病毒性胃肠炎:一项随机双盲安慰剂对照临床试验。营养药理学与治疗学。24:1423 - 1430
- 42.
Morris J, Morris C (2015) Nitazoxanide是化疗和造血干细胞移植(HSCT)后治疗诺如病毒胃肠炎的有效疗法。血液和骨髓移植生物学。21:S255-S2S6
- 43.
Hargest V, Sharp B, Livingston B, Cortez V, Schultz-Cherry S (2020) nitazoxanide抑制星状病毒复制在体外在体内。病毒,94
- 44.
Vu DL, Cordey S, Brito F, Kaiser L(2016)新型人类星状病毒:新型人类疾病?临床病毒学杂志:泛美临床病毒学学会的官方出版物。82:56-63
- 45.
Ariel E(2011)爬行动物中的病毒。兽医决议42:100
- 46.
Blahak S, Jenckel M, Höper D, Beer M, Hoffmann B, Schlottau K(2020)蟒蛇体内存在网状病毒的研究。病毒学杂志17:6
- 47.
Yon C, Viswanathan P, Rossignol JF, Korba B (2011) HCV非结构基因突变与含有复制因子的细胞对硝唑腈的耐药性无关。抗病毒研究。91:233 - 240
- 48.
Rossignol JF, Elfert A, El-Gohary Y, Keeffe EB(2009)用硝唑氮胺、聚乙二醇干扰素和利巴韦林治疗慢性丙型肝炎基因4型,改善病毒学应答。胃肠病学。136:856 - 862
- 49.
陈世林,Morgan TR(2006)丙型肝炎病毒(HCV)感染的自然史。《国际医学科学》3:47-52
- 50.
Sekiba K, Otsuka M, Ohno M, Yamagami M, Kishikawa T, Suzuki T等(2019)通过靶向HBx-DDB1相互作用抑制cccDNA中的HBV转录。细胞和分子消化病学和肝病学。7:297 - 312
- 51.
Rossignol J-F, Bréchot C (2019) nitazoxanide治疗慢性乙型肝炎的临床试验。国际肝病通讯。3:744-747
- 52.
韦弗SC,弗雷斯特NL(2015)基孔肯雅热:进化史和最近的流行病传播。抗病毒研究。120:32-39
- 53.
Staples JE, Breiman RF, Powers AM(2009)基孔肯雅热:一种重新出现的传染病的流行病学综述。临床传染病:美国传染病学会的正式出版物。49:942-948
- 54.
Voss JE, Vaney M-C, Duquerroy S, Vonrhein C, girar - blanc C, Crublet E等(2010)基孔肯雅病毒颗粒糖蛋白组织的x射线晶体学研究。大自然。468:709 - 712
- 55.
van Duijl-Richter MK, Hoornweg TE, Rodenhuis-Zybert IA, Smit JM(2015)基孔肯雅病毒感染的早期事件-从病毒细胞结合到膜融合。病毒。7:3647 - 3674
- 56.
Chaari A, Bahloul M, Berrajah L, Ben Kahla S, Gharbi N, Karray H等(2014)儿童风疹脑炎:诊断、管理和结局。儿童神经学杂志。29:49-53
- 57.
陈wm, McFadden G(2014)溶瘤性痘病毒。《启示录》1:19 19 - 141
- 58.
Hawkins T(2010)了解和管理抗逆转录病毒治疗的不良反应。抗病毒研究。85:201 - 209
- 59.
Nogalski MT, Collins-McMillen D, Yurochko AD(2014)人巨细胞病毒发病机制概述。见:Yurochko AD, Miller WE (eds)人类巨细胞病毒:方法和协议。Humana出版社,托托瓦,新泽西州,第15-28页
- 60.
Clerici M, Trabattoni D, Pacei M, Biasin M, Rossignol J-F(2011)抗感染药物nitazoxanide具有很强的免疫作用(155.21)。的。免疫学杂志。186:155.21
- 61.
Hong SK, Kim HJ, Song CS, Choi IS, Lee JB, Park SY (2012) Nitazoxanide抑制lps刺激小鼠巨噬细胞和tg注射小鼠IL-6的产生。国际免疫药理学,13:23-27
- 62.
Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ (2020) COVID-19:考虑细胞因子风暴综合征和免疫抑制。柳叶刀。395:1033 - 1034
- 63.
Miner K, Labitzke K, Liu B, Wang P, Henckels K, Gaida K等人(2019)药物再利用:驱虫药氯硝柳胺和硝氮氧胺是有效的TMEM16A拮抗剂,可完全扩张支气管气道。药理学前沿
- 64.
Shakya, Bhat HR, Ghosh SK (2018) nitazoxanide:一种多功能化疗药物的最新进展。当前的药物发现技术。15:201 - 213
- 65.
Koszalka P, Tilmanis D, Hurt AC(2017)流感抗病毒药物目前处于晚期临床试验。流感和其他呼吸道病毒。11:240 - 246
- 66.
Galan-Herrera JF, Poo JL, Rosales-Sanchez O, Fuentes-Fuentes E, Cariño L, Burke-Fraga V等人(2009)单剂量左氧氟沙星500mg的两种口服制剂的生物利用度:在健康墨西哥志愿者中进行的开放标签、随机、两期交叉比较。临床治疗。31:1796 - 1803
- 67.
Balderas-Acata JI, Ríos-RogríguezBueno EP, Pérez-Becerril F, Espinosa-Martínez C, Fraga VB, Parra MG-dl。单剂量硝唑肼500mg的两种口服悬液配方的生物利用度:开放标签、随机序列、两期交叉,在健康禁食的墨西哥成年志愿者中进行比较2011.
- 68.
Stockis A, Allemon AM, De Bruyn S, Gengler C (2002) Nitazoxanide在人体内的药代动力学和耐受性。国际临床药理学和治疗学杂志。40:213 - 220
- 69.
王东,胡斌,胡超,朱峰,刘霞,张杰等(2020)武汉市138例2019年新型冠状病毒感染的肺炎住院患者临床特征分析。中国《美国医学协会杂志》上。323:1061 - 1069
- 70.
吴蓉,王磊,郭华昌,Shannar A, Peter R,周普杰等(2020)新冠肺炎治疗药物研究进展。Curr Pharmacol代表:1-15
- 71.
Caly L, Druce JD, Catton MG, Jans DA, Wagstaff KM (2020) fda批准的药物伊维菌素可抑制SARS-CoV-2的复制在体外.抗病毒研究。178:104787
- 72.
Levy M, Martin L, Bursztejn AC, Chiaverini C, Miquel J, Mahé E等人(2020)伊维菌素在婴儿和15公斤以下儿童治疗疥疮中的安全性:一项多中心观察性研究。英国皮肤病学杂志。182:1003 - 1006
- 73.
Patel VM, Lambert WC, Schwartz RA(2016)妊娠期疥疮和虱子外用药物的安全性。印度皮肤病杂志61:583-587
- 74.
周东,戴世民,童青(2020)COVID-19:建议研究羟氯喹在预防感染和进展中的作用。抗菌化疗杂志。75:1667-1670
- 75.
食品及药物管理局。冠状病毒(COVID-19)更新:FDA撤销氯喹和羟氯喹的紧急使用授权。2020.
- 76.
Hill A, Wang J, Levi J, Heath K, Fortunak J(2020)制造COVID-19新疗法的最低成本。病毒纪元6:61-69
- 77.
Domjahn BT, Hlavsa MC, Anderson B, Schulkin J, Leon J, Jones JL(2014)美国妇产科医生对妊娠隐孢子虫病的临床和流行病学知识调查。人畜共患病与公共卫生61:356-363
确认
不适用
资金
这项工作部分由埃及科学研究与技术学院(ASRT)在“应用你的想法”计划“项目ID: 7303, To M.A.”中资助。资助者在研究设计、数据收集和分析、发表决定或手稿准备中没有任何作用。
作者信息
从属关系
贡献
DB设计了这部作品,审阅了文献,并起草了手稿;ZS查阅文献并起草手稿;AM实质性地修改了手稿并批准了提交。作者阅读并批准最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用
发表同意书
不适用
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
188滚球软件本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
Mahmoud, D.B, Shitu, Z. & Mostafa, A. nitazoxanide的药物再利用:它能有效治疗COVID-19吗?Genet Eng生物技术公司18,35(2020)。https://doi.org/10.1186/s43141-020-00055-5
收到了:
接受:
发表:
关键字
- 广谱抗病毒药物
- Bronchodilation
- 新型冠状病毒肺炎
- 细胞因子
- 特制nitazoxanide