抽象的
胞外囊泡(EV)用来自几种细胞类型,包括间充质基质细胞(MSC)释放质膜结合片段,组成型或下刺激。从MSC和其他细胞类型衍生的电动汽车传递分子(例如DNA,蛋白质/肽的mRNA,微小RNA,和脂质)和/或细胞器与修复和抗炎性质的受体细胞。通过MSC衍生的电动车推广的旁分泌的抗炎作用已经吸引了再生医学领域显著利益,包括在肺损伤的潜在用途。在本次审查中,我们描述的特征,生物活性和MSC衍生电动汽车的作用机制。在急性的相关临床前模型和慢性呼吸道疾病,如肺炎,急性呼吸窘迫综合征,哮喘和肺动脉高压的报道我们也回顾电动汽车的治疗潜力。最后,我们讨论以强化MSC衍生电动车的治疗效果,从而使这种疗法在临床实践中可能的方法。
背景
近几十年来,间充质基质细胞(MSCs)的治疗潜力和安全性已经在损伤组织的再生和免疫调节的背景下进行了研究[1].许多研究表明,当系统施用时,通过静止 - 不完全理解的趋化机制将MSC募集到炎症的部位[2]刺激受伤组织的内源性修复[3.],调节免疫应答[4.].MSCs对组织修复和再生的有益作用基于其旁分泌活性,其特征是能够分泌生长因子、细胞因子和趋化因子,这些因子在微环境中协调相互作用并影响组织再生。这些因子可以抑制细胞凋亡,刺激增殖,促进血管生成,并调节免疫反应[5.].值得注意地,从MSCs收集的条件培养基可以传达许多这些保护效果,表明可溶性因素而不是细胞 - 细胞接触是MSC动作的主要机制[6.].
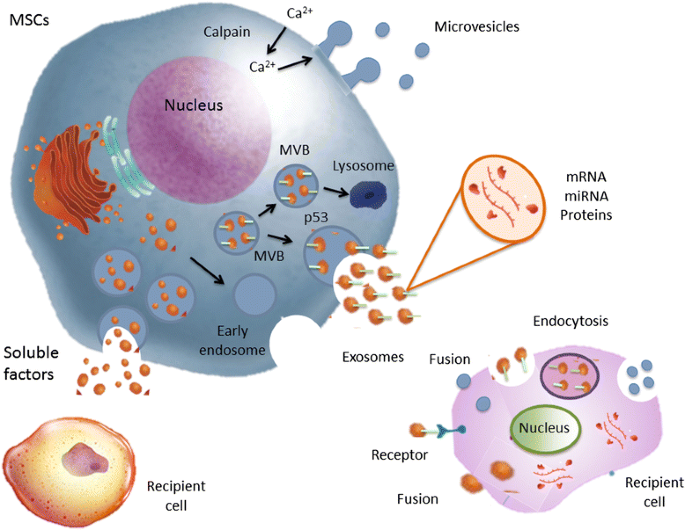
值得注意的是,生长的文献体内表明,许多这些旁静脉效应是由条件培养基中含有的细胞外囊泡(EVS)介导的。EVS是小型球形膜片段,包括外泌体,微囊泡颗粒和凋亡体,根据国际细胞外囊泡(ISEV)的建议[7.].EVS被涉及细胞到细胞通信的细胞释放,并且能够改变受体细胞的命运和表型[8.].外泌体由细胞内胚胎产生,而微泡出源自血浆膜。这些粒子类型由各种不同的细胞类型分泌,包括衍生自不同组织(骨髓,胎盘以及脂肪组织和肺组织的T和B淋巴细胞,树突状细胞(DC),粪便细胞,血小板和MSCs),并且也可以从尿液,血清和支气管肺泡灌洗液(BALF)等体内体内分离体内[9.那10.].尽管如此,EVS的分类取决于它们的起源,大小和内容(表1)。此外,EVS的数量和性质可能受到性别,年龄,昼夜节律,空腹状态,药物暴露和身体活动的影响[11.].然而,这些不同类别的电动汽车是否代表不同的生物实体还不明显。一些参数被用来描述不同类型的电动汽车,包括尺寸、离子组成、沉降速率、蔗糖梯度上的浮选密度、脂质组成、蛋白质装载量和生物发生途径;然而,这些参数中的大多数既不确定也不专属于任何特定类型的电动汽车(图。1)[7.].
外小体的大小范围为50-150nm,形状均匀,是一种来源于特殊细胞内小室的EV亚型,即多囊泡体(MVB)[12.].外泌体由细胞组成型释放,但通过可溶性激动剂(细胞因子,趋化因子和生长因子)和物理,化学(氧化应激和缺氧)激活,它们的释放显着地增强,并且剪切应力[13.].为了形成外出,MVBS芽的限制膜向内形成,从而形成腔内囊泡(ILV),然后用血浆膜熔断以将ILV作为外来释放。该过程由P53-调节的外毒性介导,其依赖于细胞骨骼活化,而是独立于细胞钙涌入[14.].相反,微泡范围为150至1000nm的尺寸,并且更为异质。它们通过小细胞质突发萌芽,依赖于CALPAIN,细胞骨骼重组和细胞内钙浓度的过程。钙离子负责产生微囊泡形成的质膜的不对称磷脂分布[14.].最后,还有另一种类型的EVS,大于1μm:凋亡体,来自于染色细胞。作为核的残余物,DNA通常存在于这些囊泡中,如非分子的RNA和细胞器细胞器[15.].
通过特异性标准化方案可以从体液或体外培养细胞中分离不同的EV,并通过使用抗体加载的磁性细胞珠子来表征差异超速离心,超滤和免疫沉淀[16.].这些程序至关重要,因为所有类型的囊泡以及膜片段通常存在于起始材料中,并且可以污染特异性EVS制剂。因此,EVS研究中的一个主要挑战是标准化分离和分析的方法。另外,由于其重叠的特性和缺乏鉴别标记,难以区分外来体和微铅作用[17.].然而,在ev的许多亚型中,外泌体已经成为与生理相关的MSC分泌组的强大组成部分[18.].
EVs的含量包括蛋白质、脂质和核酸;微泡和凋亡小体也含有细胞器成分。由于EV的作用通常取决于其来源细胞,并且可能受到生理应激或病理条件的影响,因此EV可作为诊断、预测或预测疾病及其自然史的生物标记物[14.].许多报告表明,电动汽车的功能至少部分地反映了其原始细胞的功能;它们之间存在差异,是因为电动汽车的组成可能被修改,这表明优先包装或排除材料发生了[19.].有关蛋白质,脂质和EVS的RNA表达的信息被收集在Vesicepedia(http://www.microvesicles.org)[20.],而Exocata数据库中描述了不同细胞类型和生物体的外体[21.].EVS在细胞间通信中发挥重要作用,能够通过直接表面受体相互作用,细胞,蛋白质递送至靶细胞的蛋白质递送的受体转移来修饰靶细胞的活性,或遗传信息的水平转移[22.].它们参与细胞过程,如血管生成调节、细胞增殖和免疫调节[23.].因此,EVS对其治疗潜力特别有吸引力,特别是MSC衍生的EVS,这似乎是利用MSC治疗的临床益处的重要工具,同时使用基于MSC ecricticle的无细胞策略。这些策略可以降低与MSC的植入相关的风险,例如对MSC的可能免疫反应和异位组织的发育。由于EVS携带了广泛的信号,因此已经进行了几项研究,评估了它们在器官损伤的动物模型中的含义,包括肺病。尽管如此,关于包装在MSC衍生的EVS中包装的全部范围的全面洞察力及其在组织再生中的作用尚未得到获得,并且需要进行额外的研究来提供更详细的[9.那23.].
msc衍生电动汽车的特性
msc来源的ev表达CD29、CD73、CD44和CD105等表面分子,这些分子是其起源细胞的特征。在msc衍生的ev中,外泌体是最具特征的。已知外泌体保存一组蛋白质,包括四氮杂蛋白,涉及细胞靶向(CD63, CD81和CD9);热休克蛋白Hsp60、Hsp70和Hsp90 [24.];ALG-2相互作用蛋白X(ALIX)和肿瘤敏感性基因101(TSG101),其涉及其生物发生的MVBS;整合林和附睾,对运输和融合很重要[20.];和主要的组织相容性复杂类I和II [25.].微潜水缺乏内吞径的蛋白质,但富含胆固醇和脂质筏相关蛋白,例如整联蛋白和甘曲肽。虽然肘花素通常用作外泌体的独特标记,但在某些情况下,它们可以在微胶囊中检测它们[26.].已经进行了几项研究,评估了MSC衍生的EVS在生理和病理条件下的潜在作用及其在不同疾病治疗中的可能应用[12.那15.];然而,很少有研究对这些囊泡的RNA和蛋白质含量进行评估。
MSC衍生的EV富集,可以通过不同的RNA类富集,其可以转移到靶细胞并将其转化为蛋白质,导致靶细胞行为的改变[27.].特别地,MSC衍生的EVS含有转录(转录因子CP2,时钟同源物),细胞增殖(视网膜母细胞瘤瘤1,小泛素相关改性剂1)和免疫调节(白细胞介素1受体拮抗剂)中涉及转录的转录物[27.].此外,MSC衍生的EV含有非致rNA,微小RNA(miRNA),其介导基因表达的后术治疗,以及调节受体细胞的存活和代谢活性[28.].这些miRNA可以在EVS和/或它们的源细胞中存在[9.].在msc来源的ev中检测到的mirna通常与发育、细胞存活和分化有关,而一些msc来源的富含ev的mirna与免疫系统的调控更密切相关[9.].然而,目前无法提供有关MSC衍生EV的完整RNA含量的综合信息,以及来自不同来源的成年MSCs是否份额相似的RNA曲目仍然未知。最近的研究比较了来自两种不同来源的成年MSCs释放的外来肌瘤的RNA谱分析:脂肪衍生的MSCs(ASCS)和骨髓衍生的MSCs(BM-MSCs)。尽管ASC和BM-MSC外来体中最代表的RNA之间具有实质性相似性,但它们的相对比例是不同的[29.].
蛋白质组分析可能同样重要。BM-MSC衍生EV含量的表征鉴定了几种蛋白质,其中介质是控制自我更新和分化的介质。有趣的是,该分析显示了许多表面标志物,例如血小板衍生的生长因子受体,表皮生长因子受体和纤溶酶原激活剂,尿激酶受体;RAS-丝裂原活化蛋白激酶,RHO GTP酶和细胞分裂对照蛋白42途径的信号分子;细胞粘附分子;和其他MSC抗原[30.],支持在组织修复中的这种囊泡的可能作用。具有特异性生长因子的细胞衍生EV可以改变这些囊泡的表型和蛋白质含量;例如,已显示用血小板衍生的生长因子治疗的ASCS产生具有增强血管生成活动的EVS [31.].这种生物活性的广泛分布使MSC-derived ev具有诱发多种细胞反应和与多种细胞类型相互作用的潜力。
EVS的作用机制和生物学活动
EVS可以通过不同的机制与受体细胞与受体细胞相互作用:细胞表面的相互作用,内胶质室中的内化,以及熔体膜膜(图。1)[32.].已经观察到EVS摄取的效率直接与细胞内和微环化酸相关[33.].在配体相互作用后,电动汽车可能将其内容物传递给受体细胞,受体细胞对其进行重新编程。最近,来自干细胞的ev被证明能够穿梭半胱氨酸选择性转运通道(cystinosin),在突变的靶细胞中恢复功能[34.].EVS还可以从起源细胞中介导遗传信息的水平转移,例如mRNA和miRNA的子集,从而通过不同的途径诱导受体细胞表型和行为的改变[35.]. 在该系中,由小鼠胚胎干细胞产生的EV可通过传递多种多能转录因子的蛋白质和mRNA来重新编程造血祖细胞[36.],而用RNase的预处理抑制了观察到的生物学效应,从而表明EVS衍生的mRNA的贡献[36.].因此,干细胞可以通过提供遗传信息和改变靶细胞的基因表达来调节它们的生物学效应。有趣的是,遗传信息交换可以是双向的:从受伤的细胞到骨髓衍生或驻留干细胞;或从干细胞到受伤的细胞。在这方面,Dooner等人。[37.[报道,骨髓干细胞与受损肺细胞的骨髓干细胞表达肺特异性蛋白的基因,例如表面活性剂B和C,以及克拉克拉细胞特异性蛋白,其可归因于肺特异性mRNA对骨髓细胞的转移通过EVS从受伤的肺细胞释放。
另外,来自受损和免疫细胞的EVS可以诱导在成年期间存在于几个器官中存在的干细胞募集和分化,从而有助于生理组织修复[13.].然而,ev可以发挥免疫刺激或免疫抑制作用,这取决于它们的细胞来源[38.].感染的肺泡巨噬细胞释放含有病原体衍生的促炎症分子和分泌Hsp70的分泌,其通过刺激促摩擦感(TLR)来激活核因子-κB途径[15.],导致促炎细胞因子的分泌[14.那24.].另一方面,DCS分泌的EVS能够在EVS净化之前引起对DC处理的抗原的液体反应,从而强烈地防止感染[39.]. EV也可以调节靶细胞的功能。例如,来源于脂多糖激活的单核细胞的EV通过转移caspase-1诱导靶细胞凋亡[40].此外,受损组织的蛋白质组学分析通常揭示它们的耗尽率很多限制的ATP产生酶,因此不能利用恢复的氧气供应来产生ATP。该耗竭可以由MSC衍生的外泌体的蛋白质组补充,其具有富含酶活性糖酵解酶和其他ATP产生酶的货物,例如腺苷激酶和核苷 - 二磷酸激酶[41].
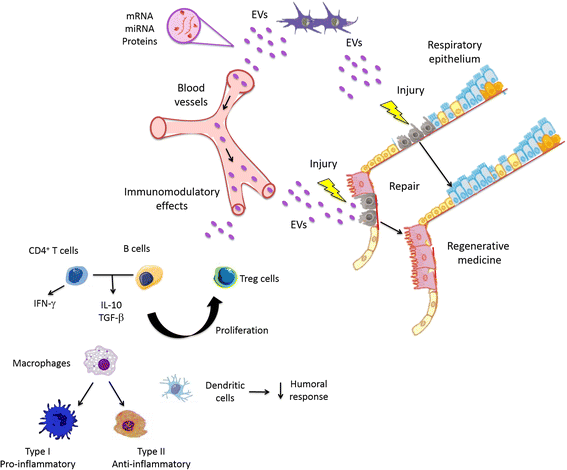
然而,msc衍生的电动汽车在文献中得到了更多的重视,并得到了最广泛的研究。在这一行中,从人MSCs释放的ev已被证明含有参与细胞内RNA运输和选定的miRNA模式的核糖核蛋白,表明参与发育、调节、再生和细胞分化的RNA的动态调控和区隔化,这有助于成人组织损伤后的恢复过程(图。2)[42].事实上,MSC衍生的电动汽车中发挥T细胞和他们的干扰素-γ(IFN-γ)释放的体外,分化和活化的重要抑制以及刺激抗炎细胞因子的分泌(白介素(IL)-10和转化生长因子β(TGF-β)),并产生调节性T细胞的[43],表明MSC衍生的外泌体是相关的免疫调节治疗剂(图。2)。此外,与MSC衍生的电动汽车治疗激活一个M2巨噬细胞样肺实质,这是众所周知的促进组织修复和限制损伤[表型44].
体外分析了BM-MSCs和衍生EV的免疫调节效应。BM-MSCs及其EV对B细胞增殖具有类似的抑制活性,但与BM-MSC相比,EVS对B细胞的分化和抗体释放的抑制活性较少。此外,BM-MSCs在抑制T细胞增殖时比EVS更有效。在一项研究中,将T细胞和B细胞与EV的孵育导致粒细胞 - 巨噬细胞菌落刺激因子和IL-10和TGF-β的增加,与BM-MSCs相比增加了IL-10和TGF-β的增加[45].
肺病中MSC衍生EV的治疗潜力
MSC衍生的EV已被证明是一种有希望的治疗方法,能够促进组织修复和伤口愈合。MSC衍生EV的作用在某些条件下可以增强,例如暴露于缺氧和与病理条件下获得的动物或人血清共培养。由于刺激和细胞因子、趋化因子和生长因子的存在,这些方法可能诱导释放并增强这些EV的作用,这不仅增加EV的释放,而且可能改变其含量,从而增强有益作用。
由于它们的脂质双层和含水核,EVS也是药物递送的重要载体,因为它们可以携带亲脂性和亲水药物[46].此外,EVS为此目的呈现了几个优点,例如:蛋白质和遗传物质的存在,其能够积极负载生物材料;由于抑制剂的抑制剂和吞噬作用的存在,身体的高耐受性[30.];防止降解酶或化学物质的保护;以及通过质膜将货物运送到目标细胞的能力[9.那47]及目标组织之家[9.那46].电穿孔[48]和病毒包装策略[49已被用于将治疗活性货物分子(例如,小分子药物或小干扰RNA(siRNA))加载到EV中[48那49].
虽然已经提出了通过旁阳碱活动的组织修复中MSCs的主要机制,但是正在进行一些研究以更好地了解与肺病中MSC衍生EV的有益效果相关的机制,例如哮喘,肺动脉高血压(PAH),急性呼吸窘迫综合征(ARDS)和肺炎(表2),以及如何对临床实践进行强化。
哮喘
哮喘是一种慢性炎症性疾病,其特征是气道收缩和炎症,这可能导致气道结构改变,通常是对过敏原、感染和空气污染物的反应[50].尽管目前有几种治疗策略可降低气道炎症,但到目前为止没有治疗能够加速受损肺部的修复[51].在这条线,一些研究报道,干细胞减少肺部炎症和实验过敏性哮喘重塑[52-54].
EVS从几种涉及过敏的细胞释放,包括肺部中的肥大细胞,DC,T细胞和支气管上皮细胞(BECS)。例如,肥大细胞衍生的EV诱导DC成熟,DC衍生的EV可以运输过敏原和激活过敏原特异性T-辅助(TH)2细胞[55].在几种潜在机制中,BEC暴露于压缩应力 - 因此模拟哮喘中观察到的支气管内容 - 产生轴承组织因子,该组织因子可以参与促进耻骨纤维化和血管生成的促进[56].简而言之,现有数据表明bec衍生ev在哮喘发病机制中的潜在贡献。此外,这些发现可能导致未来针对这些细胞抑制ev分泌的哮喘患者治疗的发展。
与健康患者相比,来自哮喘的Balf Evs中,在Balf Evs中观察到了几种表型和功能改变。这些包括CD36的更高表达,这与细菌识别有影响,并且可以在响应细菌感染时发挥哮喘恶化的作用[57],并且所述电动车包含的miRNA,具体的致病事件的关键调节[58]可能作为肺部疾病的生物标志物,如let-7(let-7a–let-7e)和miRNA-200(miR-200b和miR-141)家族[59].此外,来自哮喘患者的BECS与BALF EVS的孵育导致白酮和IL-8释放增加[60].
另外,从小鼠致敏和用卵清蛋白激发BALF衍生电动汽车的施用已被证明能够抑制IgE应答,Th2型细胞因子的产生,和在实验性哮喘气道炎症[61].在哮喘血清来源的ev中也观察到类似的行为,可以防止过敏性气道炎症,降低BALF嗜酸性粒细胞计数、IgE水平和Th2反应。因此,不同来源的电动汽车可能在哮喘和过敏的发展中发挥作用,要么作为一种有效耐受的失败或作为一种已经建立的反应的增强剂。总之,电动汽车可能是抗过敏治疗的治疗靶点。
最近,在实验性哮喘中研究了来自人MSCs(HMSCs)和小鼠MSCs(MMSCs)的EVS的治疗效果。作者观察到从HMSCs或MMSCs的SeVS的系统施用每种情况 - 在某些情况下,比HMSCs或MMSCS本身更有效 - 减轻过敏气道高反应性和肺炎,并改变了抗原特异性CD4的表型免疫活结小鼠中严重,急性,混合Th2 / Th17介导的嗜酸性嗜酸性嗜酸性嗜酸性嗜酸性嗜酸性和中性粒细胞过敏性炎症的T细胞。此外,阻断EVS释放导致没有与HMSCS和MMSCs相关的保护效果[62].
肺动脉高压
肺动脉高压是一种以小肺动脉平滑肌细胞增生和肥大为特征的疾病,内皮细胞增殖增加导致肺血管重构,从而导致平均肺动脉压力增加和右心室超负荷。从PAH患者获得的数据显示,PAH的严重程度与受刺激或内皮细胞凋亡释放的循环ev增加有关,可能是由于可溶性血管细胞粘附分子VCAM-1的释放,以及促炎标志物,如单核细胞趋化蛋白MCP-1和高特异性c反应蛋白在PAH患者中升高。此外,与肺动脉高压患者静脉血相比,肺动脉血中内皮来源的CD105微颗粒进一步增加[63].炎症在人类PAH的发展中起着重要作用,并且存在几种动物模型的这种情况,例如在啮齿动物中偏霉菌诱导和缺氧诱导的PAH。
尽管在阐明多环芳烃的病理生理学和治疗方面取得了重大进展,但现有的多环芳烃治疗方法很少,而且疗效有限。因此,许多研究调查了间充质干细胞治疗PAH的效果,并证明了其益处。在最近的一项研究中,野百合碱诱导的PAH产生的肺源性和血浆源性ev导致右心室体积和肺血管壁厚度增加,这种作用可能是通过ev对肺血管系统的直接促进,或者通过骨髓细胞向内皮祖细胞分化,诱导肺血管重构[64].这提示ev中参与肺血管重构的miRNAs表达改变。相反,在缺氧诱导的肺动脉高压中,msc来源的电动汽车对右心室收缩压升高和右心室肥厚的发展有保护作用,而电动汽车耗尽培养基和成纤维细胞来源的电动汽车没有作用。MSC-derived EVs的这些有益作用可能与抑制缺氧肺巨噬细胞内流和信号传感器和转录激活因子STAT3的缺氧激活有关,结合促炎和促增殖介质的诱导,包括MCP-1和缺氧诱导的有丝分裂因子HIMF,以及增加关键miRNAs miR-17和miR-204的肺水平,它们的表达在人类肺动脉高压中降低[65].然而,测试这些效果的动物模型不被认为是PAH的临床前模型的良好表示。因此,通过EVS治疗PAH观察的有益效果需要更深入的调查,然后才能被认为是练习变化。
急性呼吸窘迫综合征
ARDS是一种严重的临床状况,其特征在于肺泡 - 毛细血管损伤,富含蛋白质的碎片在肺泡空域中积累,以及渐进式呼吸衰竭[66].虽然已经实现了治疗和支持性护理的重大改进,但其死亡率仍保持左右40%[67].
最近,一些研究报告说,MSCs可以是通过旁静脉效应的ARDS的有希望的治疗方法[68-70].此外,已显示MSC衍生的EVS在实验内毒素诱导的ARD中产生有益效果,还原肺炎[71].HMSC衍生的EV在治疗术后大肠杆菌内毒素诱导的ARDS,从而减少了血管外肺水,BALF,水肿和中性粒细胞渗透的总蛋白质水平。这些有益效果与角蛋白细胞生长因子(KGF)表达的增加有关,因为在衍生自KGF siRNA预处理的MSC的EV递送后部分消除它们[72].此外,缺血预处理可以通过外泌体的分泌来提高MSCs在内毒素诱导的ARDS中的保护作用,因为它赋予对细胞死亡的强烈保护并通过激活多个信号通路来促进它们的分化潜力,该途径为治疗方法开放新的途径[73].
肺炎
细菌肺炎是患者呼吸衰竭的主要原因。尽管支持性护理和适当的抗生素使用,发病率和死亡率仍然很高[74].几项研究报告了MSCS在肺炎的临床前模型的疗效由于它们分泌旁静脉因子,例如生长因子,抗炎细胞因子和抗微生物肽[75].外膜囊泡释放是致病性和非致病革兰氏阴性细菌之间的保守现象[76].然而,关于革兰氏阳性EVs,尤其是它们的生物起源和在宿主-病原体相互作用中的作用,我们知之甚少。电动汽车的链球菌引起的肺炎,是全世界细菌性肺炎的主要病因之一,直到最近才被发现[77]和发现表现出高免疫原性,由于肺炎球菌溶血毒素的存在。
近日,在体内模型大肠杆菌在小鼠肺炎中,hmsc来源的ev在改善生存率、缓解肺部炎症、蛋白通透性和细菌生长方面与它们的母细胞一样有效。hmsc来源的ev的抗菌作用部分是通过增强细菌的单核细胞吞噬作用来实现的,在ev释放前用TLR-3激动剂预刺激hMSCs可以进一步增强单核细胞吞噬作用。通过CD44受体摄取hmsc来源的ev到受损的人单核细胞和肺泡上皮细胞对其治疗效果至关重要。另一个需要强调的因素是,hmsc来源的ev降低了由脂多糖介导的人单核细胞分泌的肿瘤坏死因子α,并恢复了受损的人肺泡上皮II型细胞内的ATP水平,表明ev具有免疫调节和代谢组学作用。此外,给药KGF中和抗体消除了hmsc衍生ev介导的生存优势,提示其治疗效果的可能机制[78].
结论
一些研究报道,MSCs可以通过旁分泌机制修饰靶细胞功能来修复受损组织,而不直接替代受损细胞。ev在这一机制中的作用可能是交换遗传物质,这可以解释观察到的MSCs表型和功能变化[79].该遗传物质转移可能导致生产可溶性因子,从而调节细胞增殖,细胞凋亡和/或炎症和免疫应答。
EVS具有与干细胞的许多优点,例如靶向组织的归巢能力,防止其他器官中的不希望的积累,并且在干细胞注射液中没有任何与长期发生的植入的植入细胞,肿瘤产生或免疫排斥反应的先天毒性或结合。然而,与MSC衍生EVS诱导的有益效果相关的机制需要进一步调查。在这一行中,以下几点特别是令人保证更好的评价:该信号传导调节EVS内的生物活性分子的转移,表面受体可以产生选择性特异性,并且该刺激是触发EVS释放的刺激。了解这些EVS机制可能允许其用作诊断标志物,用于递送药物和基因,以及作为新的治疗策略。虽然一些研究报告了MSC衍生的EVS在哮喘,ARDS,PAH和肺炎中的有益作用,但必须在临床环境中使用之前解决许多问题,包括:需要从MSCS进行大规模的EVS生产;由于不同的制剂和MSC来源,需要定义EVS效力的标准;EVS的长期影响;以及每种呼吸系统疾病中的EVS生物分布。
缩写
- ARDS:
-
急性呼吸窘迫综合征
- ASC:
-
脂肪衍生的间充质基质细胞
- BALF:
-
支气管肺泡灌洗液
- 因为
-
支气管上皮细胞
- BM-MSC:
-
骨髓来源的间充质基质细胞
- DC:
-
树突状细胞
- EV:
-
外囊泡
- HMSC:
-
人间充质基质细胞
- HSP:
-
热休克蛋白
- IFNγ:
-
γ干扰素
- IL:
-
白细胞介素
- ILV:
-
腔内囊泡
- ISEV:
-
国际细胞外囊泡学会
- KGF:
-
角质形成细胞生长因子
- miRNA:
-
microRNA.
- MMSC:
-
小鼠间充质基质细胞
- MSC:
-
间充质基质细胞
- MVB:
-
多泡体
- 多环芳烃:
-
肺动脉高压
- siRNA:
-
小干扰RNA
- TGF-β:
-
转化生长因子β
- TH:
-
辅助细胞
- TLR:
-
Toll样受体
参考文献
-
1。
Lalu MM,McIntyre L,Pugliese C,Fergusson D,Winston BW,Marshall JC,Granton J,Stewart DJ。间充质基质细胞细胞疗法的安全性(Safecell):临床试验的系统评价和荟萃分析。Plos一个。2012; 7(10):E47559。
-
2。
Hofmann Na,Ortner A,Jacamo Ro,Reinisch A,Schallmoser K,Rohban R,Ecchart N,Fruehwirth M,Beac-Schmid C,Andreeff M,STREED D.氧气传感间充质祖细胞促进体内人源化小鼠模型中的新血管生成。Plos一个。2012; 7(9):E44468。
-
3.
贝尔·吉尔,梅奇诺山,休斯大学,Broughton HC,Xenocostas A,Hess Da。组合人祖细胞移植通过分泌旁静脉因子来优化胰岛再生。干细胞开发。2012; 21(11):1863-76。
-
4.
Zhao S,Wehner R,Bornhauser M,Wassmuth R,Bachmann M,Schmitz M.间充质基质细胞免疫调节性质及其对免疫介导的疾病的治疗后果。干细胞开发。2010; 19(5):607-14。
-
5.
Waszak P,Alphonse R,Vadivel A,Ionescu L,Eaton F,TheBaud B.预处理增强了间充质干细胞在预防大鼠氧诱导的新生肺损伤方面的斜拉碱作用。干细胞开发。2012; 21(15):2789-97。
-
6.
Goolaerts A,Pellan-Randrianarison N,Larghero J,Vanneaux V,Uzunhan Y,Gille T,Dard N,Planes C,Matthay MA,Clecerici C.来自间充质基质细胞的调节培养基恢复钠运输,并在体外模型中保持上皮渗透性急性肺泡损伤。AM j Physiol肺细胞Mol pymiol。2014; 306(11):l975-85。
-
7.
Lotvall J,Hill AF,Hochberg F,Buzas Ei,Di Vizio D,Gardiner C,Gho Ys,Kurochkin IV,Mathivanan S,Quesenberry P,Sahoo S,Tahara H,Wauben MH,Witwer Kw,Thery C.最小的实验要求细胞外囊泡的定义及其职能:来自细胞外囊泡国际社会的立场声明。J Extracell囊泡。2014; 3:26913。
-
8.
Camussi G,Deregibus MC,Bruno S,Cantaluppi V,Biancone L. Exosomes /微胶束作为细胞 - 细胞通信的机制。肾脏int。2010; 78(9):838-48。
-
9.
Baglio SR,Pegtel DM,Baldini N.间充质干细胞分泌的囊泡提供了(干)无细胞疗法的新机遇。前面的physiol。2012; 3:359。
-
10。
Almqvist N,Lonnqvist A,Hultkrantz S,拉斯克C,从抗原喂养小鼠Telemo E.血清衍生的外来体防止在过敏性哮喘的模型变应性致敏。免疫学。2008; 125(1):21-7。
-
11.
Quesenberry PJ,Goldberg LR,Altiotta JM,Dooner MS,Pereira Mg,Wen S,Camussi G.细胞表型和细胞外囊:基础和临床考虑。干细胞开发。2014; 23(13):1429-36。
-
12.
陈家,李C,陈L.微泡源源自间充质干细胞在肺病中的作用。BioMed Res Int。2015; 2015:985814。
-
13。
Bruno S,Camussi G.中间充质干细胞衍生微胶体在组织修复中的作用。Pediastre nephrol。2013; 28(12):2249-54。
-
14。
间充质干细胞微囊泡的研究进展。肾移植。2012;27(8):3037-42。
-
15
藤田y,kosaka n,araya j,kuwano k,ochiya t。肺部微环境和发病机制的细胞外囊。趋势mol med。2015; 21(9):533-42。
-
16
费拉布拉奇A、德尔法托雷A、卢西亚诺R、穆拉卡M、泰蒂A。间充质干细胞免疫调节的最新进展:微泡的作用。细胞移植。2015;24(2):133–49.
-
17
Gould SJ,Raposo G.在等待:应对细胞外囊的不完美术语。J Extracell囊泡。2013; 2:10.3402 / jev.v2i0.20389。
-
18
Kordelas L,Rebmann V,Ludwig Ak,Radtke S,Ruesing J,Doeppner Tr,Epple M,Horn Pa,Beelen DW,Giebel B.Msc衍生的外来肌肉:一种治疗治疗难治性移植物与宿主病的新型工具。白血病。2014; 28(4):970-3。
-
19.
Katsuda T,Kosaka N,Takeshita F,Ochiya T.间充质干细胞衍生细胞外囊泡的治疗潜力。蛋白质组学。2013; 13(10-11):1637-53。
-
20。
陈继,刘泽,洪mm,张h,陈c,小m,王家,姚f,ba m,刘j,郭zk,zhong j. zhong j.Plos一个。2014; 9(12):E115316。
-
21。
Mathivanan S,Simpson RJ。Exocarta:外泌体蛋白和RNA的汇编。蛋白质组学。2009; 9(21):4997-5000。
-
22。
Tetta C、Bruno S、Fonsato V、Deregibus MC、Camussi G。微泡在组织修复中的作用。器官发生。2011;7(2):105–15.
-
23。
Akyurekli C,Le Y,Richardson RB,Fergusson D,Tay J,Allan DS。间充质基质细胞衍生微泡治疗潜力的临床前研究的系统综述。干细胞修订版2015; 11(1):150-60。
-
24。
布鲁诺S,Deregibus MC,间充质基质细胞的Camussi G的分泌蛋白质:在免疫调节细胞外囊泡的作用。免疫吧。2015; 168(2):154-8。
-
25。
Demayo F,MINOO P,PLOPPER CG,SCUGER L,Shannon J,Torday JS。肺部开发和修复中的间充质 - 上皮相互作用:采用相同的过程模拟和重塑吗?AM j Physiol肺细胞Mol pymiol。2002; 283(3):L510-7。
-
26。
戴尔GL,REMENYI G,FRIESE P.TATRASPANIN CD9是从涂层血小板中释放的微粒释放所必需的。血小板。2009; 20(6):361-6。
-
27
Tomasoni S,Longaretti L,Rota C,Morigi M,Conti S,Gotti E,Capelli C,Introna M,Remuzzi G,Benigni A.通过外泌体转移生长因子受体mRNA的转移不引起间充质干细胞的再生作用。干细胞开发。2013; 22(5):772-80。
-
28
Eirin A,Riester Sm,Zhu Xy,Tang H,Evans JM,O'Brien D,Van Wijnen Aj,Lerman Lo。来自猪的细胞外囊泡的microRNA和mRNA货物脂肪组织衍生的间充质干细胞。基因。2014; 551(1):55-64。
-
29
Baglio SR,Rooijers K,Koppers-Lalic D,Verweij FJ,Perez Lanzon M,Zinin N等人。人骨髓和脂肪 - 间充质干细胞分泌富含浓密的miRNA和TRNA种类的外索体。干细胞res。2015; 6:127。
-
30.
Kim HS,Choi Dy,Yun Sj,Choi Sm,kang Jw,Jung Jw,Hwang D,Kim Kp,Kim DW。人间充质干细胞源自人间充质干细胞的微泡蛋白质组学分析。J蛋白质组。2012; 11(2):839-49。
-
31。
Lopatina T,Bruno S,Tetta C,Kalinina N,Porta M,Camussi G.血小板衍生的生长因子通过脂肪间充质干细胞调节细胞外囊泡的分泌并增强它们的血管生成潜力。单元格式信号。2014; 12:26。
-
32。
Phinney DG, Di Giuseppe M, Njah J, Sala E, Shiva S, St Croix CM, Stolz DB, Watkins SC, Di YP, Leikauf GD, Kolls J, Riches DW, Deiuliis G, Kaminski N, Boregowda SV, McKenna DH, Ortiz LA。间充质干细胞利用细胞外囊泡外包自噬和穿梭microrna。Nat Commun。2015;6:8472。
-
33。
Parolini I, Federici C, Raggi C, Lugini L, Palleschi S, De Milito A, Coscia C, Iessi E, Logozzi M, Molinari A, Colone M, Tatti M, Sargiacomo M, Fais S.微环境pH是肿瘤细胞外泌体转运的关键因素。中国生物医学工程学报。2009;34(4):491 - 497。
-
34。
iglesias dm,el-kares r,taranta a,belloomo f,emma f,besouw m,levtchenko e,toelen j,van den heuvel l,楚l,zhao j,年轻的YK,Eliopoulos N,Goodyer P. Stem Cell微螺粒子转移半胱氨酸对人囊性细胞并减少体外胱氨酸积累。Plos一个。2012; 7(8):E42840。
-
35。
Camussi G,Deregibus MC,Cantaluppi V.茎细胞衍生的微泡在干细胞旁静脉作用中的作用。Biochem Soc Trans。2013; 41(1):283-7。
-
36。
Ratajczak J,Miekus K,Kucia M,Zhang J,Reca R,Dvorak P,Ratajczak MZ。胚胎干细胞衍生的微泡重新编程造血祖细胞:mRNA和蛋白质递送水平转移的证据。白血病。2006; 20(5):847-56。
-
37。
Dooner Ms,Altiotta Jm,Pimentel J,Dooner GJ,Abedi M,Colvin G,Liu Q,Weier Hu,Johnson KW,Quesenberry PJ。骨髓细胞转化为肺细胞的转化电位与细胞因子诱导的细胞周期波动。干细胞开发。2008; 17(2):207-19。
-
38。
Bourdonnay E,Zaslona Z,Penke LR,Speth JM,Schneider DJ,Przybranowski S,Swanson Ja,Mancuso P,Freeman Cm,Curtis JL,Peters-Golden M.从巨噬细胞到上皮细胞的囊泡SOCS蛋白术术术。J Exp Med。2015; 212(5):729-42。
-
39
QAZI KR,Torregrosa Paredes P,Dahlberg B,Grunewald J,Eklund A,Gabrielsson S. Proinflamatory ExoSomes在结节病患者的支气管肺泡灌洗液中。胸部。2010; 65(11):1016-24。
-
40。
Sarkar A,Mitra S,Mehta S,Raices R,Wewers MD。单核细胞衍生的微泡通过封装的Caspase-1提供细胞死亡消息。Plos一个。2009; 4(9):E7140。
-
41。
赖RC,杨荣文RW,林SK。间充质干细胞外泌体。Semin Cell Dev Biol。2015; 40:82-8。
-
42。
Collino女,Deregibus MC,布鲁诺S,Sterpone L,Aghemo G,Viltono L,哲太C,Camussi G.微泡从成人骨髓和组织特异性间质干细胞穿梭miRNA的选择的图案。Plos一个。2010; 5(7):e11803。
-
43。
Mokarizadeh A,Delirezh N,Morshedi A,Mosayebi G,Farshid AA,Mardani K.来自间充质干细胞的微泡,用于诱导耐受性信号传导的有效细胞器。免疫吧。2012; 147(1-2):47-54。
-
44。
张B,Yin Y,Lai Rc,Tan SS,Choo Ab,Lim Sk。间充质干细胞分泌免疫活性外来体。干细胞开发。2014; 23(11):1233-44。
-
45。
Conforti A,Scarsella男,STARC N,Giorda E,Biagini S,Proia A,Carsetti R,Locatelli的男,伯纳ME。从间充质基质细胞的Microvescicles不是很有效,如调节在体外免疫应答的能力它们的细胞对应物。干细胞开发。2014; 23(21):2591-9。
-
46。
赖Y,Long Y,Lei Y,Deng X,He B,Sheng M,Li M,Gu Z.一种新的香豆素衍生物单态官能化PEG用于抗肿瘤药物递送的新型胶束:体外和体内研究。J药物目标。2012; 20(3):246-54。
-
47。
莱瑞,陈Ts,Lim Sk。间充质干细胞外出组:一种新的心血管疾病治疗基于干细胞的治疗。regen med。2011; 6(4):481-92。
-
48。
田义,李士,宋j,ji t,zhu m,安德森gj,Wei J,Nie G.使用工程天然膜囊泡外泌体进行针对肿瘤治疗的多柔比星输送平台。生物材料。2014; 35(7):2383-90。
-
49。
捷尔吉B,洪ME,Breakefield XO,伦纳德JN。临床前景和开放性问题:外囊的治疗应用。Annu Rev Pharmacol毒物学。2015; 55:439-64。
-
50。
马丁内斯FD,Vercelli D.哮喘。柳叶刀。2013; 382(9901):1360-72。
-
51。
Papierniak ES,塔尔DT,在哮喘哈曼E.新的治疗方法:白三烯拮抗剂,生物制剂,超越。j ther。2013; 20(1):79-103。
-
52。
Abreu Sc,Antunes Ma,De Castro Jc,De Oliveira MV,Bandeira E,Ornellas DS等。骨髓衍生的单核细胞与实验过敏性哮喘中的间充质基质细胞。respir physiol neurobiol。2013; 187(2):190-8。
-
53。
Goodwin M, Sueblinvong V, eisenhower P, Ziats NP, LeClair L, Poynter ME, Steele C, Rincon M, Weiss DJ。骨髓间充质基质细胞抑制th2介导的小鼠过敏性气道炎症。干细胞。2011;29(7):1137 - 48。
-
54。
莱思罗普MJ,布鲁克斯EM,Bonenfant NR,Sokocevic d,博格ZD,古德温男,莱R,克鲁兹楼蕙CW,斯蒂尔C,魏斯DJ。间充质基质细胞通过抑制T H 17信号传导途径介导的曲霉的菌丝提取物诱导的变应性气道炎症。干细胞医学译。2014; 3(2):194-205。
-
55。
Admyre C,Telemo E,Almqvist N,Lotvall J,Lahesmaa R,Scheynius A,Gabrielsson S. ExoSomes-Nanoces - 纳米寡核苷酸在过敏性炎症中可能的作用。过敏。2008; 63(4):404-8。
-
56。
Park JA,Sharif AS,Tschumperlin DJ,Lau L,Limbrey R,Howarth P,Drazen JM。体外和体内人类机械刺激支气管上皮细胞分泌的携带组织因子的外泌体。过敏临床免疫杂志。2012;130(6):1375–83.
-
57。
Baranova INKR, Bocharov AV, Vishnyakova TG, Chen Z, Remaley AT, cako G, et al.;人CD36在细菌识别、吞噬和病原体诱导的jnk信号通路中的作用。J Immunol。2008;181(10):7147 - 56。
-
58。
Levanen B,巴克塔NR,Torregrosa帕雷德斯P,巴比亚乌R,Hiltbrunner S,波拉克JL,什科尔德CM,Svartengren男,Grunewald的Ĵ,加比利尔森S,Eklund的A,拉松BM,半圆PG,尔勒DJ,德丰AM。改变的微小RNA谱在哮喘患者支气管肺泡灌洗液外来体。j alerergy inlmunol。2013; 131(3):894-903。
-
59。
Pinkerton M,Chinchilli V,Banta E,Craig T,8月A,Bascom R,Cantorna M,Harvill E,Ishmael Ft。微小RNAS在哮喘患者呼出呼吸凝聚物中的差异表达,慢性阻塞性肺病,健康成人患者。j alerergy inlmunol。2013; 132(1):217-9。
-
60。
Torregrosa Paredes P,Esser J,Admyre C,Nord M,Rahman QK,Lukic A,Radmark O,Gronneberg R,Grunewald J,Eklund A,Scheynius A,Gabrielsson S.Bronchoalveolar灌洗液流体外来源于过敏性哮喘的细胞因子和白硫代生产。过敏。2012; 67(7):911-9。
-
61。
普拉多·恩梅、塞古拉·E、费尔南德斯·加西亚·H、维拉巴·M、特里·C、罗德里格斯·R、巴塔内罗·E。耐受小鼠支气管肺泡液中的外泌体可预防过敏反应。免疫杂志。2008;181(2):519–25.
-
62。
Cruz FFBZ,Goodwin M,Sokocevic D,Wagner de,Coffey A,Antunes M,Robinson Kl,Mitsials Sa,Kourembanas S,K,Hoffman Am,McKenna DH,Rocco PRM,Weiss DJ。人骨髓衍生的间充质基质细胞细胞外囊泡的全身施用改善了免疫活性小鼠的Aspergillus悬垂提取物诱导的过敏气道炎症。干细胞翻译med。2015; 4(11):1302-16。
-
63。
Bakouboula B,Morel o,Faure A,Zobairi F,Jesel L,Trinh A,Zupan M,Canuet M,Grunebaum L,Brunell A,Desprez D,Chabot F,Weitzenblum E,Freyssinet JM,Chaouat A,Toti F. ProcoAgant膜微粒与肺动脉高压的严重程度相关。am j respir crit care med。2008; 177(5):536-43。
-
64。
Altiota JM,Pereira M,Amaral A,Sorokina A,Igbinoba Z,Hasslinger A,El-Bizri R,Rounds Si,Quesenberry PJ,Klinger Jr。偏甲酸碱处理小鼠的细胞外囊脉冲诱导肺部血压诱导。Cardiovasc Res。2013; 100(3):354-62。
-
65。
Lee C,Mitsialis SA,Aslam M,Vitali Sh,Vergadi E,Konstantinou G,SDRIMAS K,Fernandez-Gonzalez A,Kourembanas S. Exosomes介绍了间充质基质细胞对缺氧诱导的肺动脉高压的细胞保护作用。循环。2012; 126(22):2601-11。
-
66。
马时亨,霍华德,JP。临床前小鼠急性肺损伤模型的研究进展。欧洲反应杂志。2012;39(5):1062–3.
-
67。
李L,金S,张Y.缺血预处理增强了间充质干细胞对小鼠内毒素诱导的急性肺损伤的保护作用。int J Clin Exp Med。2015; 8(3):3825-32。
-
68。
Gonzalez-Rey E,Anderson P,Gonzalez Ma,Rico L,Buscher D,Delgado M.衍生自脂肪组织免受实验性结肠炎和败血症的人成人干细胞。肠道。2009; 58(7):929-39。
-
69。
Maron-Gutierrez T, Silva JD, Asensi KD, Bakker-Abreu I, Shan Y, Diaz BL, Goldenberg RC, Mei SH, Stewart DJ, Morales MM, Rocco PR, Dos Santos CC.间充质干细胞治疗对小鼠肺重塑时间进程的影响取决于肺损伤的病因。重症监护医学。2013;41(11):e319-33。
-
70。
Ionescu L,Byrne RN,Van Haaften T,Vadivel A,Alphonse Rs,Rey-Parra GJ,Weissmann G,Hall A,Eaton F,TheBaud B.干细胞条件培养基改善了小鼠的急性肺损伤:在干细胞的体内证据帕拉克曲线行动。AM j Physiol肺细胞Mol pymiol。2012; 303(11):L967-77。
-
71。
李JW,方X, Krasnodembskaya A, Howard JP, Matthay MA。简明综述:间充质干细胞治疗急性肺损伤:旁分泌可溶性因子的作用。干细胞。2011;29(6):913 - 9。
-
72。
朱伊格,冯晓敏,雅培J,方旭,郝Q,孟塞尔A,等。人骨髓间充质干细胞微泡对大肠杆菌内毒素所致小鼠急性肺损伤的治疗作用。干细胞。2014;32(1):116–25.
-
73。
帕夏Z,王Y,谢赫R,张D,赵T,阿什拉夫M。预处理增强梗死心肌移植过程中干细胞的存活和分化。Cardiovasc Res.2008;77(1):134–42.
-
74。
引用本文:鲁本菲尔德,考德威尔,皮博迪,韦弗J,马丁DP, Neff M,等。急性肺损伤的发生率和结局。中华医学杂志。2005;353(16):1685-93。
-
75。
Hackstein H,Lippitsch A,Krug P,Schevtschenko I,Kranz S,Hecker M,Dietert K,Gruber Ad,Bein G,Brendel C,Baal N.前瞻性定义小鼠间充质干细胞抑制Klebsiella肺炎诱导的急性肺损伤和改善肺炎生存。RESPIR RES。2015; 16:123。
-
76。
麦克唐纳州,Kuehn MJ。冒犯与防御:微生物膜囊泡都发挥两种方式。res microbiol。2012; 163(9-10):607-18。
-
77。
Olaya-Abril A, Prados-Rosales R, McConnell MJ, Martin-Pena R, Gonzalez-Reyes JA, Jimenez-Munguia I, Gomez-Gascon L, Fernandez J, Luque-Garcia JL, Garcia-Lidon C, Estevez H, Pachon J, Obando I, Casadevall A, Pirofski LA, Rodriguez-Ortega MJ。肺炎链球菌产生的保护性胞外膜源性囊泡的特性。蛋白质组学。2014;106:46-60。
-
78。
Monsel A,Zhu YG,Gennai S,Hao Q,Hu S,Rouby JJ,Rosenzwajg M,Matthay MA,Lee JW。人间充质干细胞衍生微泡对小鼠重症肺炎的治疗作用。我是Respir Crit Care医学院的院长。2015;192(3):324–36.
-
79。
Quesenberry PJ,Altiotta JM。骨髓干细胞的矛盾动力学:干细胞,乳头和微铅的考虑。干细胞修订版2008; 4(3):137-47。
致谢
作者愿意对Moira Elizabeth Schottler,Filippe Vasconcellos夫人和Martha McMahan夫人的帮助表达他们的感谢,以便为编辑这篇文章提供帮助。
这项研究得到了巴西科学技术发展委员会(CNPQ)、里约热内卢州研究基金会(FAPEJ)、高等教育协调人(CAPE)和巴西科技部(DESEIT)的支持。
作者信息
隶属关系
通讯作者
附加信息
利益争夺
作者声明他们没有潜在的竞争利益。
作者的贡献
SCA,DJW和PRMR负责审查的概念。SCA负责撰写稿件的初稿。DJW和PRMR负责协助学习选择。DJW和PRMR负责对稿件的批判性审查。所有作者均阅读并批准了手稿。
权利和权限
188滚球软件本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
阿卜勒苏,S.C.,Weiss,D.J.&rocco,p.r.m.来自间充质基质细胞的细胞外囊泡:呼吸系统疾病的治疗选择?干细胞res7.53(2016)。https://doi.org/10.1186/s13287-016-0317-0.
关键词
- 肺动脉高压
- 急性呼吸窘迫综合征
- 间充质基质细胞
- 角质形成细胞生长因子
- 细胞外囊泡