抽象的
背景
三个不同的循环人机单核细胞,CD14明亮的CD16 -(经典),CD14明亮的CD16+(中间)和CD14昏暗的最近已识别CD16 +(非古典)。据报道,CD14明亮的CD16+单核细胞在类风湿性关节炎(RA)中增加。然而,各单核细胞亚群在RA发病机制中的作用尚不清楚。本研究的目的是探讨CD14的相关性明亮的CD16+单核细胞伴RA。
方法
该研究纳入了35名患有RA和14名健康志愿者的患者。通过流式细胞术分析外周血单核细胞的三个亚组。在Ra和健康志愿者患者的基线下测量血清细胞因子。CD14.明亮的将CD16-单核细胞分离并在体外用不同细胞因子培养14小时,评估CD16诱导。
结果
CD14的比例明亮的与健康对照组相比,RA患者的CD16+单核细胞和血清白细胞介素(IL)-6、IL-8和IL-10升高。CD14亮cd16 +单核细胞比例与RA疾病活动性呈正相关,CD14亮cd16 +单核细胞比例与RA疾病活动性呈正相关明亮的CD16-单核细胞带来负相关。孤立的CD14明亮的用IL-6,IL-8和IL-10刺激CD16-单核细胞,该细胞因子显着诱导细胞上CD16表达的唯一细胞因子是IL-10。
结论
CD16的比例明亮的CD14+单核细胞与RA疾病活性呈正相关。IL-10诱导单核细胞CD16表达,IL-6诱导单核细胞CD16表达,IL-8诱导单核细胞CD16表达。我们的结果表明CD16明亮的CD14+单核细胞参与了RA的发病,IL-10是调节单核细胞中CD16表达的关键细胞因子。
背景
类风湿性关节炎(RA)是一种系统性,自身免疫和慢性炎症性疾病,导致疼痛和功能障碍,并导致关节的破坏[1].主要的炎症组织是滑膜,细胞薄的薄膜。免疫细胞,例如中性粒细胞,淋巴细胞和单核细胞,产生炎性细胞因子,包括白细胞介素(IL)-1,肿瘤坏死因子-α(TNF-α),IL-6和粒细胞 - 巨噬细胞群刺激因子(GM-CSF))[2],并参与发炎的发展。众所周知,外周血单核细胞衍生自骨髓中的前体,迁移到滑膜组织中,并分化为产生促炎细胞因子的巨噬细胞[3.].巨噬细胞参与滑膜炎症转化成骨核苷酸,引起RA的关节破坏[2那4.].在促炎细胞因子的影响下,骨核苷酸也来自CD14 +单核细胞[5.].循环CD14 +单核细胞用作内皮细胞的前体,并有助于组织中血管生成的过程[6.].基于此背景,外周血单核细胞的识别和分类对于了解RA的发病机制是必不可少的。
CD16是免疫球蛋白(IG)γFC区III(FCγRIII)的受体。Fcγ受体(FcγRS)在免疫系统中涉及的大多数细胞上表达,包括循环单核细胞,并通过与抗体的相互作用调节免疫应答[7.].根据之前的研究,抗环瓜氨酸肽抗体(ACPA)和瓜氨酸肽形成的免疫复合物似乎与FcγRs结合,刺激RA患者免疫细胞激活和炎症细胞因子释放[8.].因此,FcγRIII是可能与Ra发病机制相关的分子之一。据报道,FcγRIII的异常表达或等位基因变体的存在,可以有助于RA的发病机制[9.].然而,FcγRIII在RA中的调控机制尚不完全清楚。
到目前为止,根据CD14和CD16的表达水平分为CD14 + CD16-(经典)和CD14 + CD16 +亚群[10那11].有报道称,RA患者的CD14+ CD16+单核细胞增多[12].最近,一个新的单核细胞亚群,CD14明亮的定义了CD16 +单核细胞。根据新的分类系统,CD14 + CD16 +人口分为CD14明亮的CD16 +(中间)和CD14昏暗的CD16+(非经典)单核细胞,取决于CD14的表达水平[13].CD14的明亮的CD16-(经典)单核细胞是主要的亚群,而CD14是主要的亚群明亮的CD16+和CD14昏暗的CD16 +子集的数量低于经典单核细胞[11].
已显示CD14明亮的CD16 +单核细胞种群增加炎症或传染病,并且在脂多糖刺激后[14那15]产生TNF-α、IL-1β、IL-6和IL-10。这是新分类的CD14明亮的据报道,RA患者据报道CD16 +单核细胞群体增加,而CD14昏暗的CD16 +单核细胞群没有增加[14].有人建议CD14明亮的CD16+单核细胞可能从外周血迁移到滑膜,并在组织中分化为M1或M2巨噬细胞[16].然而,各亚群在RA中的作用尚未完全阐明。
在本研究中,我们试图研究CD14的参与明亮的RA发病机制中的CD16 +单核细胞,以及CD16在RA患者患者单核细胞上增强CD16表达的可能机制。
方法
主题和学习设计
患者RA(N = 35) (mean age ± SD 59.8 ± 12.6 years, 82.9% female) who met the 2010 American College of Rheumatology/European League Against Rheumatism Classification criteria, and 14 healthy volunteers (mean age 49.2 ± 10.8 (range 30–72), 12 female) were enrolled into the study. All patients visited Keio University Hospital between January 2013 and May 2014 and had never been treated with methotrexate (MTX) or biological agents. They were considered to have moderate or high disease activity (scoring ≥3.2 on the 28-joint disease activity score based on erythrocyte sedimentation rate (DAS28-ESR). All participants gave written informed consent in accordance with the Declaration of Helsinki. MTX was initiated at an oral dose of 4–16 mg weekly. Monocyte subsets from peripheral blood samples were taken at baseline and after 12 weeks of MTX treatment in the patients. Clinical parameters including C-reactive protein (CRP), ESR, matrix metalloproteinase-3 (MMP-3), ACPA, and rheumatoid factor (RF) titers were obtained by routine clinical laboratory methods. DAS28-ESR scores, DAS28-CRP score, clinical disease activity index (CDAI), and simplified disease activity index (SDAI) were also determined at baseline and after 12 weeks of MTX treatment. Clinical characteristics of the patients were retrospectively collected from their medical records.
单核细胞子集确定
肝素化全血沾满了斑斑phycoerythrin-Cy7 (PE-Cy7)共轭anti-CD14(圣地亚哥克隆M5E2, BD Pharmingen CA,美国)和V450-conjugated anti-CD16抗体(克隆3 g8, BD地平线,圣何塞,CA,美国),并分析了使用流式细胞分析仪内置软件(MACSQuant分析仪®和MACSQuantify®软件,Miltenyi研究,格拉德巴赫Bergisch,德国)。基于正向散射/侧散射特性和cd14阳性门控检测单核细胞亚群。亚种群的CD14明亮的CD16 - CD14明亮的CD16 +和CD14昏暗的根据先前的报告,通过CD14和CD16的表面表达模式来区分CD16 +单核细胞[11,并测定各单核细胞亚群的比例。
血清免疫测定
在基线上收集血清样品并储存在-80℃。通过多重电化学荧光测定法测量血清GM-CSF,干扰素-γ(IFN-γ),IL-1β,IL-10,IL-12P70,IL-2,IL-6,IL-8和TNF-α(Meso Scale Discovery Sector Imager 2400Platform®,Meso Scale Discovery,Rockville Md,USA)。Serum macrophage colony-stimulating factor (M-CSF) levels were assessed by enzyme-linked immunosorbent assay (ELISA) (Quantikine® ELISA, Human M-CSF Immunoassay, R&D Systems Inc., Minneapolis MN, USA) and calculated using the manufacturer’s software. Values are expressed in pg/mL and presented as median with interquartile range (IQR).
在体外刺激外周单核细胞
通过密度梯度离心(Ficoll-Paque®,GE Healthcare,Uppsala,Sweden),从五个健康志愿者分离出外周血单核细胞(PBMC)。为了将单核细胞亚群分离,用植物(PE) - 缀合的抗CD14(克隆MφP9,BD Pharmichen)和BV421-CONG16抗CD16抗体(克隆3G8,BD地平线)染色细胞并根据其CD14 / CD16表达进行分选一个细胞分拣机(BD ARIAIII®,BD Biosciences,美国圣何塞CA)。CD14.明亮的CD16-单核细胞以2.5×10培养5./500μl在罗斯威尔公园纪念学院媒体(RPMI-1640®,ATCC,Manassas,VA,USA),10%热灭活胎牛血清(MP生物医学,Santa Ana Ca,USA)。然后用100ng / ml M-C-CSF,1-100(1,10,25,50或100)Ng / ml IL-10,100ng / ml IL-6或20ng,它们刺激14小时14小时/ ml IL-8在37℃下含有5%CO的潮湿气氛2.用pe标记的抗cd14、bv421标记的抗CD16和allophycocyanin (APC)标记的抗hla(人白细胞抗原)-DR(克隆LN3, eBioscience, San Diego CA, USA)抗体对受刺激的单核细胞进行染色,并使用流式细胞仪分析CD16+单核细胞的比例。
检测IL-10受体表达
来自四个健康志愿者的肝素的全血细胞用PE-CY7缀合的抗CD14(克隆M5E2,BD Pharmingen),V450-缀合的抗CD16(克隆3G8,BD地平线),和APC-CONGING抗IL-10染色受体抗体(克隆3F9,Biolegend,San Diego Ca,USA)以及CD14上IL-10受体的表达水平明亮的检测CD16单核细胞亚群。
IL-10中和测定
CD14.明亮的CD16-单核细胞(2.5 × 105./将四名健康志愿者的外周血中的500μL)与25 ng/mL IL-10孵育。在一些实验中,将抗IL-10受体抗体(5μg/mL)(克隆3F9,Biolegend)或大鼠IgG2aκ(5μg/mL)与无关抗原(克隆RTK2758,Biolegend)添加到培养物中。然后测量单核细胞上CD16的表达。
统计分析
我们使用商业统计软件(JMP 11 system®,SAS Institute Inc.,Cary NC,USA)。Wilcoxon秩和检验用于评估组间差异的统计学意义。使用斯皮尔曼秩相关系数分析两个连续变量之间的相关性。Dunn检验用于多种比较程序。A.P.值<0.05认为有统计学意义。
结果
RA患者的临床特征
35例患者的基线特征如表所示1.共有68.6%的RF阳性,61.8%是ACPA阳性。患者的平均DAS28-ESR得分为4.83±0.91。12周的平均MTX剂量为10.8mg /周(8-16)。平均DAS28-ESR在12周内从基线4.83减少到3.53(P. < 0.001) (Table2).其他临床参数也明显降低,见表2.
各单核细胞亚群的比例
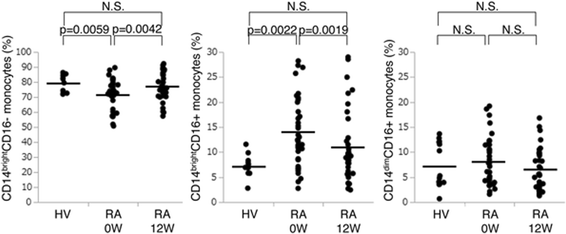
数字1显示来自基线和健康志愿者的RA患者的外周血细胞三种单核细胞亚组。CD14的比例明亮的RA患者的CD16 +单核细胞显着高于健康志愿者(平均14.0±7.0%与7.4±2.2%),而CD14昏暗的CD16+单核细胞在两组之间没有差异(平均7.3±4.5% vs. 8.1±4.9%)。相反,CD14明亮的与健康志愿者相比,RA患者CD16-患者(平均值72.1±9.9%)显着降低了(平均72.1±9.9%)。
CD14的比例明亮的CD16 +, CD14昏暗的CD16 +和CD14明亮的从类风湿性关节炎患者获得外周血中的CD16-单核细胞(类风湿性关节炎)来自基线的健康志愿者(0 W.)及12周(12 W).CD14.明亮的CD16- / CD14.明亮的CD16 + / CD14昏暗的通过流式细胞术鉴定CD16 +单核细胞。在基线和12周内患有RA患者的单核细胞三个亚组的比例(N = 35) was compared with that in healthy volunteers (HV.)(N = 14). Statistical analysis, Wilcoxon rank sum test. Proportions of CD14明亮的CD16 - CD14明亮的CD16 +显着差异。N.S。不重要
在MTX治疗12周后,CD14的比例明亮的CD16 +人口从14.0%到10.9%和CD14的人口显着下降明亮的CD16-单核细胞在RA患者中从72.2%显着增加到77.6%,而CD14的比例没有显着差异昏暗的基线和12周之间的CD16 +单核细胞(表2).
临床参数和单核细胞子集之间的关联
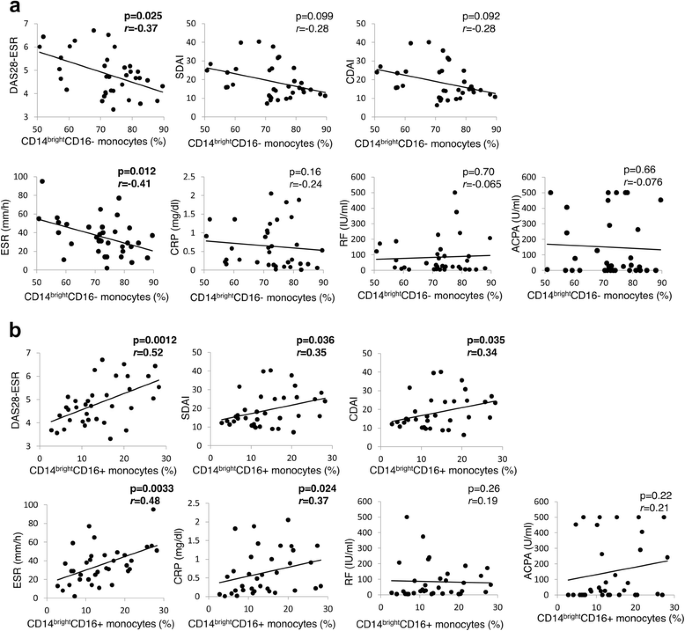
CD14之间的关联明亮的CD16- / CD14.明亮的CD16 +单核细胞和临床参数如图2所示。2.CD14的比例明亮的CD16-单核细胞显着呈负相关(图。2A),而CD14明亮的CD16 +单核细胞显着呈正相关,DAS28-ESR在基线时(图。2B.).这些结果表明了CD14明亮的CD16 +单核细胞呈正相关和CD14明亮的CD16-单核细胞与RA活性呈负相关。CD14的明亮的CD16 +单核细胞子集还与CDAI,SDAI和CRP等其他参数相关。因此,我们利用DAS28-ESR作为以下分析的代表指标。
各单核细胞亚群与血清细胞因子浓度的关系
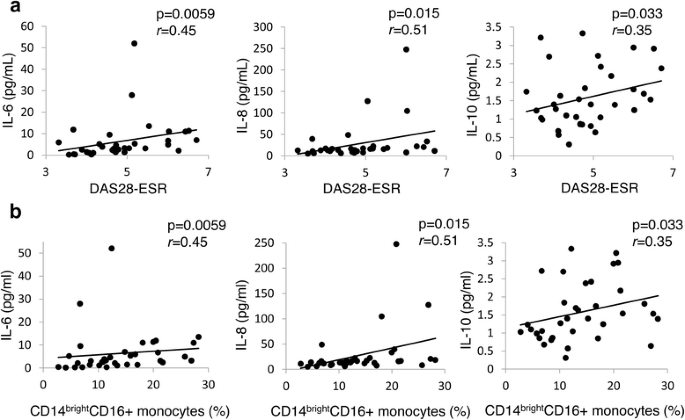
在RA患者比健康志愿者中,在基线中,基线的IL-6,IL-8和IL-10的水平显着更高(表3.).这些细胞因子与DAS28-ESR呈正相关(图。3A).此外,CD14的比例明亮的CD16+单核细胞与血清IL-6、IL-8、IL-10呈显著正相关(图2)。3B.).
IL-10诱导体外单核细胞表面CD16表达
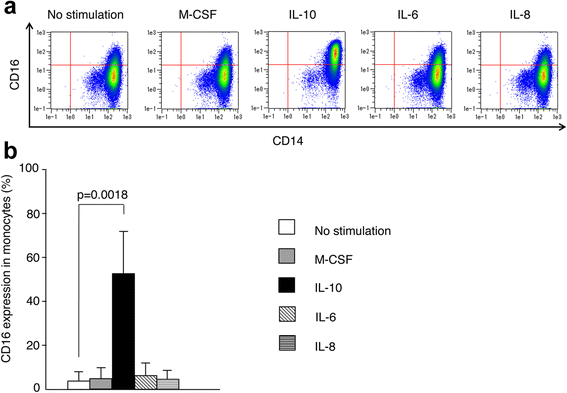
为了研究这些细胞因子如何为单核细胞的CD16表达有助于CD14明亮的来自五个健康志愿者的CD16-单核细胞,并在体外用IL-6,IL-8,IL-10或M-CSF培养细胞14小时。我们试图用M-CSF刺激CD16表达,如前一个报告中所述[12那17].CD14的平均纯度明亮的CD16亚群为96.8%。值得注意的是,在IL-10作用14小时后,细胞上的CD16表达强烈而显著地增加,而M-CSF、IL-6和IL-8没有显著地诱导CD16表达(图2)。4A和B.).评估CD14的等价物明亮的由CD14生成CD16+细胞明亮的CD16-经典单核细胞,我们通过流式细胞术分析培养细胞上HLA-DR的表达,因为CD14的平均荧光强度(MFI)明亮的CD16+单核细胞高于CD14明亮的CD16-单核细胞[14那18].CD14上HLA-DR的MFI明亮的用IL-10培养的CD16 +细胞高于CD14上的HLA-DR的细胞明亮的CD16-不含IL-10的细胞(数据未显示),并几乎与CD14一样增加明亮的外周血CD16 +单核细胞,确认前VIVO CD14明亮的由CD14生成CD16+细胞明亮的CD16-单核细胞具有与天然CD14的HLA-DR表达相同明亮的CD16+细胞。
CD16表面表达CD14明亮的IL-10诱导的CD16-单核细胞。CD14.明亮的来自健康志愿者的CD16-单核细胞(N = 5) were stimulated with M-CSF (100 ng/mL), IL-10 (25 ng/mL), IL-6 (100 ng/mg), or IL-8 (20 ng/mL) for 14 hours. CD16 expression on CD14明亮的流式细胞术检测CD16-单核细胞。一种用巨噬细胞菌落刺激因子刺激后单核细胞的CD14和CD16表达的代表性点图(M-CSF.)、IL-10、IL-6或IL-8持续14小时。B.在健康志愿者中单核细胞的CD16表达(N = 5).酒吧显示中间值 ± SD。统计分析,邓恩检验
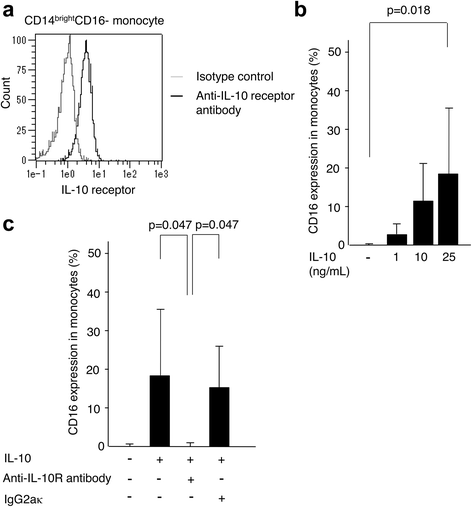
然后我们确认了CD14表面IL-10受体的表达水平明亮的CD16 -单核细胞。结果,超过90%的细胞是IL-10受体阳性(图。5A).当CD14.明亮的将CD16-单核细胞与IL-10(1-50ng / mL)的梯度浓度孵育,CD16表达对单核细胞的表达的比例以剂量依赖性方式增加,1-25ng / ml IL-10(图。5B.).当用50ng / ml IL-10培养细胞时,细胞上几乎存在相同的CD16水平。为了通过IL-10受体确认IL-10的直接效果,我们进一步使用抗IL-10受体阻断抗体进行中和测定。结果,细胞上的CD16水平增强(18.3±17.1%,P.= 0.047),添加抗IL-10受体抗体显著抑制(0.19±0.19%),而同型对照(igg2b κ)未抑制(15.3±10.5%)。P. = 0.047) (Fig.5C).这些结果表明,通过IL-10受体的细胞信号有助于调节单核细胞上的CD16表达。
通过阻断IL-10受体抑制CD16表达对单核细胞的表达。一种用allophycocyanin (APC)偶联的抗IL-10受体和大鼠IgG2aκ抗体在CD14表面表达IL-10受体代表了平均荧光强度明亮的CD16 -单核细胞。B.CD14.明亮的来自健康志愿者的CD16-单核细胞(N = 4), stimulated with various concentrations of IL-10 (0, 1, 10, 25 ng/mL) for 14 hours.CCD14.明亮的IL-10 (25 ng/mL)、抗IL-10受体抗体(5 μg/mL)和/或大鼠IgG2aκ (5 μg/mL)刺激健康志愿者的CD16-单核细胞。观察IL-10和抗IL-10受体抗体(5 μg/mL)对培养14h单核细胞CD16表达的影响。无IL-10和IL-10 +抗IL-10受体培养的单核细胞中CD16表达中位数分别为0.06%和0.13%。酒吧(B.那C)显示中位数±SD。统计分析,Dunn的测试
讨论
在这项研究中,我们证明了循环CD14明亮的CD16 +单核细胞在活性相的患者中增加,并以与降低疾病活性相关的方式在MTX治疗后降低。此外,这种单核细胞子集与外周血中炎性细胞因子的表达相关,并且细胞因子IL-10在RA患者中增加,诱导单核细胞的CD16表达。这些结果表明CD14明亮的CD16 +单核细胞在RA的发病机制中发挥作用,并且IL-10是调节CD16表达的关键细胞因子。
虽然CD14增加明亮的有文献报道RA患者的CD16+单核细胞[14],CD14之间相关的可能性明亮的未治疗的活动性RA患者的CD16+单核细胞和细胞因子尚未被研究。既往研究未排除治疗对细胞因子和疾病活动的任何影响,因为这些研究中的类风湿性关节炎患者不是treatment-naïve。我们的结果支持先前的观察[14并显示CD14的比例明亮的与健康对照组相比,treatment-naïve活动期RA患者的CD16+单核细胞增加,并与这些患者的疾病活动呈正相关。
我们进一步表明CD14明亮的CD16-与RA疾病活动呈负相关。值得注意的是,CD14的比例明亮的CD16+单核细胞减少,CD14单核细胞减少明亮的当患者接受MTX治疗时,CD16-单核细胞增加。
虽然CD14的功能明亮的CD16+单核细胞在RA中的作用尚不清楚,根据我们的研究发现CD14可能参与了RA的发病机制明亮的MTX治疗后CD16 +单核细胞减少。已经表明MTX抑制炎症细胞因子生产[19],并诱导免疫细胞凋亡[20.]但尚未发现抑制单核细胞的特定子集。减少CD14比例的原因之一明亮的MTX治疗后的CD16+单核细胞可能是继发于RA疾病活动改善的现象。
据报道,M-CSF在引入CD14中起着重要作用明亮的CD16 +单核细胞。抗M-CSF抗体导致循环CD14的降低明亮的CD16+和CD14昏暗的CD16+单核细胞在2例活动性RA患者中的临床试验[17].此外,已发现M-CSF和IFN-γ治疗诱导CD16表达癌症或淋巴瘤患者循环单核细胞[21].研究表明,在CD14上添加M-CSF或IL-10的全PBMCs培养单核细胞可诱导CD16表达明亮的体外CD16-单核细胞[12].虽然本报告可能表明细胞因子的可能直接作用,但它并没有排除与PBMC中其他小区子集的相互作用。在我们的研究中,使用高度纯化的CD14明亮的CD16-单核细胞,我们清楚地表明IL-10,而不是M-CSF,直接诱导CD14中的CD16表达明亮的CD16 -单核细胞。此外,我们证明了加强CD14对CD14的表达明亮的通过抗IL-10受体抗体中和实验,发现CD16单核细胞需要与IL-10和IL-10受体相互作用。
众所周知,IL-10在RA的发病机制中起着至关重要的作用,如抗炎和/或促炎作用。已证明IL-10可抑制免疫细胞产生IL-6、TNF-α和GM-CSF[22],并增强B细胞分化对分泌IgG,IgM和IgA的细胞[23那24],在外周血中通过B细胞增加RF和IgG-RF产生增加。此外,IL-10本地化为滑膜膜衬里层,单核细胞迁移部位,并抑制RA中的促炎细胞因子[25].在这项研究中,我们证明,与健康志愿者相比,RA患者血清IL-10显着提升,并与疾病活动相关。
IL-10由多种细胞分泌,如t细胞、b细胞、巨噬细胞、树突状细胞、自然杀伤细胞和单核细胞本身[26-28].据据悉,通过人类Na-10产生的单核细胞对单核细胞的CD16表达是通过人类Na-10产生的[29].CD14的功能明亮的CD16 +单核细胞可以由产生IL-10的这些细胞调节。IL-10随着CD14减少的RA患者倾向于降低明亮的CD16+单核细胞。IL-10可能参与了RA患者单核细胞CD16的诱导。
我们注意到我们的研究有两个限制。首先,患者的数量相对较小,尽管足够大以提供统计学上显着的数据。其次,我们没有显示CD14明亮的CD16 +单核细胞与体内RA中的炎性细胞因子直接相关。CD14中的IL-6和TNF-α的生产明亮的CD16+单核细胞不高于CD14明亮的CD16-monocytes(附加文件1).我们以为CD14明亮的CD16 +单核细胞可以发挥炎症和抗炎作用,其效果的优势将取决于产生IL-10的细胞。在未来的研究中需要澄清ra中这些单核细胞的功能。
结论
总之,我们已显示CD14明亮的CD16 +单核细胞比例与RA患者的疾病活动相关,CD16明亮的CD14 +单核细胞由IL-10诱导,但不是由RA患者血清上调的其他细胞因子。我们的结果表明CD16明亮的CD14 +单核细胞可能参与RA的发病机制,IL-10应该是调节单核细胞中CD16表达的关键细胞因子。
缩写
- ACPA:
-
抗环瓜氨酸肽抗体
- APC:
-
联素键素
- CDAI:
-
临床疾病活动指数
- CRP:
-
c反应蛋白
- DAS-28:
-
疾病活动得分在28个关节计数中
- ELISA:
-
酶联免疫吸附测定
- ESR:
-
红细胞沉积率
- FcγRIII:
-
免疫球蛋白γFC区III的受体
- FCγRS:
-
Fcγ受体
- gm - csf:
-
集落刺激因子
- 哈克:
-
健康评估问卷
- HLA:
-
人类白细胞抗原
- IFN:
-
干扰素
- IG:
-
免疫球蛋白
- IL:
-
白细胞介素
- IQR:
-
四分位范围
- M-CSF:
-
巨噬细胞集落刺激因子
- MFI:
-
平均荧光强度
- MMP-3:
-
基质金属蛋白酶-3
- MTX:
-
甲氨蝶呤
- 体育:
-
藻红蛋白
- RA:
-
类风湿关节炎
- 射频:
-
类风湿因素
- SDAI:
-
简化疾病活动指数
- 肿瘤坏死因子:
-
肿瘤坏死因子
工具书类
- 1.
Feldmann M.抗TNF治疗类风湿性关节炎的发展。NAT Rev Immunol。2002; 2:364-71。
- 2.
麦克尼斯IB,Schett G.类风湿性关节炎的发病机制。n Engl J Med。2011; 365:2205-19。
- 3。
史志华,帕默。感染和炎症时单核细胞的补充。2011; 11:762-74。
- 4。
Kennedy A, Fearon U, Veale DJ等。滑膜炎症中的巨噬细胞。Immunol前面。2011;2:52。doi:10.3389 / fimmu.2011.00052.
- 5。
Massey HM,Flanagan Am。人骨骨骨液源于CD14阳性单核细胞。Br J oematol。1999; 106:167-70。
- 6。
等。单核细胞活化在兔后肢血管生成和侧枝生长中的作用。J clinj Invest. 1998; 101:40-50。
- 7。
Hogarth PM,Pietersz Ga。Fc受体靶向治疗炎症,癌症及以后。NAT Rev Disp Discov。2012; 11:311-31。
- 8。
补体和Fc γ R系统在关节炎发病机制中的作用。关节炎研究。2005;7:129-35。
- 9。
Takai T. FC受体在自身免疫中的角色。NAT Rev Immunol。2002; 2:580-92。
- 10.
Ziegler-Heitbrock HW。人外周血中一种新的单核细胞亚群的鉴定和特性。血。1989;74:2527-34。
- 11.
王坚,叶文辉,邰俊杰,等。人类单核细胞的三个亚群:对健康和疾病的影响。Immunol杂志2012;53:41-57。
- 12.
Kawanaka N,Yamamura M,Aita T,等。CD14 +,CD16 +血液单核细胞和类风湿性关节炎中的关节炎症。关节炎Rheum。2002; 46:2578-86。
- 13。
Ziegler-Heitbrock L,Ancuta P,Crowe S等人。血液中单核细胞和树突细胞的命名。血。2010; 116:E74-80。
- 14。
Rossol M,Kraus S,Pierer M,等。CD14(明亮)CD16 +单核细胞子集扩增了类风湿性关节炎,促进了Th17细胞群的扩增。关节炎Rheum。2012; 64:671-7。
- 15.
Skrzeczyńska-moncznik J,Bzowska M,Loskke S等人。外周血CD14High CD16 +单核细胞是IL-10的主要生产商。Scand J Immunol。2008; 67:152-9。
- 16。
杨杰,张L,yu C,等。单核细胞和巨噬细胞分化:循环炎症单核细胞作为炎症性疾病的生物标志物。Biomark Res。2014; 2:1。doi:10.1186 / 2050-7771-2-1.
- 17。
Korkosz M,Bukowska-Strakova K,Sadis S等人。针对巨噬细胞菌落刺激因子的单克隆抗体在类风湿性关节炎患者中减少了循环中间体和非生物化(CD14(++)CD16(+)/ CD14(+)CD16(++))单核细胞的数量。血。2012; 119:5329-30。
- 18。
Abeles Rd,Mcphail MJ,Sowter D等人。CD14,CD16和HLA-DR可靠地识别通过CD14(HI)/ CD16(NEG)单核细胞的病理上减少HLA-DR表达的背景下的人单核细胞及其子集:CD14(HI)/ CD16(POS)的扩展和收缩CD14(LO)/ CD16(POS)急性肝功能衰竭的单核细胞。Cytometry A. 2012; 81:823-34。
- 19。
陈ES, Cronstein BN。甲氨蝶呤在炎症性疾病中的分子作用。关节炎研究》2002;4:266 - 73。
- 20。
Cutolo M,Sulli A,Pizzorni C等人。类风湿性关节炎中甲氨蝶呤的抗炎机制。ann Rheum dis。2001; 60:729-35。
- 21.
Weiner Lm,Li W,Holmes M等。I相试验重组巨噬细胞菌落刺激因子和重组γ-干扰素:毒性,单吞吐量和临床疗效。癌症res。1994年; 54:4084-90。
- 22.
金泉T,Larsen CG,Gesser B等。人IL-10是CD8 + T淋巴细胞和IL-8诱导的CD4 + T淋巴细胞迁移的抑制剂的化学抑制剂。J免疫酚。1993; 151:4545-51。
- 23.
o'garra a,chang r,go n等。LY-1 B(B-1)细胞是B细胞衍生的白细胞介素10.欧J免疫素的主要来源。1992年; 22:711-7。
- 24.
Rousset F,Garcia E,Defrance T等人。白细胞介素10是活化人B淋巴细胞的有效生长和分化因子。Proc Natl Acad Sci USA。1992年; 89:1890-3。
- 25。
Katsikis Pd,Chu CQ,Brennan FM,等。白细胞介素10在类风湿性关节炎中的免疫调节作用。J Exp Med。1994年; 179:1517-27。
- 26。
Blanco E,Moñuxg,mas a等。IL-10启动子多态性在严重主轴闭塞性疾病发展中的作用。嗡嗡声免疫素。2008; 69:651-4。
- 27。
王志强,王志强,王志强,等。肝NK细胞和腹腔巨噬细胞在小鼠实验性细菌性腹膜炎γ干扰素和白细胞介素-10产生中的作用感染Immun。1998;66:5286 - 94。
- 28。
Chomarat P,Rissoan MC,Banchereau J等人。干扰素γ抑制单核细胞的白细胞介素10产生。J Exp Med。1993年; 177:523-7。
- 29。
刘y,杨b,ma j等。白细胞介素-11通过人类Na-10通过人类Na 4 + T细胞生产CD16对单核细胞的表达。细胞免疫酚。2011; 267:102-8。
致谢
作者真诚地感谢Harumi Kondo女士和Mayumi Ota女士在获取临床信息方面的帮助。
资金
这项工作得到了Keio University的机构研究资助的支持。
数据和材料的可用性
补充方法和图。
作者的贡献
MT,NS,Kyo,Ks,Kya和TT参与起草手稿。所有作者都参与了批判性地修改了重要的智力内容,并修改最终版本。TT完全访问研究中的所有数据,并负责数据的完整性以及数据分析的准确性。所有作者都参与了研究理念和设计,并参与了数据的收购,以及数据分析和解释。所有作者均阅读并批准了手稿。
利益争夺
MT和Kyo对申报感兴趣的冲突。NS已收到Chugai Pharmaceutical Co.,Ltd.的研究赠款,Mitsubishi Tanabe Pharma Co.,Ono Pharmaceutical Co.,Ltd。和Nippon Kayaku Co.,Ltd。Ks已收到Eisai Co.,Ltd。和布里斯托尔的研究赠款- myers squibb。Kya已获得辉瑞公司,郑楚国药业有限公司,三菱 - 塔宾制药公司,ABBVIE的顾问费用,并获得富辉瑞,楚格赖制药有限公司,Mitsubishi-Tanabe Pharma Co.,Bristol-Myers Squibb,Takeda Industrial Pharma,Glaxosmithkline,Nippon Shinyaku,Eli Lilly,Janssen Pharma,Eisai Pharma,Astellas Pharma和Acterlion Pharmaceutical以及来自Chugai Pharma和Mitsubishi-Tanabe Pharma的研究支持。TT has received lecture fees or research grants from Abbott Japan Co., Ltd., Astellas Pharma, Bristol-Myers K.K., Chugai Pharmaceutical Co, Ltd., Daiichi Sankyo Co., Ltd., Eisai Co., Ltd., Janssen Pharmaceutical K.K., Mitsubishi Tanabe Pharma Co., Pfizer Japan Inc., Sanofi-Aventis K.K., Santen Pharmaceutical Co., Ltd., Teijin Pharma Ltd., Asahikasei Pharma Corp., Taisho Toyama Pharmaceutical Co., Ltd., Janssen Pharmaceutical K.K., Astra Zeneca K.K., Eli Lilly Japan K.K., Novartis Pharma K.K., and Abbvie GK.
同意出版物
书面知情同意书是从患者获得的,以出版本文中的个人细节。该同意书由作者持有,可供本杂志主编审查。
伦理批准和同意参与
本研究经受Keio大学医学院的机构审查委员会批准,并遵守赫尔辛基宣言。参与者提供了知情同意参加。
作者信息
隶属关系
通讯作者
附加文件
额外的文件1:
补充方法和图。(ZIP 314 KB)
权利和权限
188滚球软件本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
Tsukamoto,M.,Seta,N.,Yoshimoto,K。et al。CD14.明亮的CD16 +中间体单核细胞由白细胞介素-10诱导,并与类风湿性关节炎中的疾病活性呈正相关。关节炎研究与治疗19,28 (2017). https://doi.org/10.1186/s13075-016-1216-6
已收到:
公认:
发表:
关键字
- 类风湿性关节炎
- 单核细胞
- 白细胞介素-10
- CD16