文摘
背景
纤维细胞与特发性肺纤维化(IPF)发病机理和发行量的增加比例与不良预后相关。组织损伤后,纤维细胞迁移到受影响的器官。在IPF患者中,循环纤维细胞增加,特别是在急性加重,但是纤维细胞在肺部没有检查。
因此,我们试图评估如果在IPF肺纤维细胞可以被检测到,我们比较百分比和肺纤维细胞的表型特征和IPF循环纤维细胞。
方法
首先我们优化流仪检测使用的独特组合内部循环纤维细胞和细胞外标记建立一个坚实的控制策略。接下来我们分析肺纤维细胞的单个细胞悬浊液外植IPF和控制特点和数字相比肺和IPF的循环纤维细胞。
结果
使用控制策略对循环和肺纤维细胞,不包括潜在污染细胞群(如中性粒细胞和不同的白细胞的子集),我们表明,IPF患者纤维细胞的比例增加,不仅在流通,而且在外植终末期IPF肺。HLA-DR这些肺纤维细胞表面表达增加,增加细胞内collagen-1表达式,也改变了前进和侧散射特征与循环同行相比。
结论
这些发现表明肺纤维细胞IPF患者可以量化和流式细胞术的特征。肺纤维细胞比循环纤维细胞有不同的特征,代表了一个中间的细胞群之间循环纤维细胞和肺纤维母细胞。因此,更多的信息在他们的表型可能导致肺纤维化疾病。具体的治疗目标
背景
纤维细胞被认为是成纤维细胞的前体,首次在实验小鼠皮肤创伤模型描述为骨骨髓来源的细胞产生细胞外基质蛋白质帮助伤口愈合(1]。纤维细胞来源于一个共同的单核细胞谱系(2)和组织损伤,他们迁移到受影响的器官趋化因子,分化成纤维母细胞。分化成(myo) fibrobalsts旁边,纤维细胞被认为显示几旁分泌功能,包括成纤维细胞活化,替代macrophage-dependent和独立的炎症过程,所有可能导致组织重构和纤维化3,4,5,6,7]。的贡献纤维细胞纤维化疾病的发病机理和潜在的使用作为肺纤维化疾病的生物标志物和肺动脉高压(PH)调查,因为他们与疾病进展和生存8,9,10,11]。
然而,一个统一的缺乏(浇注)策略来确定纤维细胞。人们普遍认为所需的最小标记CD45(造血标记)和胞内collagen-1 [12,13,14]。意见差异如何进一步精确地描述纤维细胞可能来源于两种可能的问题。首先,目前尚不清楚其他细胞外标记是真正需要的,如果是这样,哪一个会是最优的。最常CD34(造血干细胞标记)和趋化因子受体CXCR4 (C-X-C趋化因子受体4),在几乎所有的循环纤维细胞,表达。其次,没有共识是否循环纤维细胞是细胞与高压侧散射(SSC)特点,衡量细胞粒度或内部的复杂性。大多数研究表明,CD45+/ collagen-1+纤维细胞是一个异质的细胞群中发现的主要多形核细胞(中性粒细胞)分数高的SSC [8,9,13,14,15]。相比之下,其他人则表明循环纤维细胞与血液单核细胞比例分享侧散射特性类似的基于细胞分选实验(16,17]。因此,目前尚不清楚SSC代表不同的亚种群的差异,不同的发展阶段或这是否反映了方法论的问题。
肺纤维细胞可能承诺在更好地了解纤维细胞生物学,他们已经完全分化的效应细胞和旁分泌和炎症功能已经成形。
增加CD45+/ collagen-1+纤维细胞中发现了支气管肺泡灌洗(BAL) IPF患者[18]。然而,在IPF肺纤维细胞是否可以检测到肺组织匀浆使用流式细胞术是目前未知。
在我们的研究中,我们提出的控制策略和表型染色更具体的循环和肺纤维细胞的选择和比较的比例和IPF肺组织肺纤维细胞的表型特征与IPF患者循环纤维细胞。循环和肺纤维细胞的可靠识别可能是很有价值的开发新疗法的目标在IPF循环和肺纤维细胞。
材料和方法
研究设计和主题
人类肺组织收集的终末期IPF患者接受肺移植。控制,肺组织获得长体积减少程序在肺移植后大小不匹配的超大号的供体肺或剩余材料获得在肺癌手术治疗肺肿瘤。健康的残余组织获得至少> 3厘米的肿瘤患者,只有正常的肺功能测试(击球)或轻微气流阻塞(黄金1)被选中。所有患者和健康的主题特征额外的文件所示1。
鹿特丹伊拉斯谟MC的医学伦理委员会批准了这项研究(METC 2012 - 512)。知情同意是来自每一个参与者和健康的控制(HC)之前收集的血液样本。肺动脉高压的诊断或肺纤维化是符合当前诊断指南ATS /人(19,20.,21]。
血液处理
在EDTA管收集血液样本(BD真空采血管K2E)。外周血单核细胞(PBMC)和总白细胞获得根据标准协议。简而言之,PBMC获得使用聚蔗糖与简单的分离技术和全白血细胞巴斯德吸管管技术后旋转样品在1000 x g如前所述22]。红细胞溶解使用渗透裂解缓冲NH (8.3%4CL, 1% KHCO3,0.04%的钠2EDTA Milli-Q)。在隔离,PBMC和总白细胞在0.1% BSA resuspended + 2毫米的EDTA PBS和流式细胞术和fluorescence-activated细胞立即处理排序(流式细胞仪)。分离PBMC或白细胞总数,而不是用于直接流式细胞术或流式细胞仪、整除、低温贮藏完全RPMI (RPMI 1640 + glutaMax媒介,生活技术)为10% DMSO(σ),40%胎牛血清(FCS)和存储在−196°C到解冻。
肺组织处理
新鲜肺组织是存储在寒冷PBS和处理在24 h后肺移植或切除。肺组织处理孤立的单个细胞悬浮液中描述的部分“单一细胞悬浮液的制备”。此外,周围肺组织冷冻和储存在−80°C,直到进一步的使用。
制备单一细胞悬浊液
肺切除标本与PBS冲洗,去除残留的血液。装腔作势的肺后,标本被酶消化消化介质(20毫升哈佛商学院(生活技术,14170 - 088年)与10μg Liberase(罗氏,Liberase™,研究级)和40单位DNA-se(罗氏,DNase我重组,RNase-free))为30分钟湿润孵化器在37°C而轻轻颤抖的样品。剩余的细胞碎片被通过细胞通过一个100μm-diameter一次性细胞网状过滤器。这些细胞被洗的RPMI 5% FCS和离心10分钟的速度400×g。样品受到红细胞裂解,清洗和统计。最后,样本整除和低温贮藏在完整的RPMI 10% DMSO(σ),和40%胎牛血清(FCS)和存储在−196°C。
人类纤维细胞和纤维母细胞的文化
人类纤维细胞培养从外周血如前所述7),做了一些调整。短暂,聚蔗糖密度离心后,2×10 ^ 5 PBMCs被镀成culture-slides(σ,C7182, 0.8厘米2/)完全培养基(杜尔贝科的修改鹰的介质)(DMEM)补充20%胎牛血清,2毫米谷酰胺,100 U /毫升的青霉素、链霉素的100毫克/毫升)(生活技术,大岛,纽约)37°C和5%的二氧化碳。3天后,non-adherent细胞吸气和丢弃和新鲜中应用。后10 - 14天的文化、幻灯片和冰冷的洗了三次PBS和钱伯斯从玻璃中删除。正常的人类肺成纤维细胞(NHLF)也培养文化幻灯片(50000 NHLF /)完全培养基。NHLF是弗吉尼亚大学的捐赠从实验室(医学院的夏洛茨维尔,弗吉尼亚州,美国)。2 - 3天后non-adherent NHLF吸气和丢弃。随后,培养NHLF用冰冷的PBS,加工而成的,类似于人类纤维细胞培养。
流式细胞术和流式细胞仪染色
新孤立PBMCs和总白细胞染色了额外和胞内抗体标记使用以下:CD45-V450 (HI30) CD56-Af488 (B159 RUO) CD15-PE (HI98) CD16-PerCP-Cy5.5八国集团(3)HLA-DR-BV711 (G46-6)趋化因子受体CXCR4 (CD184) -Pe-Cy7 (12 g5) (BD生物科学),strep-APC-eF780, CD3-FITC (UCHT1) CD19-FITC (HIB19) (eBiosciences) Collagen-1-Biotin共轭生物(大600-406-103),CD14-PE-Texas红(Tuk4)(表达载体)。为非特异性标记控制兔子IgG-Biotin共轭(大011 - 0602)是使用。抗体的细胞分类实验中,相同的细胞外被使用,除了HLA-DR: HLA-DR-APC (G46-6) (BD生物科学)。
自从在肺巨噬细胞单细胞悬浮体有很高的汽车荧光,我们没有使用荧光染料FITC染色和Alexa萤石488,使用以下抗体:CD3-BV711 (UCHT1) CD19-BV786 (J25C1) CD56-BV605 (NCAM16.2) (BD生物科学)。可确定的可行性染料eFluor 506 (eBiosciences)应用作为live-dead标记流式细胞仪实验和4′,6-diamidino-2-phenylindole (DAPI)(表达载体、分子探针)用作细胞live-dead标记分类实验。总之,细胞培养在流式细胞仪缓冲区(PBS, 0.25% BSA, 0.5毫米EDTA, 0.05% NaN3叠氮化钠)与荧光抗体30分钟在4°C使用制造商推荐的方法。值得注意的是,细胞外CXCR4-Pe-Cy7染色进行分别在mac缓冲区(0.5% BSA在PBS EDTA + 2毫米)。在固定和透化作用(BD Cytofix / Cytoperm装备,554714),细胞与生物素化的孵化Collagen-1抗体或同形像控制透化作用缓冲在4°C为30分钟。生物素化的抗体与streptavidin-APC-eF780可视化。细胞在LSRII或流式细胞仪测定咏叹调™IIu流式细胞分析仪(BD生物科学)。我们分析了最少200000活细胞血液样本和100000年活细胞仪分析肺组织样本。分析了数据流式细胞仪Flow-Jo软件。
Cytospin
在PBS排序细胞被洗。Cytospins是使用cytocentrifuge每点和50000个细胞补充道。幻灯片被风干,储存在密封箱−80°C,直到进一步的使用。免疫细胞化学存储后4周内完成−80°C。
免疫细胞化学
Cytospin-slides固定在100%丙酮在室温下15分钟。collagen-1染色,幻灯片pre-incubated 10%正常山羊血清(σ,G9023)块缓冲区(1%阻塞试剂,罗氏,PBS根据制造商的协议)30分钟。与PBS冲洗后,幻灯片和鼠标反collagen-1孵化60分钟(Abcam ab6308, 1:20 00)或同形像控制块缓冲区。第二(山羊anti-mouse抗体biotin-labeled)和第三抗体(链霉亲和素,碱性磷酸酶(美联社)共轭)我们使用了从Biogenex链接标签工具(链接:hk - 325 -嗯,标签HK321-UK)根据制造商的协议。检测collagen-1阳性细胞我们使用新的碱性品红碱性磷酸酶底物溶液(0.01%新洋红,0.02%亚硝酸钠,0.03%磷酸萘酚是双,1毫米左旋咪唑,在0.2 M Tris-HCl, pH值8.5)。细胞与苏木精复染色(σ,吉尔3号),干和安装在Vecta山(美国向量,伯林盖姆,CA)。CD15检测我们使用相同的协议,但由于不同的抗体;幻灯片是pre-incubated正常兔血清(σ,R9133)和随后沾鼠标反CD15-FITC (BD生物科学,HI98)或同形像控制和老鼠anti-FITC美联社共轭(σ,A4843)。
统计数据
统计分析了使用IBM SPSS统计21和GraphPad棱镜6软件。在评估不同的多个独立的团体之间的连续变量,克鲁斯卡尔-沃利斯测试使用。计算重要性水平组之间的差异我们使用Mann-Whitney U测试。用斯皮尔曼相关系数计算的排名方法。P值< 0.05被认为是重要的。流式细胞仪数据表示为人口百分比或平均荧光强度(MFI)。
结果
循环CD45+/ Col-1+纤维细胞可能含有多形核白细胞
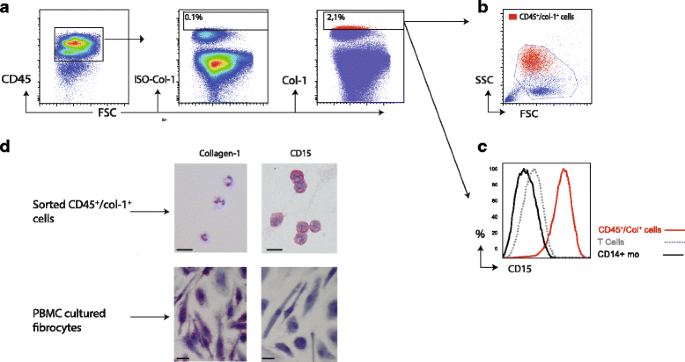
差异以来报道有关他们的粒度和/或纤维细胞内部的复杂性,我们首先评估SSC纤维细胞的特点确定基于CD45和collagen-1 (Col-1)表达式。纤维细胞被发现使用图中所示的控制策略。1。Col-1表达是基于控制同形像染色。循环CD45+/ Col-1+纤维细胞代表了异质的细胞群主要基于SSC和高鳞状细胞癌(无花果。1 b)因为SSC-high细胞包含多形核的细胞,如中性粒细胞,我们检查了粘附分子CD15表达循环中性粒细胞(23]。CD45的+/ Col1+细胞表现出细胞外表达水平高CD15(无花果。1 c)。调查是否该人群可能含有中性粒细胞,我们孤立CD45传播+/ Col-1+基于细胞外的细胞标记所示(排序策略附加文件2),并分析了这些细胞与免疫细胞化学(无花果。1 d)。几乎所有细胞(95% CI 97 98, 6日,9 - 99,2)在flowcymetric丰富CD45+/ Col-1+人口是CD15 collagen-1消极和积极的免疫细胞化学,而培养纤维细胞(图1 d)和成纤维细胞(附加文件3)积极染色为CD15 collagen-1和消极。此外,所有细胞丰富CD45+/ Col-1+组multi-lobulated形核。我们还发现循环CD45之间显著相关+/ Col-1+细胞和中性粒细胞(R = 0.39, p = 0.006)(附加文件4)。
循环CD45+/ Col-1+纤维细胞都含有多形核白细胞。一个代表控制策略循环CD45的识别+/ Collagen-1+从PBMCs纤维细胞。同形像控制collagen-1 (Col-1)是用于设置的门Col-1 CD45 +细胞在活着+细胞。红细胞是CD45+Col-1+。bFSC和SSC CD45的特征+/ Col-1+细胞(红色)相比,所有活细胞(蓝色)显示,大多数CD45+/ Col-1+细胞中发现的多形核白细胞分数。c直方图叠加显示的表面表达CD15评估CD45流式细胞术+/ Col-1+细胞(红色),CD14 +单核细胞(黑)和T细胞(灰色)。dCD45+/ Col-1+细胞丰富分数和PBMC培养纤维细胞与免疫细胞化学分析(ICC) CD15和collagen-1表达式。放大为所有国际刑事法庭的数字是200×和部分与苏木精复染色。这是代表7实验
CD14 +莫= CD14 +单核细胞,PBMC =外周血单核细胞,FSC =向前散射,SSC =边撒。
总之,我们的数据表明,PMN-leukocytes尤其是中性粒细胞污染纤维细胞识别当使用只有CD45和collagen-1作为识别标记。因此循环纤维细胞的百分比很可能低于之前报道。
肺纤维细胞的识别和表征在IPF肺
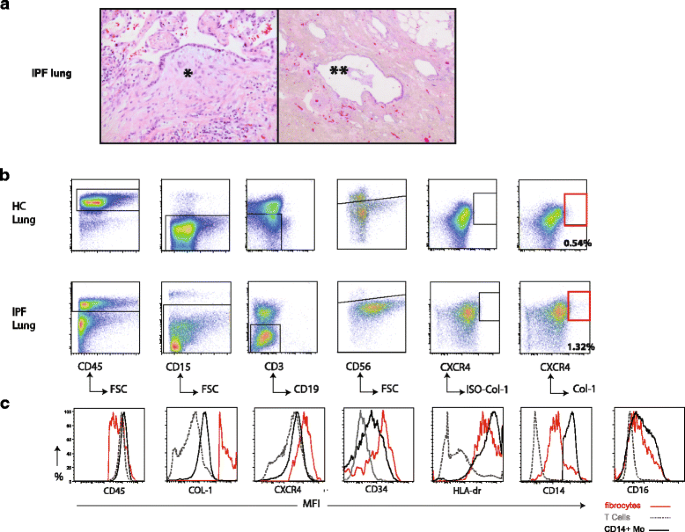
在外周血中性粒细胞阻碍纤维细胞的识别,我们开发了一个策略,选择性地识别纤维细胞。自循环纤维细胞是一个假定的来源成纤维细胞的焦点,IPF的一个特点,我们使用IPF肺来测试我们的控制策略。肺纤维细胞在肺IPF最初维护CD45的表情和他们的存在与免疫荧光(之前确认11,24]。我们获得单细胞悬浮体肺移植IPF (n= 3)。作为一个控制我们使用健康肺组织肺减容手术在肺移植或剩余材料叶切除术病人的肺癌,以下称为控制肺(n= 4)。
在这项研究中使用的所有移植肺的IPF患者综述了病理学家和满足的标准通常的间质性肺炎(摘要)模式(无花果。2)。我们下一个评估我们是否能够选择性地识别纤维细胞中性粒细胞排除后,T细胞、NK细胞和B细胞。使用此策略,我们可以区分人口纤维细胞表达CD45,趋化因子受体CXCR4和胞内collagen-1 IPF肺和肺(图控制。2 b)。
肺纤维细胞的识别和表征在IPF肺。代表组织移植的终末期肺IPF的照片显示(左):一般的间质性肺炎(摘要)模式(*)一个与上覆反应上皮和纤维母细胞集中(右):(* *)的区域完全纤维化的改建与囊肿形成和bronchiolisation肺组织,总共形成蜂窝状。放大20×5×(左)和(右)。b肺纤维细胞(CD45代表控制策略+CD15−CD3−CD19−CD56−趋化因子受体CXCR4+Col-1+肽)在肺移植IPF (n= 3底部)和控制肺(HC,) (n= 4)。单个细胞悬浮液被解冻,活着的细胞进行了进一步的分析。CD45肺纤维细胞存在+细胞群。污染和不必要的CD15+中性粒细胞,CD3+T细胞,CD19+B细胞和CD56+nk细胞顺序被排除在外。同形像控制Col-1设置门用于Col-1 +细胞。c代表直方图叠加显示表达水平描绘成MFI表示标记的评估与肺纤维细胞的流式细胞术(红色),T细胞(灰色)和CD14 +单核细胞(黑色)。CD14 +莫= CD14 +单核细胞,MFI =平均荧光强度
纤维细胞表达CD45,趋化因子受体CXCR4和CD34细胞内collagen-1通常认为成熟的分组人口CD14 +单核细胞(25]。图2摄氏度显示了这些标记物的表达水平和HLA-DR, CD14, CD16肺纤维细胞(CD45+CD3−CD19−CD56−CD15−趋化因子受体CXCR4+Col-1+)。肺纤维细胞CD45表情略低于t细胞和CD14 +单核细胞。不出所料,collagen-1和表达的趋化因子受体CXCR4显然是肺纤维细胞CD14 +单核细胞和T细胞。常用的祖细胞标记,CD34表达时在纤维细胞进入肺。HLA-DR表情肺tissue-resident纤维细胞类似于CD14 +单核细胞和T细胞相比,相同的捐献者。Tissue-resident纤维细胞CD14的显示一个中间表达(表达水平之间CD14 +单核细胞和T细胞CD14 -)和CD16表达相对较低。
总之,肺纤维细胞中可以检测到肺排除中性粒细胞单个细胞悬液后,T细胞、NK细胞和B细胞。肺纤维细胞表达已知纤维细胞表面标记如CD34、CD45、和趋化因子受体CXCR4和胞内Col-1标志,表明他们刚刚进入肺组织,还没有分化成myofibroblasts。肺纤维细胞的高表达,HLA-DR表明在抗原表示他们有潜在的作用。
详细的循环纤维细胞的识别
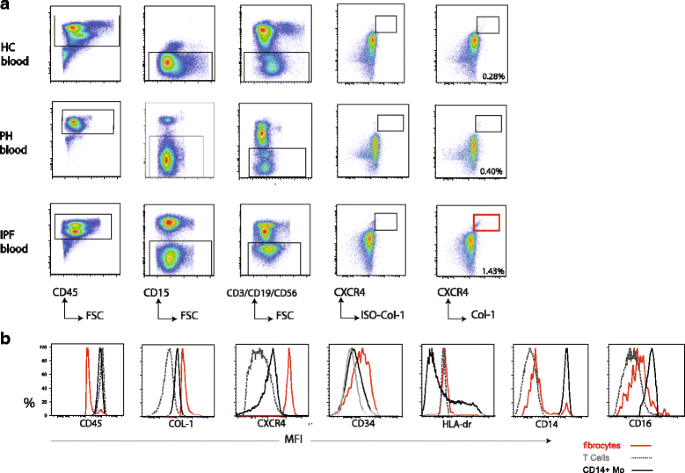
有显示,可以可靠地检测到肺纤维细胞单细胞悬浮体排除中性粒细胞和淋巴细胞后,我们假设这是适用于循环纤维细胞的检测。旁边IPF患者,我们研究了纤维细胞在肺动脉高压(PH)患者中,高数量的边缘(之前曾被观察到10]。我们检查了新鲜PBMC的IPF患者(n= 5),PH患者(n= 4)和健康对照组(HC) (n = 4)。病人特征详细在附加文件中1S1:表。
代表dot-plot控制策略的确定循环纤维细胞(CD45+林- - - - - -CD15- - - - - -趋化因子受体CXCR4+Col-1+肽)无花果所示。3。(血统组合包含:CD3、CD19和CD56)定义良好的循环纤维细胞的数量被确定在HC PBMC分数,IPF和PH患者。
接下来,我们调查了循环纤维细胞的表达谱。循环纤维细胞表达高水平的collagen-1,趋化因子受体CXCR4和CD34和低水平的CD45相比经典CD14 +单核细胞和T细胞(图3 b)。HLA-DR循环纤维细胞上表达与HLA-DR表情T细胞,而经典CD14 +单核细胞中细胞高,低,中间HLA-DR表达式。有趣的是,大多数的循环纤维细胞CD14表达很低,只有一小部分(11日3 95%可信区间9、7 - 0%)古典单核细胞CD14表达媲美。CD16表情循环纤维细胞较低相比古典单核细胞和略高于T细胞相同的捐献者。
总之,这些数据表明,循环纤维细胞可以检测中性粒细胞排除后,T, B和NK细胞,表达与肺纤维细胞标记共同之处。HLA-DR和CD16表达低循环纤维细胞,只有一小部分CD14表达高水平。
量化的纤维细胞数量是独立于白细胞隔离策略使用
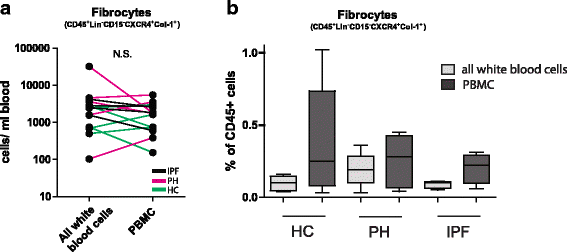
由于中性粒细胞的存在阻碍了纤维细胞的检测和确认的特异性染色,我们比较两种常见白细胞隔离技术。我们比较了聚蔗糖分离技术分离PBMCs删除PMN-leukocytes,和简单的巴斯德吸管管技术分离白细胞。我们分析成对总白细胞和PBMCs当日血撤回9例(4 IPF患者和5 PH患者)和5健康对照组。了循环纤维细胞的绝对数量(CD45 + Lin-CD15-CXCR4 + Col-1 +)每毫升血液(ml)没有不同的两个白细胞之间的隔离技术(2、5×103(95%可信区间0,4×1039、0×103巴斯德吸管)(技术)和1 8×103(95%可信区间1,1×1031、7×103(图)(聚蔗糖分离技术))。4)。正如所料,循环纤维细胞从CD45 +细胞的比例是在PBMC样本相对高于在全血样品,因为聚蔗糖技术消除大多数PMN-leukocytes(无花果。4 b)。缺乏纤维细胞百分比的差异之间的图组患者和控制可能是低的患者数量的结果用于实验。
总之,我们的策略来确定纤维细胞是可靠的,不管其中白细胞隔离技术,用于循环纤维细胞的绝对数量的量化。
循环纤维细胞与肺纤维细胞的比较
在组织损伤,纤维细胞迁移到靶器官(myo)成纤维细胞和成熟,参与组织改造和纤维化。目前还不清楚如果循环纤维细胞变得更激活,或调节表面标记(例如CD45, CD34或趋化因子受体CXCR4),或移植细胞内collagen-1当进入肺部。因此,我们同时比较了这些标记之间的循环和tissue-resident纤维细胞的表达水平。
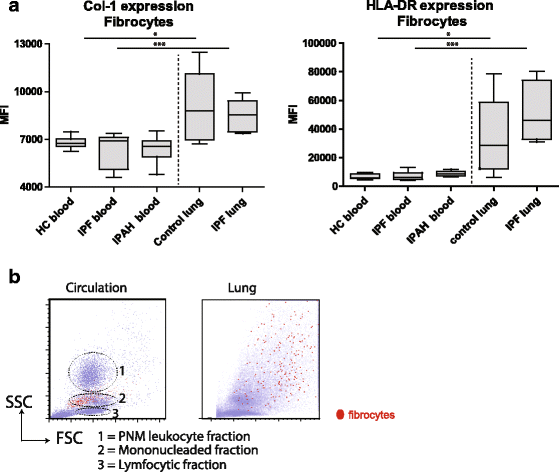
Collagen-1表达纤维细胞IPF /没有差异(IPAH)患者和(健康)控制肺细胞悬浊液或PBMCs(无花果。5(左)。collagen-1表达式在肺纤维细胞明显高于与IPF患者循环纤维细胞相比,IPAH和控制。
表达HLA-DR IPF / IPAH患者和控制之间的相似(图5,对吧)。Tissue-resident纤维细胞表现出显著增加HLA-DR而循环纤维细胞的表达。CD34和趋化因子受体CXCR4表达循环和tissue-resident纤维细胞之间没有差别(数据没有显示)。
检查循环和肺纤维细胞的大小和复杂性,我们检查了SSC和FSC的纤维细胞选择如无花果所示。2 b和3。循环纤维细胞FSC和SSC特征与单核细胞。在肺癌、肺纤维细胞的FSC和SSC相比增加循环纤维细胞(图5 b)。FSC的变异和SSC肺纤维细胞的特征可能不同粒度的结果,激活状态和胶原蛋白含量。
总之,这些数据表明,肺tissue-resident纤维细胞的表达水平增加HLA-DR和collagen-1同时获得规模和内部复杂性与循环。没有观察到的差异之间的隔间内控制或IPF患者或IPAH,这可能表明当地环境的一个重要的角色在肺纤维细胞的发展。
增加纤维细胞的比例IPF患者的肺部和血液循环
表明我们的控制策略来检测纤维细胞是可靠的和具体的,我们希望这种技术应用到一个更大的临床相关,群PH值和IPF患者,增加循环纤维细胞的百分比以前被描述(8,10,12]。尽量减少可变性在纤维细胞由于病因的异质性的PH值,只有特发性肺动脉高压(IPAH)干线患者检查。我们因此决定纤维细胞百分比PBMCs IPF患者(n= 14),IPAH (n= 10)和HC (n = 10)。
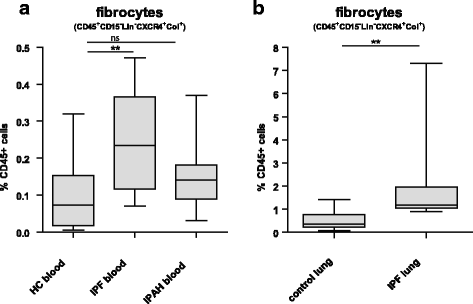
循环纤维细胞显著提高IPF患者相比,控制样品(p< 0.01)(图6和额外的文件5)。IPF患者循环纤维细胞的平均比例为0.25% (95% CI 0.17 - -0.33)的所有CD45 +细胞,HC则为0.10% (95% CI 0.03 - -0.17)。IPAH病人循环纤维细胞的比例为0.18% (95% CI 0.08 - -0.22)和不增加而HC (p= 0.14)。
符合之前的文献,我们已经表明,循环纤维细胞在IPF患者增加。我们下一个评估肺纤维细胞是否也会增加肺部的IPF患者(n= 8)和比较控制肺部(n=(图9)。6 b)。这些患者临床特征的额外的文件所示1。
的确,IPF肺的肺纤维细胞的比例是2,6% (95% CI -0.8 - -5.9)的CD45 +细胞,增加(p= 0.002)相比,控制肺(0.7% (95% CI 0.02 - 1, 3%))。
总的来说,这些数据表明,IPF患者纤维细胞的比例增加,不仅在循环,而且在终末期肺部疾病。
讨论
据我们所知,这是第一次在IPF肺纤维细胞肺组织匀浆由流式细胞术进行评估。我们已经表明,肺纤维细胞在IPF肺部和表达高水平的升高HLA-DR collagen-1和增益大小和内部复杂性而循环纤维细胞。我们使用一个可靠的控制策略,包括破坏性的细胞群,特别是粒细胞,为一个特定的循环和肺纤维细胞的识别。
确定循环纤维细胞用流式细胞术具有挑战性的,因为不存在统一的控制策略,导致循环纤维细胞的高可变性数字在不同的报告。循环纤维细胞是来源于monocyte-like的骨细胞能产生细胞外基质成分,因此至少CD45和胞内Collagen-1应该用于识别循环纤维细胞。此外,CD34和多种趋化因子受体被用来确定循环纤维细胞的子类型,尤其是趋化因子受体CXCR4, CCR7、CCR2。在目前的研究中,我们已经表明,趋化因子受体CXCR4同样表达了对肺癌和循环纤维细胞无论潜在的疾病。大多数循环纤维细胞也表达CD34 (5,16,26]。我们还表明,肺纤维细胞CD34表达。CD34结合L-selectin和L-selectin KO-mice纤维化感应阻碍博来霉素接触模型的肺纤维化(27]。这表明,循环纤维细胞CD34可能需要进入肺组织通过L-selectin激活内皮细胞表达。目前还不清楚如果体内或者什么时候CD34表达下调,一个年代Andersson-Sjoland和他的同事们证明所示成熟alfa-SMA仍然积极在IPF肺纤维细胞CD34表达(24]。在体外,CCR7表达与增加循环纤维细胞的迁移和TGF-β生产(28]。CCR2-CCL2轴促进纤维细胞招聘和诱导其分化成(myo)成纤维细胞29日,30.]。因此,相信这些趋化因子receptor-bearing纤维细胞可能代表激活亚型,然而这些标记物的表达水平变化在不同疾病和大部分的纤维细胞不表达CCR2和CCR7 [6,7,28,31日,32]。这里描述的控制策略可用于可靠测定这些归巢受体和其他感兴趣的标记。
我们的研究表明,污染的循环纤维细胞池粒细胞使用控制策略基于CD45和collagen-1孤单。污染粒细胞最有可能的结果非特异性结合collagen-1粒细胞抗体。最普遍的粒细胞,中性粒细胞表达各种胶原蛋白受体和胶原蛋白发挥重要作用。然而,据我们所知没有collagen-containing中性粒细胞的报道,表明非特异性抗体绑定(33]。众所周知,Fc受体粒细胞会导致非特异性,假阳性抗体染色,即使在特定的存在阻碍试剂(34]。据推测,在病人粒细胞可以表达更多的fc受体与健康受试者(35,36]。另外,我们观察到循环纤维细胞有类似FSC和SSC特征相比,单核细胞。因此,我们强烈主张使用标记排除粒细胞在当前控制协议来确定纤维细胞。
符合之前的报道(8,12),我们发现IPF患者循环纤维细胞的百分比增加,但不是IPAH患者。耶格尔和他的同事描述循环纤维细胞的百分比增加儿童特发性或可继承的PH值(10]。可以想象,在我们的样本量相对较小,组织重塑或纤维化的程度IPAH病人相对过低循环纤维细胞的差异。因此,一个更大的患者群可能是需要调查如果循环纤维细胞与IPAH成人也升高。
消除干扰后的循环纤维细胞的比例我们描述细胞数量远低于此前报道。巨噬细胞、纤维细胞monocyte-derived及其发展成一个效应细胞外主要是建立循环,取决于当地的组织环境(37]。虽然,monocyte-fibrocyte通路可能是类似的,大部分的纤维细胞出现在靶器官。事实上,我们已经表明,tissue-resident纤维细胞可以识别在IPF肺使用流式细胞术,他们CD45的占更大比例+隔室与循环。这些肺纤维细胞表达高水平的collagen-1循环纤维细胞相比,这使得collagen-1染色更健壮。HLA-DR表达式也是调节肺纤维细胞相比,循环纤维细胞。HLA-DR分子可以激发或抑制T -(助手)细胞反应和调节响应信号,表达增加可能指向抗原呈现或与当地T细胞体内相声。它也表明,培养纤维细胞表达抗原产生的所有必要costimulatory分子,他们的有力刺激器幼稚t细胞和体外诱导Th2细胞因子的反应38,39]。
总的来说,这种控制策略具有巨大的潜力在调查更详细地肺纤维细胞。这种方法可以取代人工培养的纤维细胞实验和允许直接调查组织重构和肺纤维细胞的作用的靶器官的纤维化。
结论
使用控制策略,排除可能的污染细胞群,我们表明,在IPF肺肺纤维细胞可以通过流式细胞术和评估他们的表型与循环纤维细胞不同。这种新方法可能是有趣的科学家调查迷人的纤维细胞在疾病发病机理中的作用或其潜在生物标志物和治疗的目标。
缩写
- 创新领导力:
-
碳碳图案配体
- CCR:
-
碳碳趋化因子受体
- Col-1:
-
collagen-1
- CXCL:
-
C-X-C图案配体
- CXCR:
-
C-X-C趋化因子受体
- FSC:
-
向前散射
- HC:
-
健康的控制
- IPAH:
-
特发性肺动脉高血压
- IPF:
-
特发性肺纤维化
- PBMC:
-
外周血单核细胞
- PF:
-
肺纤维化
- PH值:
-
肺动脉高压
- PNM:
-
多形核的
- SSC:
-
边撒
引用
布克拉R,明镜,切斯尼J,霍根米斯拉米a循环纤维细胞中,定义一个新的白细胞群协调组织修复。摩尔医学。1994;1:71 - 81。
日本须贺H,雷纳尔特RC,罗德里格斯M,索金M, Glotzbach JP, Januszyk M,藤原T, Longaker MT, Gurtner GC。跟踪难以捉摸的纤维细胞:识别和表征collagen-producing造血系细胞在小鼠伤口愈合。干细胞。2014;32:1347-60。
贝里尼,Mattoli纤维细胞的作用,活性骨骨髓来源间充质祖,和修复fibroses。实验室Investig。2007; 87:858 - 70。
Yokota Aono Y,岸M, Y, Azuma M,木下光男K, Takezaki,佐藤年代,【H,岸J, Goto H, et al .血小板源生长因子的作用/血小板源生长因子受体轴循环纤维细胞的人口贩运的肺纤维化。我和细胞杂志。2014;51:793 - 801。
Reilkoff RA,布克拉R,赫尔佐格EL。纤维细胞:新兴在慢性炎症效应细胞。Nat Immunol牧师。2011;11:427-35。
杜宾,Allard B, Ozier Maurat E, Ousova O, Delbrel E,特里T, Bui HN,德龙C, Guisset O, et al。血纤维细胞中招募了慢性阻塞性肺疾病急性加重CXCR4-dependent通路。J过敏Immunol。2015;
菲利普斯RJ Burdick MD,香港K, Lutz妈,穆雷洛杉矶,雪YY, Belperio是的,基恩MP, Strieter RM。循环纤维细胞交通应对CXCL12和调解的肺纤维化。中国Investig。2004; 114:438-46。
Moeller,吉尔平著,问K,考克斯G,库克D, Gauldie J, Margetts PJ, Farkas L, Dobranowski J, Boylan C, et al。循环纤维细胞在特发性肺纤维化预后不良的指标。是J和保健医学。2009;179:588 - 94。
特林布尔Gochuico BR, Markello TC,费舍尔R, Gahl佤邦,李JK,金正日Y, Burdick医学博士Strieter RM, Mehrad b循环纤维细胞在Hermansky-Pudlak综合征预后的生物标志物。是J和保健医学。2014;190:1395 - 401。
耶格尔我,阮厘米,Belchenko DD,科尔文KL,高摫之间的年代,艾薇DD, Stenmark KR。循环纤维细胞增加与肺动脉高压的儿童和年轻人。欧元和j . 2012; 39:104-11。
加西亚de Alba C, Buendia-Roldan我,萨尔加多,Becerril C,拉米雷斯R,冈萨雷斯Y, Checa M,纳瓦罗C,鲁伊斯V, Pardo,塞尔曼M .纤维细胞在慢性过敏性肺炎导致炎症和纤维化通过旁分泌的影响。是J和保健医学。2015;191:427-36。
藤原,小林H, Masuya M, Maruyama M,中村年代,Ibata H,藤本H,吴建,米浦和M, Naito M, et al .循环纤维细胞之间的相关性,以及活动和间质性肺疾病的进展。Respirology。2012; 17:693-8。
LaPar DJ,医学博士Burdick Emaminia,哈里斯DA, Strieter英航,刘L,罗宾斯M,克隆亚麻,Strieter RM,刘CL。循环纤维细胞与肺移植后闭塞性细支气管炎综合征发展:一种新的临床生物标志物。安Thorac Surg. 2011; 92:470-7。
Alhamad呃,沙Z, Al-Kassimi FA, Almogren,迦得ElRab MO,大师,科尔布M:循环纤维细胞的快速检测flowcytometry在特发性肺纤维化。2015年安Thorac地中海,10:279 - 283。
基利EC, Mehrad B, Janardhanan R, Salerno M,小猎人,Burdick MM, JJ, Strieter RM,克雷默厘米。循环纤维细胞水平升高患者的高血压心脏病。J Hypertens。2012; 30:1856 - 61。
Bianchetti L, Isgro M,马里尼妈,贝里尼,施密特M, Mattoli循环纤维细胞的s .枚举在哮喘的临床使用优化单一平台流式细胞术分析。BBA。2014; 1:52-8。
SA,林德加德H, Hejbol EK, Davidsen JR Bjerring N,汉森SWK,施罗德高清,汉森IMJ, Barington T,尼尔森c纤维细胞测量外周血与体外培养成熟的纤维细胞的数量,是一个潜在的间质性肺疾病的生物标志物在类风湿性关节炎。和杂志2017;18:141。
Borie R,奎斯C, Phin S, R MP, Marchal-Somme J, K Tiev, Bonay M,法布尔,太阳系P, Dehoux M b伽马安基丁酸在特发性肺纤维化肺泡纤维细胞的检测,系统性硬化症。《公共科学图书馆•综合》。2013;8:e53736。
拉克,羽衣甘蓝人力资源,伊根JJ,马丁内斯FJ,贝洱J,布朗KK,科尔比电视、科迪亚摩根富林明,Flaherty KR,斯基是的,等。一位官员ATS /人/青年队/ ALAT声明:特发性肺纤维化:循证指南诊断和管理。是J和保健医学。2011;183:788 - 824。
特拉维斯WD Costabel U, Hansell DM,国王忒小,林奇哒,尼科尔森AG)、瑞尔森CJ, Ryu JH,塞尔曼M,井非盟,et al。美国胸科学会/欧洲呼吸协会一位官员声明:更新的国际多学科分类的特发性间质性肺炎。188bet官网地址是J和保健医学。2013;188:733-48。
Galie N,亨伯特M, Vachiery杰,吉布斯,朗我Torbicki, Simonneau G,孔雀,Vonk Noordegraaf, Beghetti M, et al . ESC /人肺动脉高压的诊断与治疗:指南的联合特遣部队的诊断和治疗肺动脉高压的欧洲心脏病学会(ESC)和欧洲呼吸协会(人):认可:欧洲儿科先天性心脏病学协会(AEPC),国际社会对心脏和肺移植(ISHLT)。188bet官网地址心脏j . 2015欧元;2016 (37):67 - 119。
Boyum, Lovhaug D, L Tresland Nordlie EM。白细胞分离:提高细胞纯度梯度介质密度和同渗重摩的精细调整。Scand J Immunol。1991; 34:697 - 712。
皮莱J,达克T,坎普VM, Koenderman l .免疫抑制中性粒细胞和粒细胞myeloid-derived抑制细胞:相同点和不同点。细胞摩尔生命科学。2013;70:3813-27。
Andersson-Sjoland A de Alba CG Nihlberg K, Becerril C,拉米雷斯R, Pardo, Westergren-Thorsson G,塞尔曼m .纤维细胞的潜在来源在特发性肺纤维化肺成纤维细胞。Int细胞杂志。2008;40:2129-40。
安倍R,唐纳利SC,彭T,布克拉R,梅茨CN。外周血纤维细胞分化途径和网站迁移到伤口。J Immunol。2001; 166:7556 - 62。
施密特M,太阳G,斯泰西,Mori L, Mattoli s循环纤维细胞的识别前兆的支气管myofibroblasts哮喘。J Immunol。2003; 171:380-9。
p Y, Nishizawa Y, Yasui M,长谷川M, Kaburagi Y,高K,长冈T,齐藤E,岛田Y、Takehara K, et al,细胞间粘附molecule-1 L-selectin调节bleomycin-induced肺纤维化。分册。2002;161:1607-18。
傅XY,张DW,李码,赵PW,唐YQ,妞妞生理改变,李y .姜黄素治疗CCR7表达和抑制人类循环纤维细胞的分化和迁移。学生物化学细胞杂志。2015;35:489 - 98。
盛Ekert我,莫里洛杉矶,Das, H, Giles-Komar J, Rycyzyn马。趋化因子(碳碳主题)配体2介导的直接和间接人类和小鼠的纤维细胞纤维化反应。纤维发生组织修复。2011;23。
Gurczynski SJ, Procario MC, O 'Dwyer DN, Wilke CA,摩尔BB。失去CCR2信号改变白细胞招聘和加剧gamma-herpesvirus-induced骨髓移植后肺炎和纤维化。是杂志肺细胞摩尔杂志。2016;311:L611-27。
辛格SR,拍摄,考尔D,古普塔年代,德赛D,桑德斯R, Brightling CE。CCL2释放在哮喘气道平滑肌增加和促进纤维细胞迁移。过敏。2014;69:1189 - 97。
波肯斯泰全TE,考珀年代,吴SP,路,布克拉r .循环纤维细胞:collagen-secreting外周血细胞。国际生物化学与细胞生物学杂志》上。2004;36:598 - 606。
阿方索PV,麦肯CP, Kapnick SM,父CA。Discoidin域受体2 3 d调节中性粒细胞趋化性胶原蛋白矩阵。血。2013;121:1644-50。
Nimmerjahn F, Ravetch合资企业。fc受体免疫的监管机构。难以Immunol。2007; 96:179 - 204。
博安公司CC, van den ak EL van den Berg B, Russcher H, Joosten K, Hokken-Koelega AC,兰贝茨西南,科佩尔JW。Ficoll-separated从污染的脓毒症患者粒细胞单核细胞。重症监护医学。2008;34:912-6。
山崎T, Hokibara年代,Shigemura T,小林N, K,本田laowai Y, Agematsu K明显升高CD64表情的中性粒细胞和单核细胞可用于诊断周期性发热、口疮的口腔炎、咽炎、宫颈腺炎(PFAPA)耀斑期间综合症。Rheumatol。2014; 33:677 - 83。
永利助教,Vannella公里。巨噬细胞在组织修复、再生和纤维化。免疫力。2016;44:450 - 62。
切斯尼J,巴彻M,本德,布克拉r .外周血纤维细胞是一个强大的抗原呈递细胞原位启动幼稚T细胞的能力。《美国国家科学院刊S a . 1997; 94:6307-12。
麦地那,Ghahary A重组纤维细胞诱导混合Th1 / Th2细胞因子响应天真的CD4 (+) T细胞。摩尔细胞。2011;346:89 - 94。
资金
本研究部分从Actelion股价制药提供资助。
可用性的数据和材料
和/或使用的数据集分析在当前研究可从相应的作者以合理的要求。
作者信息
从属关系
贡献
PH值、JvH MvN、RWH可,BvdB实验设计。PH值,从而可以KB,, MW参与招聘的病人和收集病人资料。PH值、JvH MvN, JvdT进行实验和分析数据。RWH PH值,可和BvdB写的手稿。所有作者阅读和批准最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
鹿特丹伊拉斯谟MC的医学伦理委员会批准了这项研究(METC 2012 - 512)。知情同意是来自每一个参与者和健康的控制(HC)之前收集的血液样本。
相互竞争的利益
作者宣称没有利益冲突。
出版商的注意
施普林格自然保持中立在发表关于司法主权地图和所属机构。
附加文件
额外的文件1:
特征的患者和健康者用于实验。数据平均值±标准偏差,除非另有指示。一个1慢性血栓栓塞患者酸碱和4患者继发于一种自身免疫性疾病。b6 IPF患者,3例摘要模式二次外在过敏性肺泡炎,2例非特异性间质性肺炎和1 anti-synthetase综合症患者。c意味着FVC、FEV1比率= 0.71(2 9有阻塞性肺功能测试,都归类为金)。d与超声心动图评估右心导管或怀疑。IPF =特发性肺纤维化,IPAH =特发性肺动脉高血压,FVC =用力肺活量,TLCO =一氧化碳扩散能力,人民行动党=肺动脉压力,说唱=右心房压力,Svo2 =混合静脉饱和,PDE5i = 5型磷酸二酯酶抑制剂,时代=内皮素受体拮抗剂,一=环前列腺素受体激动剂(多克斯22 kb)
额外的文件2:
这种策略CD45+/ Col-1+细胞。(一)传统与CD45策略+/ Col-1+细胞在红色。(B)相同的纤维细胞的位置使用控制策略基于额外的细胞外的标记。这种策略是基于细胞外标记,与先前发表的一些修改16)(注:对于我们的研究问题我们不排除SSC嗨细胞)。CD45 +细胞分析HLA-DR表达和谱系标记排除b细胞(CD19), NK细胞(CD56)和t细胞(CD3)。血统-细胞被绘制为CD14和CD16 CD45创建一个不同的组的细胞丰富+/ Col-1+细胞(红色框)。(PDF 75 kb)
额外的文件3:
完整概述collagen-1 CD45 CD15染色+/ Col-1+细胞和控制。采用培养的成纤维细胞,培养纤维细胞,古典单核细胞和CD45分类排序+/ Col-1+细胞。表明细胞沾Collagen-1或同形像控制(兔免疫球蛋白)和CD15。作为CD15控制我们使用淡黄色的外套,很好地显示出积极的粒细胞-淋巴细胞。所有图片是100×放大。(PDF 1282 kb)
额外的文件4:
相关循环CD45+/ Col-1+纤维细胞和粒细胞。这个实验我们分析成对总白细胞(开放点)和PBMCs(黑点)在同一天血液撤回9例(4 IPF患者和5 PH患者)。用斯皮尔曼相关系数计算的排名方法。(PDF 102 kb)
额外的文件5:
IPF患者循环纤维细胞数量和特发性肺动脉高压(IPAH)。(一)每毫升血液循环纤维细胞的绝对数字冻PBMC HC, IPF患者和IPAH患者。* *P< 0.01 (PDF 91 kb)
权利和权限
188滚球软件本文是分布式根据创作共用署名4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),允许无限制的使用、分配和复制在任何媒介,你提供给适当的信贷原始作者(年代)和来源,提供一个链接到Creative Commons许可,并指出如果变化。知识共享公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于数据可用在这篇文章中,除非另有说明。
关于这篇文章
引用这篇文章
Heukels, P。,van Hulst, J.A.C., van Nimwegen, M.et al。增加纤维细胞在肺和特发性肺纤维化患者的外周血。和物19日,90 (2018)。https://doi.org/10.1186/s12931 - 018 - 0798 - 8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12931 - 018 - 0798 - 8
关键字
- 纤维细胞
- 特发性肺纤维化
- 肺纤维细胞
- 肺动脉高压
- 流式细胞术