抽象
背景
关于健康风险,尽管欧盟在人气高涨与电子烟(EC)的使用有关,并已主张为手段,以戒烟吸烟鲜为人知的是。
方法
十从不吸烟者,而不暴露历史烟草产品或EC,在与问卷基线进行了评估,胸部X线,肺功能,内皮微粒的血浆水平(EMP),和支气管镜检查获得小气道上皮细胞(SAE)和肺泡巨噬细胞(AM)。一周后,受试者吸入的“蓝光”牌EC 10个泡芙,等待30分钟,然后再过10粉扑;n = 7 were randomized to EC with nicotine andn= 3到EC,不含尼古丁,以评估健康,幼稚个体的生物反应。
结果
两个人力资源。ec暴露后,受试者再次作为基线进行评估。临床参数未见明显变化。与基线相比,观察到生物学变化,包括所有受试者的SAE和AM的转录组改变,以及吸入含有尼古丁的EC后血浆EMP水平升高。
结论
本研究提供的体内人体数据表明,急性吸入EC气雾剂在有限的健康无经验个体人群中破坏了正常的人肺内环境平衡。这些观察结果对新的电子烟使用者、接触二手电子烟气溶胶的非吸烟者和使用电子烟戒烟的吸烟者都有意义。
试验注册
ClinicalTrials.govNCT01776398(注册10/12/12),NCT02188511(注册7/2/14)。
背景
电子烟是一种锂离子电池供电的电子烟,它能释放出每包含有4至24毫克尼古丁的气雾剂,以及香精、丙二醇和甘油[1,2,3.,4,5]。电子传感器检测吸入时气流的变化,并激活一个元件,使液体、调味料和丙二醇和/或甘油推进剂蒸发。许多EC看起来像香烟,EC气溶胶像香烟烟雾被吸入;然而,一些电子商务设备可以单独定制,以提供气溶胶在首选的设置。电子商贸的应用正迅速普及[1,2,3.,4]。据估计,有4 - 6%的英国和8 - 10%的美国吸烟者曾使用过电子烟,而在没有吸烟史的较年轻的年龄组别中,电子烟的使用也在增加[1,2,3.,6,7]。EC为市售香烟,可提供尼古丁但不香烟烟雾的有毒产物[替代8,9,10],并用作一个策略,以减少吸烟,与概念,EC是“更安全” [2,3.,8,9,11]。这个观点得到了来自皇家医师学院[报告的支持3.]和公共卫生英格兰[2]鼓励吸烟者改用电子烟,作为戒烟的策略。
虽然吸EC对健康的危害可能小于吸烟,也可能不小于吸烟,但这并不意味着吸EC对人体健康是无害的,尤其是对肺,肺是吸入EC气溶胶的最初冲击器官。EC气雾剂通常含有尼古丁,以及多种调味剂、添加剂和其他可能影响正常肺部生物的污染物[3.,5]。人类气道上皮细胞表达烟碱受体,暴露上皮尼古丁激活烟碱相关的通路,并在体外研究已证明,EC气溶胶可以修改上皮细胞和内皮细胞生物学[12,13,14,15,16]。虽然这些体外研究表明,EC气溶胶可能有害于人体肺部,有没有研究评估的是在体内的天然人肺的生物利用EC的影响。
要着手解决这一问题,并规避前吸烟的混杂作用,我们设计了一项研究来回答一个简单的问题:有什么后果急性暴露的人体肺部的生物健康从不吸烟者EC气溶胶?我们的研究设计仅限于基于暴露较大的个人尼古丁和EC的数字不知道效果和潜在风险瘾伦理问题的10名健康从未吸烟者的志愿者小的群体。因此,十个志愿者健康不吸烟者之前和急性暴露于EC气溶胶吸入后全面评估,以从7个吸入EC气溶胶与尼古丁,并从相同的EC不含尼古丁吸入3个气溶胶。使用纤维支气管镜检查,以评估小气道上皮细胞的转录组(SAE),肺部异常的吸烟者第一站点[17,18,19]和肺泡巨噬细胞(AM),下呼吸道的单核吞噬细胞维护者[20,21],和流动的血浆肺细胞仪分析毛细血管衍生内皮微粒[22],我们评估急性暴露于这些气溶胶是否修改了SAE,AM的生物学和间接,肺毛细血管内皮。
方法
研究人群和生物样本
(:NCT01776398和NCT02188511 ClinicalTrials.gov标识符)研究对象在威尔康乃尔医学院临床转化科学中心与遗传医学临床研究机构的下IRB批准协议的部门进行了评价。资格确定之后的详细筛选访问包括病史,体格检查,全血化学和凝血功能检查,肝功能检查,尿液分析,胸片,心电图,和全肺功能检查。The smoking phenotype of “never-smoker” was determined by self-reported history and confirmed by absence of tobacco metabolites in the urine (urine nicotine < 2 ng/ml, urine cotinine < 5 ng/ml; see Additional file1:参考方法的细节就包含/排除标准)。
在研究登记时,10名健康的不吸烟者,没有接触过任何烟草产品或EC,在第1天(基线)用一份关于EC使用后要评估的症状、生命体征(血压、体温、心率、呼吸频率)、O2饱和度、胸透、肺功能、血浆EMPs、支气管镜及支气管刷取小气道上皮(SAE;10 - 12级支气管)和支气管肺泡灌洗以获得肺泡巨噬细胞(AM)。一周后,受试者被训练如何使用EC,然后吸入10泡“Blu”牌EC,等待30分钟,然后再吸入10泡。的n= 10名受试者,n = 7 were randomized to Blu EC with nicotine andn = 3 to Blu EC without nicotine. Immediately after the 1st and 2nd EC exposures, the questionnaires were administered and vital signs and O2饱和度进行评估。在第二次EC暴露后2小时内,获得肺功能、血浆EMPs和经刷洗和灌洗的重复支气管镜检查。对细胞总数和细胞差异进行定量分析。从基线和ec暴露后收集SAE和AM的mRNA进行rna测序。
血浆内皮细胞微粒的特性研究
如先前所描述的内皮微粒进行定量[22]。收集血液并在1个小时内进行处理,以制备富血小板血浆。将上清液在5分钟内进一步处理,得到血小板含量低的血浆,将其用3种抗体染色:组成型内皮细胞标记物PECAM(CD31)和血小板特异性糖蛋白IB(CD42b的)组成。为了评估肺毛细血管内皮到升高水平的EMP,CD42b的相对贡献的存在-CD31 +是釉基质蛋白基于该知识ACE中大量对肺毛细血管内皮表达共染色用抗人血管紧张素转换酶(ACE)[22,23]。对于每种抗体的最佳条件通过连续稀释来确定。EMP测量进行两次,以确保测量结果的重现性。CD42b的-CD31 +微粒水平标准化成同型对照。
小气道上皮细胞和肺泡巨噬细胞转录组
SAE从第十收集到12阶支气管使用柔性支气管镜如前所述[18]。将SAE细胞从细胞学刷中取出,放入5 ml冰冷的支气管上皮基础培养基(BEBM、龙沙、巴塞尔、瑞士)中,置于冰上,待处理。取总体积的五分之一进行细胞活力和鉴别分析,其余样品立即处理并于- 80°C的TRIzol试剂(Invitrogen, Carlsbad, CA)中保存,直到后续RNA纯化。
AM经支气管肺泡灌洗(BAL)恢复[20]。每个注射点的最大容量为150毫升,每个人最多可注射两个位置。注入量的回收率为56.2 ~ 65.5%(见表)1)。所有回收的流体首先通过纱布过滤,并以1250rpm离心5分钟。将细胞沉淀物再悬浮于ACK裂解缓冲液(5毫升,23℃,5分钟内; Invitrogen,卡尔斯巴德,CA)中,然后在10ml的RPMI 1640个培养基(Invitrogen)中洗涤两次,将含有9%胎牛血清(Sigma Aldrich公司,圣路易斯MO)和1%青霉素和链霉素(Invitrogen)中。使用血球台盼蓝排斥评估可行性进行细胞计数。将细胞沉淀物稀释到10的浓度6细胞/ ml。差动细胞计数上进行了细胞离心400μl的等分试样染色用Diff-Quik的。The remaining cells were plated into 6-well plastic culture dishes at 2 × 106细胞/2 ml /孔,37℃,5% CO孵育过夜2以允许AM纯化通过粘附[21]。取总体积的五分之一进行细胞活力和鉴别分析,其余样品立即处理并于- 80°C的TRIzol试剂(Invitrogen, Carlsbad, CA)中保存,直到后续RNA纯化。
对于SAE和AM,使用TRIzol方法提取总RNA,最后使用RNeasy柱(Qiagen, Valencia, CA)对样本进行清洗。分别用Nanodrop rd -1000 (Thermo Scientific, Wilmington, DE)和Bioanalyzer (Agilent Technologies, Santa Clara, CA)对RNA的数量和质量进行了评估。总RNA(0.5μg)提交给纽约基因组中心RNA-sequencing(2×125个基点)后的Illumina公司HiSeq2500 TruSeq v2 mRNA图书馆准备。在NCBI基因表达数据公开可用的混合(GEO加入数字:GSE85121)。用STAR (2.3.1z13_r470)处理NYGC RNA-Seq数据的Illumina HiSeq双端reads,使其与GRCh37/hg19人类参考基因组和RefSeq基因定义(2014-06-02)一致。利用Cufflinks(2.2)对RefSeq基因定义进行基因表达定量。为了修正转录本长度和覆盖深度,Cufflinks将对齐的reads转换为每千碱基外显子每百万片段测序(FPKM)的片段,并使用相同的RefSeq基因定义进行表达。SAE的表达包括FPKM > 0.125的值[24,对于AM表达式,包含FPKM > 0.08的值。
统计数据
该FPKM导入数据和帕特克基因组学Suite软件6.6版(帕特克,圣路易斯,密苏里州)进行评估。倍数变化被确定为的EC /最小二乘均值匹配基线样品的急性气溶胶吸入的最小二乘均值。一种pvalue < 0.05 calculated by a Student’s t-test and a fold-change > ± 1.5 were designated as the threshold. The SAE and AM RNA-seq data was also used to identify expression of nAChR in the SAE and AM. The molecular pathways associated with the significant genes impacted by acute aerosol inhalation of EC was examined using Ingenuity Pathway Analysis.
结果
临床参数
除了症状变化的报告,如感到头晕,头晕,紧张不安,感到恶心,放松,紧张,激动或头痛,有使用或不使用尼古丁吸入EC无相关症状一致(附加文件1:表S1)。同样,在生命体征、肺功能测试等方面也没有一致的变化2血中羧酸血红蛋白水平或尿中尼古丁代谢物水平,支气管肺泡灌洗细胞差异或小气道上皮细胞差异(表)1额外的文件1:表S2A和B)。
血浆内皮微粒
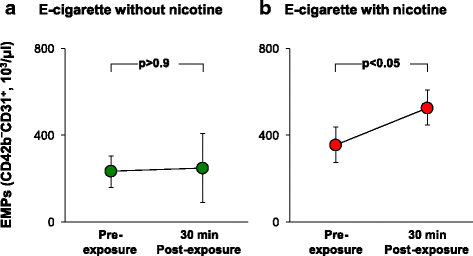
内皮微粒(釉基质蛋白)是由质膜和在循环血液少量本胞质溶胶的小0.2-1.5微米囊泡被从活化或损伤内皮细胞的释放[22]。循环EMP水平升高已被证明在活性吸烟者[22,23]。要确定是否EMP水平受影响急性EC曝光,在曝光前基线就诊时采集血样,然后1周后的复诊30分钟内以下EC曝光。对于这两个EC暴露组,有和没有尼古丁,平均%ACE+CD42b的-CD31+/ CD42b的总-CD31+was 76 ± 6% (+nicotine vs no nicotine,p > 0.09), consistent with the majority of EMPs derived from pulmonary capillaries [22]。暴露于EC不含尼古丁血浆EMP水平没有显著改与基线相比,EMP水平(图1A)。然而,置身于EC尼古丁导致显著较高水平相比,环境管理计划总额为同一个人的基线水平总环境管理计划(图1B)。这些结果并不意外,因为与不吸烟的人相比,含尼古丁的吸烟者的总EMP水平明显更高[22,23],但尚未有EC首次使用的报告。
烟碱乙酰胆碱受体亚基的表达
SAE RNA-seq数据的分析证明了多个烟碱乙酰胆碱受体的表达(乙酰亚基包括α1α3,α5,α7,α10β1。也表达乙酰子单元,包括α1α3,α5,α7,α10β1。
小气道上皮转录组
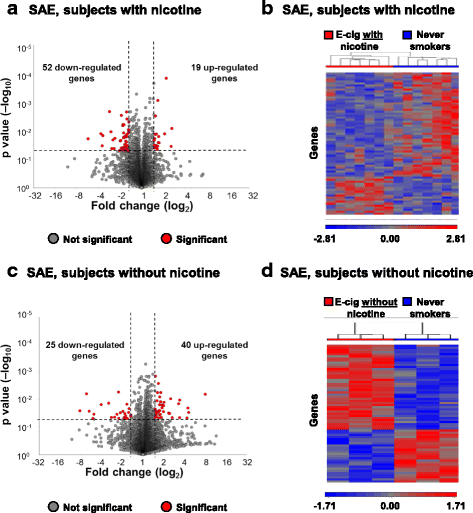
通过在基线和第1周分别刷10 - 12级支气管收集的小气道上皮的mrna测序来评估全基因组的基因表达谱。EC暴露后2小时内使用的意义标准p>±1.5的倍数变化,有71个基因在暴露于含有尼古丁的EC后发生显著改变,其中19个基因表达上调,52个基因表达下调(图3)。2A;额外的文件1:表S4)。火山图显示,吸入含有尼古丁的EC后,SAE转录组的整体变化(图3)。2A)和层次聚类(图2B)。在暴露于不含尼古丁的EC后,SAE共发生65个基因的显著改变,其中40个基因表达上调,25个基因表达下调(图3)。2C;额外的文件1:表S5)。急性吸入不含尼古丁的EC也会导致SAE转录组谱的整体变化,这是通过不同表达基因的层次聚类分离每个研究对象观察到的结果(图3)。2D)。总的来说在EC用户,显著影响是尼古丁受体途径(KCNK15,PPP1R16B和GNB1L)和p53的一些下游目标的途径之一,其中包括上调的基因(EDN1,AMOTL2,LATS2,RND3)和下调基因(ATAD2,GDA,MKI67,NDC80和RRM2),与p53依赖性信号的改变的活化相一致。
急性电子烟雾化吸入对气道上皮细胞全基因组转录组谱的影响。一个来自从不吸烟者的SAE比较基线后EC曝光访问所有基因谁暴露于EC的急性吸入尼古丁的火山图显示表达式(n = 7 subjects). Significance determined byp值< 0.05(水平虚线)和ec后暴露与基线> 1.5的折线变化(垂直虚线)。b从不吸烟者暴露于含有尼古丁的EC急性吸入后SAE差异表达基因的层次聚类(n = 7 subjects).c来自从不吸烟者的SAE比较基线后EC曝光访问所有基因谁暴露于EC的急性吸入不含尼古丁的火山图显示表达式(n= 3科目)。意义由p值< 0.05(水平虚线)和ec后暴露与基线> 1.5的折线变化(垂直虚线)。d从从不吸烟者的SAE差异表达基因谁暴露于EC的急性吸入不含尼古丁分层聚类(n= 3科目)
肺泡巨噬细胞转录组
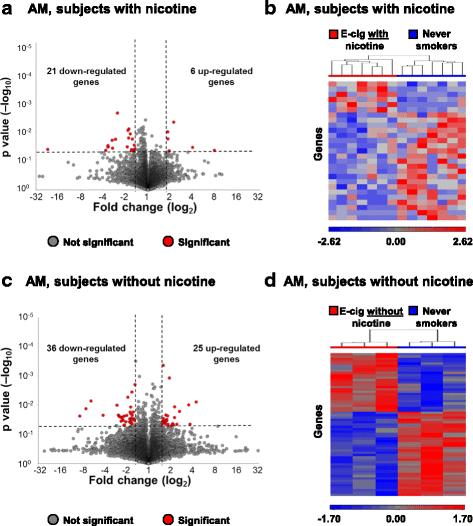
的全基因组基因表达谱通过在基线通过支气管肺泡灌洗收集肺泡巨噬细胞(AM)mRNA的测序和评估再次1周后EC曝光的2小时内。使用的意义标准p< 0.05和倍变>±1.5,AM中有27个基因在暴露于含有尼古丁的EC后发生显著改变,其中6个基因表达上调,21个基因表达下调(图3)。3A;额外的文件1:表S6)。通过差异表达基因分级聚类(图每一个研究对象的分离观察到EC的尼古丁急性气溶胶吸入导致AM转录概况全球变化。3B)。在不含尼古丁的电子烟环境下,AM基因共发生61个基因的显著改变,其中25个基因表达上调,36个基因表达下调(图3)。3C;额外的文件1:表S7)。与SAE一样,急性吸入不含尼古丁的EC气溶胶也会导致AM转录组的整体变化,这是通过分层聚类完全分离每个研究对象观察到的(图3)。3D)。虽然通过评估上调和下调基因组的标准通路分析没有发现AM中的主导通路,但已知有几个受EC暴露影响的基因在巨噬细胞生理和肺部健康中发挥作用,包括叉头盒M1 (FOXM1;FC -1.61,p < 1.7 × 10- 2,不含尼古丁的电子烟,补充档案1:表S7),冠蛋白1A(CORO1A; FC -2.13,p < 4.7 × 10- 2,不含尼古丁的电子烟,补充档案1:表S7)、前列腺素E受体3 (PTGER3;FC 2.26,p< 2.6×10- 2,不含尼古丁的电子烟,补充档案1:表S7)。
对肺泡巨噬细胞的全基因组转录谱急性电子烟雾化吸入。一个来自从不吸烟者的AM比较基线后EC曝光访问所有基因谁暴露于EC的急性吸入尼古丁的火山图显示表达式(n = 7 subjects). Significance determined byp值< 0.05(水平虚线)和ec后暴露与基线> 1.5的折线变化(垂直虚线)。b不吸烟者急性吸入欧共体尼古丁组AM基因差异表达的层次聚类(n = 7 subjects).c火山图显示了所有基因的表达,并比较了急性吸入不含尼古丁的EC的吸烟者的基线和AM暴露后的基因表达(n= 3科目)。意义由p值< 0.05(水平虚线)和ec后暴露与基线> 1.5的折线变化(垂直虚线)。d从从不吸烟者的AM差异表达基因谁暴露于EC的急性吸入不含尼古丁分层聚类(n= 3科目)
讨论
电子烟的使用日益增加,因为人们普遍认为电子烟比吸烟更安全[1,2,3.,4,6,7,8,9,10,11]。尽管EC的有限的数据对健康影响人类的肺器官,需要接触吸入EC气溶胶的冲击,皇家外科学院建议,“在公众健康的利益,重要的是要推广使用电子烟……尽可能广泛地代替吸烟在英国”(3.]。这一概念得到了英国公共卫生部门的支持[2]。虽然长期研究可能最终证明,吸烟EC比吸食传统香烟更安全,这提示了一个问题:你EC气溶胶对人体肺部造成不利影响?要开始评估这个问题,我们评估了健康的不吸烟者的肺细胞的生物学前,然后经过短暂,急性暴露于EC气溶胶是在尼古丁交付大约相当于吸2支香烟。即使在这种有限的队列研究中,我们观察到EC气溶胶的急性暴露于至少3个肺细胞群的健康个体幼稚症生物学,包括:小型气道上皮细胞,吸烟引起的肺部异常的最初的网站[17,19],肺泡巨噬细胞,下呼吸道的单核吞噬细胞“后卫” [20,21],并通过对循环内皮细胞微粒的间接评估,作为肺泡血管床的肺毛细血管内皮健康的生物标志物[22,23]。虽然更多的研究将需要确定这些生物的变化转换成肺疾病的风险增加,数据显示,EC气溶胶是不是良性的。这些意见提高关心它是否是为时过早医学界积极推荐EC用作吸烟替代,直到更多的研究来进行。
EC气溶胶中可能与肺健康有关的成分
EC气雾剂含有尼古丁和其他各种化学品。尼古丁能够经由细胞内激酶信号传导途径的激活[唤起在细胞广泛的细胞变化,包括增殖,细胞生长和细胞凋亡的16]。尼古丁从其由5个亚基形成的杂 - 或由任一5个相同α亚基或α的组合和β亚基[的同聚五聚体通道的烟碱乙酰胆碱受体(nAChRs)置换本地CYTO-发射机乙酰胆碱(ACh)25]。九个不同类型α亚基(α2-α10)和3种类型β亚基(β2-β4)的已被鉴定。两个人的气道上皮细胞和AM表达多种胆碱受体亚单元,并很可能是烟碱暴露对上皮和AM效应的发生,在最低限度,在胆碱受体依赖性。
从我们的研究,EC使用显著改变多种基因的表达中的烟碱受体途径在小气道上皮细胞进一步支持这一概念的发现。然而,烟碱暴露可能对肺独立NACR介导的信号的生物效应。最近的一项研究由李某等人。[26]显示老鼠暴露于电子烟烟雾12周。通过亚硝基化和随后的尼古丁代谢产生DNA损伤因子,诱导包括肺在内的多个器官的DNA损伤。这些数据表明,人类长期接触含有尼古丁的电子烟可能会产生类似的后果。
除了尼古丁本身可能造成的有害影响外,越来越多的文献记录了EC气溶胶中有害化学成分的存在[5]。EC中使用的液体通常含有不同比例的植物甘油、丙二醇(PG)、尼古丁和香料化学物质。甲醛是一种已知的PG降解产物,在蒸发过程中与PG和甘油反应生成半缩醛。对42种不同品牌e-liquid的检测结果显示,所有42个样品的甲醛浓度均在0.02-10.09 mg/L之间[27,28]。其他污染物,例如柠檬烯和各种碳氢化合物[-蒎烯、-蒎烯、-萜烯和苯1-甲基-4-(1-甲基乙基)(对聚氰胺)],已在一些但不是所有的电子液中检测到,其浓度均高于建议的暴露限值[28]。从EC醛的排放也有报道以下的加热和电子液体主要成分的氧化,植物甘油和丙二醇[29]。我们的数据来自不含尼古丁的电子烟使用者,显示急性电子烟暴露后SAE和AM的多种基因表达变化。因此,这些数据表明,非尼古丁衍生的化学物质存在于EC气溶胶可以诱导细胞群的分子变化对肺部健康至关重要,从长远来看,这可能导致有害的影响。
EC气溶胶改变肺细胞生物学的证据
在本研究中,人体内的数据一致,则在体外和实验动物的证据表明,EC气溶胶修改肺细胞生物学。从皮肤和肺给EC细胞系暴露气溶胶导致细胞毒性效应[12]。体外人气道上皮细胞和体内小鼠暴露于EC气雾剂可导致氧化应激、炎症细胞募集水平低、病原体清除延迟等宿主反应缺陷[13,15]。此外,EC烟雾暴露的损害DNA,并减少在小鼠肺和体外[修复活性人肺细胞26]。原代肺微血管内皮细胞经e-液或浓缩EC气溶胶±尼古丁处理后内皮细胞通透性增加[14],对卵清蛋白致敏的小鼠气管内给药e-液,可加重致敏原引起的气道炎症和高反应性[三十]。
在体内的证据表明,欧盟气溶胶可能对人体有害的肺
据我们所知,已经有急性染毒的EC气溶胶与吸烟天真人类肺癌生物学事先没有直接评估。然而,在本研究中观察到的紊乱肺生物学一致,有文献证明与EC的急性吸入,包括咳嗽相关的临床异常,降低分数呼出的一氧化氮,提高呼吸阻抗和增加的呼吸流动阻力[2,3.,31]。此外,最近的一项研究Reidel等。[32使用定量蛋白质组学来比较来自吸烟者、电子烟使用者和非吸烟者的诱导痰样本,表明使用电子烟可导致肺内独特的先天免疫反应,增加中性粒细胞激活和改变黏液分泌。我们的研究表明,在无EC或传统烟草产品使用史的初生个体中,急性暴露于EC气溶胶可导致SAE和AM的转录组改变。与AM反应相比,SAE中转录组的变化更明显,这可以通过更多的基因在EC暴露下的SAE中表现出不同的表达来证明。在SAE中,几个p53下游靶点的改变与EC暴露后p53依赖信号的激活一致。p53信号通路在调节细胞凋亡、细胞周期阻滞、衰老和DNA损伤反应等多种细胞功能中发挥核心作用[33,34,35]。此外,p53的激活对预防吸烟诱导的肺癌的发生至关重要[36,37,38,39]。在此基础上EC气溶胶知识包含多个有毒化学品[5,27,28,29]和尼古丁衍生的代谢物/分解产物引起所述肺部DNA损伤[26],我们推测p53的下游目标在SAE该改变的表达表明对环境胁迫和/或DNA损伤的细胞应答。如果为true,这些数据进一步加强教统不是良性的,甚至急性暴露于他们的气溶胶诱发不良影响的说法。
标准的途径分析没有发现在AM转录组数据的主要途径,但已知参与巨噬细胞的生理和机体防御几个单独的基因受到EC曝光包括叉头框M1(FOXM1),冠蛋白-1A(CORO1A)和前列腺素è受体3(PTGER3),表明改变的免疫反应。FOXM1编码的转录激活因子,是已知的调节的细胞周期相关基因的表达,并具有在控制细胞增殖[作用40]。FOXM1最近显示调节新生儿啮齿动物肺部高氧肺炎症反应[25]。此外,鼠的研究表明它是肺部炎症和肿瘤形成[期间所需的巨噬细胞募集41]。基于响应于EC曝光在AM降低的FOXM1的表达,我们可以假设从EC用户该AM可具有受损的迁移和炎症反应。CORO1A encodes coronin-1A, a member of the WD repeat (~ 40 amino acid conserved region that may facilitate protein-protein interactions) protein family, which has been shown to inhibit autophagosome formation around结核分枝杆菌在啮齿动物的巨噬细胞吞噬体含在培养物中[26]。因此,EC暴露后CORO1A表达的降低可能损害AM的吞噬能力。PTGER3编码前列腺素E受体3,这是一种g蛋白偶联受体,是已知的前列腺素E2 (PGE2)的四种受体之一[42]。PTGER3的删除显示出改善从死亡以下肺宿主的防御和保护小鼠肺炎链球菌感染 [27],其他研究表明前列腺素可能在肺宿主防御中起关键作用[43,44,45]。因此,EC使用后PTGER3的AM表达增加可能会增加EC使用者对药物的敏感性肺炎链球菌感染。结合先前的研究表明EC的使用与两个人肺免疫反应的改变有关[32]和小鼠[15我们的研究进一步支持了这一观点,并表明AM中依赖ec的转录组改变是一个促成因素。
肺紊乱作为肺部疾病的前兆的后果
电子烟气溶胶对肺部健康可能产生的不良影响的研究比较复杂。电子烟品牌繁多,除尼古丁外,还有多种口味和其他添加剂[1,2,3.,4]。此外,许多研究评估电子烟烟雾对前吸烟者的影响,而他们的肺已在一定程度上构成[2,3.]。因为尼古丁会使人上瘾,所以让从不吸烟的人长期接触电子烟烟雾是不道德的。
结论
在本研究的数据表明,即使限制,急性暴露于EC的气溶胶存在于体内人肺癌的生物学dysregulates。无论是否长期暴露于EC将导致肺部疾病是未知的,只能通过大规模的,长期的个人谁不EX-谁只使用了电子香烟当前吸烟者的研究和评估,一项研究,是具有挑战性目前进行,因为大多数电子香烟用户不得不事先或电流香烟烟雾暴露。然而,在小气道上皮细胞,肺泡巨噬细胞和(间接)肺毛细血管内皮的生物学的观察到的变化,可用信号通知EC使用可能不一样安全已经假设。Thererfore,建议EC指令,那么危险比吸烟要慎重考虑,直到进一步的研究已经完成,以确定哪些EC气溶胶和使用模式的组件负责呼吸道生物的伤害。
参考
-
1。
Caponnetto P,平原d,Papale宫殿G,拉索C,电子香烟Polosa R.新兴现象。ExpertRevRespirMed。2012; 6:63-74。
-
2。
McNeill AB, Brose LS, Calder R, Hitchman SC, Hajek P, McRobbie P。:E-cigarettes: an evidence update: a report commissioned by Public Health England. (England PH ed. London: PHE; 2015.
-
3。
医生有数。无烟尼古丁:减少烟草危害。伦敦:RCP;2016.p。2016。
-
4。
绿色SH,拜耳R,仙童AL。证据,政策和E-香烟 - 将英格兰重构的争论?新英格兰医学杂志。2016; 374:1301-3。
-
5。
Hutzler C,帕施克男,Kruschinski S,Henkler女,哈恩Ĵ,鲁奇A.化学危害存在于液体和电子香烟的蒸气。拱门毒理学。2014; 88:1295-308。
-
6.
彩K,费边L,Mottey N,科贝特A,福斯特J.青壮年鼻烟,可溶解烟草产品,和电子烟的有利的看法:从焦点小组研究结果。AmJPublic健康。2012; 102:2088-93。
-
7.
ASH:ASH简介:在大Britan成年人电子烟(vapourisers)的使用。在ASH简介。http://www.ash.org.uk/files/documents/ASH_891.pdf;2016年
-
8.
艾尔斯JW,Ribisl KM,布朗斯坦JS。跟踪使用搜索查询监控电子尼古丁输送系统(电子香烟)的流行程度的上升。AmJPrevMed。2011; 40:448-53。
-
9。
麦克米伦R,MadukaĴ,新兴烟草产品在美国的温尼考夫J.使用。JEnvironPublic健康。2012; 2012:989474。
-
10。
皮尔森JL,理查森A, Niaura RS, Vallone DM, Abrams DB。电子烟的意识、使用和危害美国成年人的认知。AmJPublic健康。2012;102:1758 - 66。
-
11。
Giovino GA,米尔扎SA,沙美JM,古普塔PC,贾维斯MJ,Bhala N,皮托R,Zatonski W,夏Ĵ,莫顿J,等。3个十亿个人烟草使用来自16个国家:全国代表性的断面住户调查的分析。柳叶刀。2012; 380:668-79。
-
12。
Cervellati楼穆雷桑XM,Sticozzi C,甘R,Montagner G,福曼HJ,托里切利C,Maioli E,在人角质形成细胞和上皮肺细胞的电子和香烟烟雾之间Valacchi G.比较的效果。ToxicolIn体外。2014; 28:999-1005。
-
13。
勒纳CA,孙大信IK,姚H,GerloffĴ,Ossip补充DJ,McIntosh的S,鲁宾逊R,拉赫曼I.蒸气产生由电子香烟和电子果汁与调味剂诱导毒性,氧化应激和肺上皮细胞和炎症反应小鼠肺。PLoSOne。2015; 10:e0116732。
-
14。
施魏策尔KS,陈SX,法律S,凡DM,普瓦里耶C,司法MJ,哈伯德WC,金ES,赖X,王男,等。尼古丁和电子烟蒸气暴露的内皮破坏性促炎效应。上午生理学杂志肺癌细胞与分子生理学。2015; 309:L175-87。
-
15。
Sussan TE,Gajghate S,Thimmulappa RK,马静,金JH,Sudini K,Consolini N,Cormier的SA,Lomnicki S,哈桑F等。暴露于电子香烟也妨碍肺在小鼠模型中抗细菌和抗病毒防御。公共科学图书馆之一。2015; 10:e0116861。
-
16.
Schaal C,Chellappan SP。尼古丁介导的细胞增殖和肿瘤进展与吸烟有关的癌症。分子癌症研究。2014; 12:14-23。
-
17.
奥尔巴赫O,福尔曼JB,基尔JB,Kassouny DY,Muehsam GE,Petrick TG,斯莫林HJ,粗壮AP。在相对于肺的吸烟与癌症支气管上皮变化;的进展情况的报告。新英格兰医学杂志。1957; 256:97-104。
-
18.
哈维BG,Heguy A,利奥波德PL,卡罗兰BJ,摩天B,水晶RG。响应于吸烟小气道上皮细胞的基因表达的修饰。Ĵ分子医学(贝尔)。2007; 85:39-53。
-
19.
豪格,朱,尤托卡布施,伍兹,埃利奥特,布扎图,切尼亚克RM,罗杰斯RM,休尔巴FC,科克森HO, Pare PD。慢性阻塞性肺疾病小气道阻塞的性质。N Engl J Med. 2004; 350:2645-53。
-
20。
Russi TJC, R. G。:Use of bronchoalveolar lavage and airway brushing to investigate the human lung. In The lung: Scientific Foundations. Second Edition edition. Edited by Crystal RGW, J.B.; Weibel,E.R.; Barnes, P.J. Philadelphia: Lippincott-Raven Publishers; 1997: 371–382.
-
21。
Shaykhiev R,克劳斯A,SalitĴ,Strulovici-BAREL Y,哈维BG,O'Connor的TP,水晶RG。肺泡巨噬细胞偏振吸烟相关重编程:含义为慢性阻塞性肺疾病的发病机理。免疫学杂志。2009; 183:2867-83。
-
22。
戈登·C、古迪·K、克劳斯·A、萨克罗维茨·R、哈维·BG、斯特鲁罗维茨·巴洛尔·Y、梅泽·j·g、克里斯托·RG。循环内皮微粒作为香烟吸烟者早期肺损伤的一种测量方法。Am J Respir Crit Care Med. 2011; 184:224-32。
-
23。
Strulovici-BAREL Y,施陶特MR,克劳斯A,戈登C,特利AE,哈维BG,坎儿RJ,的Hollmann C,Mezey JG,苦H,等人。尽管戒烟循环中COPD内皮微粒的持久性。胸部。2016年
-
24。
克特NR,巴特勒MW,Shaykhiev R,SalitĴ,Omberg L,Rodriguez的-Flores的JL,Mezey JG,Strulovici-BAREL Y,王G,迪东L,水晶RG。人小气道上皮细胞转录的RNA-Seq的定量。BMC基因组学。2012; 13:82。
-
25。
阿尔伯克基EX,佩雷拉EF,Alkondon男,罗杰斯SW。哺乳动物烟碱乙酰胆碱受体:从结构到功能。生理学评论2009; 89:73-120。
-
26。
李HW,公园SH,翁兆瓦,王HT,黄WC,Lepor H,吴XR,陈LC,唐女士。E-香烟烟雾损害DNA,并减少在小鼠肺,心脏,膀胱,以及在人类肺癌和膀胱细胞修复活性。国家科学院院刊美A. 2018; 115:E1560-9。
-
27。
詹森RP,罗W,潘科JF,Strongin RM,佩顿DH。在电子香烟气溶胶隐藏甲醛。新英格兰医学杂志。2015; 372:392-4。
-
28.
瓦列特V,法萨利诺斯K,奥格斯伯格M,托马斯A,等JF。电子烟补充液毒性评价。国际环境卫生。2015;12:4796-815。
-
29.
内山S,太田K,稻叶Y,从使用具有的氢醌和2,4-二硝基苯肼浸渍的二氧化硅耦合墨盒E-香烟产生的羰基化合物,接着高效液相色谱法的Kunugita N.测定。肛门科学。2013; 29:1219至1222年。
-
30.
林HB,金SH。电子香烟盒溶液加重的Inhallation过敏原诱导的气道炎症和在小鼠中高反应性。ToxicolRes。2014; 30:13-8。
-
31.
卡拉汉 - 里昂P.电子香烟:人类健康的影响。TOB控制。2014; 23(增刊2):ii36-40。
-
32。
Reidel B,Radicioni G,克拉普PW,福特AA,Abdelwahab S,Rebuli ME,Haridass P,亚历NE,雅斯贝尔斯I,Kesimer M. E-香烟使用导致在肺独特的先天免疫应答,涉及增加嗜中性活化和改变粘蛋白的分泌。牛J和呼吸暴击保健医学。2018; 197:492-501。
-
33。
Lozano G. p53之谜。1 .冷泉季节生物规律分析。2016;81:37-40。
-
34。
温顺的DW。p53抑制肿瘤:DNA损伤反应的作用?Nat Rev Cancer. 2009; 9:714-23。
-
35。
Yee KS, Vousden KH。使p53的复杂性复杂化。致癌作用。2005;26:1317-22。
-
36。
富兰克林·WA, Gazdar AF, Haney J, Wistuba II, La Rosa FG, Kennedy T, Ritchey DM, Miller YE。p53在呼吸道上皮细胞中广泛分布。一种新的野外致癌机制。[10]李国强。中国投资。1997;100:2133-7。
-
37。
Shaykhiev R, Wang R, Zwick RK, Hackett NR, Leung R, Moore MA, Sima CS, Chao IW, Downey RJ, strulovicii - barel Y,等。健康吸烟者的气道基底细胞表达与肺癌相关的胚胎干细胞信号。干细胞。2013;31:1992 - 2002。
-
38。
Toyooka S, Tsuda T, Gazdar AF. TP53基因、烟草暴露与肺癌。哼Mutat。2003; 21:229-39。
-
39。
Wistuba II, Lam S, Behrens C, Virmani AK, Fong KM, LeRiche J, Samet JM, Srivastava S, Minna JD, Gazdar AF.吸烟者和戒烟者支气管上皮的分子损伤。中国癌症杂志1997;89:1366-73。
-
40。
《癌症中的FOXM1:相互作用与脆弱性》。实用癌症杂志2017;77:3135-9。
-
41.
Balli d,任X,周杰伦FS,十字E,张Y,Kalinichenko VV,卡林电视。FOXM1转录因子所需的肺部炎症和肿瘤形成过程中巨噬细胞迁移。癌基因。2012; 31:3875-88。
-
42.
Lebender LF,PrünteL,Rumzhum NN,阿米特AJ。选择性靶向前列腺素E(EP)受体介导的细胞信号传导途径:对肺健康和疾病。Pulm药理学疗法。2018; 49:75-87。
-
43.
阿罗诺夫DM,卡内蒂C,彼得斯-金M.前列腺素E2抑制通过细胞内环AMP的E-2前列腺素受体介导的增加肺泡巨噬细胞的吞噬作用。免疫学杂志。2004; 173:559-65。
-
44。
巴林杰MN,阿罗诺夫DM,麦克米兰TR,库克KR,Olkiewicz K,陶斯GB,彼得斯-金男,穆尔BB。在骨髓移植后受损的肺宿主反应前列腺素E2的生产过剩的关键作用。免疫学杂志。2006; 177:5499-508。
-
45。
Sadikot RT,曾H,阿齐姆AC,裕男,戴伊SK,布雷尔RM,皮布尔斯RS,布莱克韦尔TS,克里斯特曼JW。铜绿假单胞菌的细菌清除是通过COX-2的抑制增强。欧洲免疫学杂志。2007; 37:1001-9。
致谢
我们感谢A.E. Tilley, a.k rause, P-Y Chung, f.a osto- perez, s.d Hyde, a.r algalski, t.s odeinde和r.r him对研究的帮助,以及n.m hamedi对准备这份手稿的帮助。
资金
这些研究支持的,部分由P20 HL113443,3R01HL107882-S1和UL1 TR000457-06。研报本出版物中由美国国立卫生研究院和家庭吸烟预防和烟草控制法的支持。内容完全是作者的责任,并不一定代表美国国立卫生研究院或食品药品监督管理局的官方观点。
数据和材料的可用性
这些数据是在NCBI基因表达综合(GEO登录号:GSE85121)公开可用。
资助者的角色
该资助者在研究设计,数据收集和分析,决定发表或准备手稿没有作用。
作者信息
隶属关系
贡献
MRS和RGC设计的研究;MRS,JS和RGC分析数据和写文章;RK监督研究的医疗方面,进行的医疗掩护和支气管镜检查程序;CH指导临床操作和监管事务。所有作者阅读并认可的终稿。
通讯作者
通讯作者罗纳德·g .水晶。
伦理声明
伦理批准和同意参与
Weill Cornell Medicine (WCM)机构审查委员会批准了这些协议。研究对象的评估和同意在威尔康奈尔医学院临床转化和科学中心和遗传医学临床研究设施的部门。
IACUC批准不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
出版商的注意
《自然》杂志对出版的地图和附属机构的管辖权主张保持中立。
额外的文件
附件1:
补充方法。对于希西从不吸烟者包含/排除标准。表S1。电子烟效果比例。表S2A。电子烟生命体征开始。表S2B。电子烟生命体征的时间点不同。表S3。尿液尼古丁代谢物暴露于电子烟烟雾前和后。表S4。急性吸入含尼古丁电子烟后,小气道上皮细胞差异表达基因。表S5。小型气道上皮细胞中特异表达基因继E-香烟的急性吸入不含尼古丁。表S6。电子烟与尼古丁急性吸入后肺泡巨噬细胞的差异表达基因。表S7。急性吸入无尼古丁电子烟后肺泡巨噬细胞差异表达基因。(PDF 199 kb)
权利和权限
188滚球软件本文遵循知识共享署名4.0国际许可条款(http://creativecommons.org/licenses/by/4.0/),允许在任何媒体不受限制地使用,分配和繁殖,只要你给予适当的信贷给原作者(S)和源,提供了一个链接到Creative Commons许可,并指示是否进行了更改。创作共用公共领域贡献获豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,但另有规定的除外。
关于这篇文章
引用本文
施陶特,M.R.,Salit,J.,坎儿,R.J.et al。以下电子烟的急性吸入健康不吸烟者的肺改变生物学。和呼吸RES19日,78(2018)。https://doi.org/10.1186/s12931-018-0778-z
收到了:
接受:
发表: