抽象的
介绍
糖皮质激素抗炎治疗的中流砥柱,但显著的不利影响最终限制其效用。先前的努力来设计结构的糖皮质激素具有增加的治疗窗口集中在离解从主要由转录激活驱动的不良影响抗炎转录抑制。这种药物化学方法的替代方法是基于系统生物学策略,旨在选择性扩增在免疫细胞中非常低的剂量糖皮质激素的抗炎活性,而没有调节的替代蜂窝网络介导的糖皮质激素的毒性。
方法
泼尼松龙和抗血栓药物潘生丁的组合使用异形体外和在活的有机体内抗炎活性的模型和糖皮质激素诱导的不良反映,证明解离活性谱。
结果
该组合协同抑制促释介导剂的释放,包括肿瘤坏死因子-α,IL-6,趋化因子(C-C基序)配体5(RANTES),基质金属蛋白酶-9和其他来自人外周血单核细胞和小鼠巨噬细胞。在大鼠急性脂多糖诱导的内毒血症和延迟型超敏反应的模型中,以及在胶原诱导和佐剂诱导的关节炎的慢性模型中,该组合产生了仅需要血吸虫的子治剂量的抗炎活性。双吡酰胺的泼尼松渗透炎活性的免疫特异性扩增与糖皮质激素介导的不利影响没有延伸,包括皮质酮抑制或酪氨酸氨基转移酶的表达增加,在活的有机体内在大鼠重复给药后。给小鼠口服8周后,联合用药不会改变泼尼松龙诱导的骨钙素和股骨中段骨密度的降低,这是类固醇诱导的骨质疏松症的标志。此外,在促肾上腺皮质激素AtT-20/D16v-F2细胞网络中未观察到扩增体外,如由阿黑皮素原的表达和促肾上腺皮质激素的分泌测定。
结论
这些数据表明,低剂量强的松龙和双嘧达莫的多靶点机制通过糖皮质激素介导的抗炎信号的细胞网络选择性放大,创造了一个解离活性谱,并增加了治疗窗口。
介绍
糖皮质激素的健壮抗炎作用在临床环境广泛地适用于治疗不同的病症,包括风湿性疾病,过敏症,皮肤病,肺部病症,癌症,移植排斥,和甚至脊髓损伤。不幸的是,糖皮质激素的长期的临床应用受到不期望的不利影响的限制,其中包括抑制下丘脑 - 垂体 - 肾上腺轴(HPA)的,血清葡萄糖增加,骨质疏松症和青光眼的诱导,改变电解质平衡,失眠和其它行为改变。具有甚至相对低的剂量治疗慢性(例如,7.5毫克/天泼尼松龙)可导致的糖皮质激素诱导的不利影响的子集[1那2].因此,通过改进的治疗窗口的糖皮质激素的研制是多组的焦点面积。
糖皮质激素的各种作用是由糖皮质激素受体(GR)介导的。非配体GR被糖皮质激素结合和激活后释放的热休克蛋白保留在胞质中[3.].一旦激活GR易转移到核,并且可以直接与糖皮质激素响应元素(GRES)作为同源体结合,导致转录的活化和抑制,这取决于启动子结构和与各种共同活化剂和共压缩机的相互作用。另外,活化的GR可以通过独立于DNA结合的机制来影响转录,该机制调节其他转录因子的活动,包括核因子-κB,活化剂蛋白-1和统计(信号传感器和转录激活剂)[4.].最后,激活GR经由3'-非翻译区的结合引起的各种通过mRNA稳定性的调制转录非依赖性作用[5.].正是这些不同机制,这影响多个分子靶,细胞,组织,其导致所希望的抗炎活性和糖皮质激素治疗的不希望有的不利影响的整合。
从糖皮质激素的不良反应中解离抗炎活动的努力主要集中在分离活化GR的DNA结合依赖性(转录激活)和DNA结合依赖性(转录抑制)活性。缺乏DNA结合活性的GR的二聚化缺陷突变体可以抑制活化剂蛋白-1介导的转录,但它们不能激活GRE-调节基因的转录[6.].糖皮质激素治疗可以抑制表达此GR的纯合鼠中的局部和全身炎症暗淡突变,强调DNA结合无关机制对观察到的抗炎作用的重要性在活的有机体内[7.]相反,糖皮质激素治疗的许多不良反应是由于DNA结合依赖性激活(高血糖、高血压)或通过激活GR同型二聚体结合GRE抑制转录(抑制HPA轴、骨质疏松)[8.那9.].一些选择性GR调节剂或选择性GR激动剂(SEGRAs)已经被开发出来,可以从一些经典的糖皮质激素不良反应中分离出抗炎活性[10-15].
早期使用药物化学进行类固醇解离的尝试取得了不同程度的成功,因为糖皮质激素的抗炎活性和不良反应并没有沿着转录抑制和转录激活的机制线完全打破。例如,糖皮质激素的不良作用,包括抑制HPA轴、骨质疏松和皮肤萎缩,可能至少部分是由dna结合独立的抑制作用引起的[8.].同样,抗炎作用的靶点是膜联素-1 (lipocortin-1) [16],糖皮质激素诱导亮氨酸拉链[17那18],和tristetraprolin [19]由糖皮质激素的DNA结合依赖的转录活化作用正调控。最后,从GR巨噬细胞暗淡小鼠表现出降低的IL-1β的糖皮质激素抑制,单核细胞趋化蛋白-1(CCL2),巨噬细胞炎性蛋白-2(CXCL2)的效力,和干扰素γ诱导蛋白-10(CXCL10)20.]。糖皮质激素作用的有效分离以提高治疗指数可能需要仔细调整DNA结合依赖性(转录激活)和DNA结合非依赖性(转录抑制)达到理想抗炎活性与不良反应诱导之间更好平衡的效果[21].这种类型的多参数优化对糖皮质激素解离的药物化学方法提出了重大挑战。
的另一种方法离解利用协同多目标生物学的选择性扩增在免疫细胞糖皮质激素的抗炎活性,而不会影响在替代蜂窝网络糖皮质激素诱导的不利影响[22那23].抗血栓药物双嘧达莫和极低剂量的糖皮质激素强的松龙的联合分子效应产生了这样的活性谱。双嘧达莫可抑制平衡核苷转运体和磷酸二酯酶的活性,增加cAMP和cGMP,从而阻止血小板的激活,它与低剂量阿司匹林联合用于治疗性中风预防[24]双嘧达莫还显示了使用基于细胞的药物的抗炎活性体外楷模 [25].强的松龙和双嘧达莫的协同联合抑制脂多糖(LPS)刺激的人外周血单个核细胞分泌肿瘤坏死因子(TNF)-α,以及小鼠骨源性巨噬细胞分泌一套独特的细胞因子、趋化因子和蛋白酶[26](弗雷泽CC,未发表的数据)。In addition to suppressing the rheumatoid arthritis (RA)-modifying target TNF-α, the combination inhibits additional targets, including chemokine (C-C motif) ligand 5 (RANTES) and matrix metalloproteinase-9 (gelatinase-B), which are upregulated in RA synovium [27-30.]和IL-6已被验证为ra治疗Ra的新目标[31].在类风湿性关节炎中,低剂量泼尼松龙治疗通常被认为是每天7.5毫克[32那33].非常低剂量的泼尼松龙(3毫克/天)和双嘧达莫(400mg /天)的组合表现出了在手骨关节炎的人类临床试验[统计学显著效果34]和RA (Kirwan JR,未发表数据)。通过测量该联合药物在大鼠急性和慢性炎症模型中的活性,证明了该联合药物的选择性。然后在不同的培养基中测试这种组合在活的有机体内的糖皮质激素诱导的不利影响,包括HPA的抑制模型轴线标记皮质酮,糖异生基因酪氨酸转氨酶(TAT)的诱导,和对骨稳态的标记物的效果。这些数据支持了这样的组合的选择性活性谱,其中双嘧达莫放大免疫细胞泼尼松龙的期望的抗炎活性,而没有在介导的不良影响,以产生改善的治疗指数的替代蜂窝网络增强糖皮质激素作用。
材料和方法
人外周血单核细胞细胞因子抑制测定
化合物自Sigma-Aldrich(圣路易斯,MO,USA),和合适浓度的储备溶液(在二甲亚砜)中得到使用处理液体的自动化连续稀释于主板并转移至测定板。从健康供体的每日获得的人血沉棕黄层新鲜并在10%胎牛血清补充了培养基中稀释(FBS; HyClone公司(洛根,UT,USA))之前的刺激与LPS(目录号L-4130; Sigma-Aldrich公司)在2微克/毫升和除了测定板。将板温育在37℃下18小时,5%的二氧化碳。上清液转移到用抗TNF-α抗体的ELISA板(目录号551220; BD Pharmingen公司(圣地亚哥,CA,USA))。然后将板用的第二抗体探查之前洗涤(目录号554511; BD Pharmingen公司)和铕标记的检测试剂(目录号1244-360;珀金埃尔默(沃尔瑟姆,MA,USA))。由化合物或组合处理的值(T)与所述车辆中位数单独级(U)进行比较 - 时间分辨荧光的原始数据值转化为相对的分数抑制(T / U I = 1)。协同作用是通过比较该组合的给Loewe加标准响应来确定[35],并使用组合指数(CI)进行数值比较[36].例如,CI70= (CX/我知道了70X) + (Cy/我知道了70Y(C)X/我知道了70X)对于混合物是70%有效混合物中的化合物X浓度的比例(C.X)超过其70%的抑制浓度单独应用(IC70X).
大鼠内毒血症模型
Lewis (LEW/SsNHsd)大鼠(n = 8/组)经灌胃给予相应的试验或对照剂。给药后2小时(时间= 120分钟),腹腔注射大肠杆菌血清型0111:B4 LPS(Sigma-Aldrich)。对照动物接受盐注射。在LPS给药后90分钟通过二氧化碳窒息使动物安乐死。使用ELISA(Biosource,Camarillo,Ca,USA)测定血清样品的TNF-α水平。所有研究程序都由Combinatorx,Inc。机构动物护理和使用委员会批准。
鼠标迟发型超敏反应模型
将2,4-二硝基氟苯(DNFB)溶液应用于CD-1小鼠(n=5/组)腹部,使其致敏。在应用DNFB后5天,通过灌胃给药给小鼠指定剂量(mg/kg)的试验药物.给药两小时后,用DNFB涂抹左耳外表面和内表面,对动物进行挑战。用稀释剂(4:1丙酮/橄榄油)涂抹右耳作为对照。在激发24小时后,麻醉小鼠,并使用电子精密卡尺测量DNFB处理的耳朵和对照耳朵的厚度,以确定厚度变化(mm)。
鼠胶原诱导关节炎模型
刘易斯(LEW / SsNHsd)大鼠(n = 12 /组)用从在不完全弗氏佐剂(产品编号F5506乳化新生小牛关节(弹性蛋白产品公司,公司,Owensville,MO,USA)的II型胶原进行免疫; Sigma公司-Aldrich)。约2mg / kg的胶原经由皮内注射是给所有的动物在研究的第1天。将100μl的胶原/佐剂进行了改造,一个到尾的基部而另一进一步向上背面的两次注射,由大约1.5 cm分离。相同材料的增压喷射真皮内给予该研究的第6天。车辆和测试试剂被通过口服管饲法给药。给药体积为5ml / kg和基于体重测量每周进行调整。治疗期间通过第27天为第10天胫跗关节厚度使用第3天,6,8,13,15,17,20,22,24和27变化关节厚度的电子卡尺测量物相对于所计算出的第3天测量。所有的研究程序是由MDS医药服务公司(Bothell的,WA,USA)机构动物护理和使用委员会的批准。
12只鲁汶大鼠(n = 12/组)用可溶性II型胶原蛋白(1 mg/ml)免疫,不完全弗氏佐剂皮下注射背部15个部位。随后10天出现胶原诱导关节炎(CIA),从10天到28天每天灌胃给药,剂量(mg/kg)。每天记录每个后爪的关节炎严重程度,使用从0到4的整数标度来量化红斑和肿胀的水平(0 =正常;4 =最大)。双后爪之和(最高8分)代表关节炎的严重程度。在祭祀时(第28天)采集后肢,根据x线照片关节指数从0到3进行评分,评分依据是软组织肿胀、关节间隙狭窄、骨膜新生骨形成、有无侵蚀和/或强直(0 =正常;3 =最大联合破坏)。关节指数的x线表现为双后爪的和,最高为6分。实验方案符合加州大学洛杉矶分校动物护理和使用委员会批准的方案。
大鼠重复给药模式
刘易斯(LEW / SsNHsd)大鼠(n = 5 /组)称重并放置到六个研究组中的一个。隔日体重记录整个研究。动物在基于整个研究中体重进展卷经检测剂口服强饲法每日给药。在第10天,2小时后口服给药时,将动物通过二氧化碳窒息安乐死。所有研究程序都由Combinatorx,Inc。机构动物护理和使用委员会批准。
收集血液和皮质酮判定从血清(诊断系统实验室有限公司,韦伯斯特,TX,USA)分离。胸腺和脾脏收集和称重。肝脏取出样品并在4℃下储存在RNAlater(Ambion公司,奥斯汀,TX,USA)。肝脏样品用TissueRuptor(Qiagen)进行匀浆,并总RNA使用RNeasy-PLUS迷你试剂盒(Qiagen公司,瓦伦西亚,CA,USA)。被用于一步RT-PCR(的QuantiTect探针; Qiagen)进行总RNA的等量。市售测定试剂(TaqMan基因表达分析;应用生物系统公司,福斯特市,CA,USA)用于检测TAT的和β-actin(内参)的mRNA,使用7300实时PCR系统。
鼠标骨质疏松模型
开始给药前,根据体重将小鼠(C57Bl/6)随机分为治疗组(n=10/组)。试验药物通过口服灌胃给药,地塞米松除外,地塞米松通过皮下注射给药。所有药物每天给药两次,每周制备新制剂,总治疗期为8周。在尸检进行荧光标记前6天和2天,给动物腹腔注射两剂钙黄绿素10 mg/kg。尸检前用异氟醚麻醉动物,采集终末血样,分离血清并冷冻保存,直到分析骨标志物。收集股骨和腰椎进行双能X线吸收测定、外周定量计算机断层扫描和组织形态计量学检查。所有研究程序均由MDS制药服务机构动物护理和使用委员会批准。
Corticotroph营地化验
在96孔板上以每孔60,000个细胞的密度播种at -20细胞,以测定cAMP水平在不同处理条件下的变化。细胞恢复18 h后,在室温下用双嘧达莫(10 μmol/l)、罗利普仑(10 μmol/l)或二甲基亚砜对照处理30 min。然后用促肾上腺皮质激素释放因子(37.5 nmol/l)或对照(载体)在室温下刺激细胞30分钟。使用LANCE cAMP检测试剂盒(PerkinElmer)定量测定cAMP水平。
Pro-Omiomelanocortin表达和肾上腺皮质激素分泌物分泌测定
鼠垂体前叶促肾上腺皮质激素细胞系ATT-20 /从美国典型培养物保藏中心(Manassas,VA,USA)获得并保持在Dulbecco氏有10%FBS的最低必需培养基(美国典型培养物保藏中心),在37 D16v-F2°下用5%的二氧化碳。为了确定与泼尼松龙和/或双嘧达莫治疗的AtT20细胞相对阿黑皮素原(POMC)的表达,实时RT-PCR在使用最终使其细胞RT-PCR试剂盒(Qiagen)的细胞裂解物进行的。可商购的检测试剂(TaqMan基因表达测定法;应用生物系统公司)被用于检测POMCβ肌动蛋白(内源性对照)的mRNA。实时RT-PCR使用7300实时PCR系统来完成。对于ACTH分泌实验,的AtT20细胞在24孔板中在125,000个细胞的密度接种/孔在Dulbecco氏最小基本培养基补充有10%炭/葡聚糖FBS(HyClone)的,并与泼尼松龙和/或双嘧达莫治疗。(100 nmol / L的CRF)24小时后,将培养基与在不存在相同化合物治疗或促肾上腺皮质激素释放因子存在刷新。三个小时后(27小时),收集培养基用ELISA(MD Biosciences公司,圣保罗,明尼苏达州,美国)ACTH的评价。
结果
体外抗炎测定
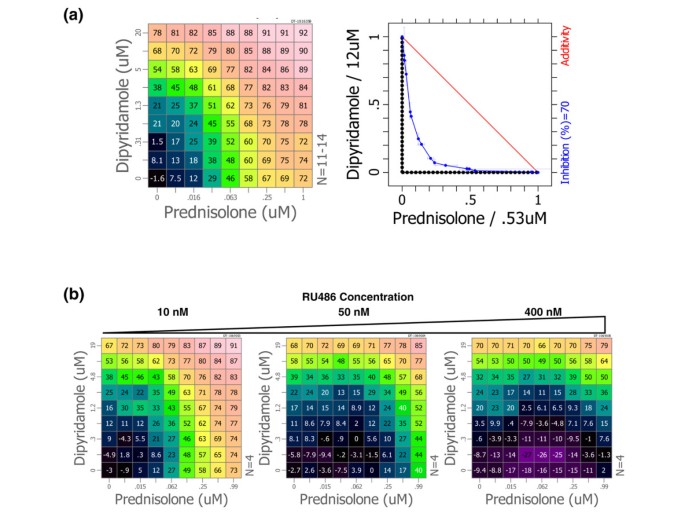
泼尼松龙和潘生丁联合使用可协同抑制促炎症标志物的产生体外。基于TNF-α的协同抑制从佛波醇肉豆蔻乙酸酯和钙离子载体观察的组合被发现在附加信息文件刺激的人外周血单核细胞(PBMC [见图S11])。在二次检测中,发现联合抑制lps刺激的PBMCs的TNF-α分泌,CI为0.31±0.02(图)1左面板)。CI约为1的组合可加性相互作用,如药物与自身结合时所期望的,CI值低于1表示成分之间存在协同作用[36].异丙漆分析表明该组合的协同效应允许减少在为泼尼松龙的10倍和为二吡啉的五倍实现TNF-α分泌所需的药物浓度,以便为二吡哚(图)1右面板)。
泼尼松龙与潘生丁的协同抗炎作用体外。(一)双嘧达莫和强的松龙采用两倍连续稀释法进行正交稀释,然后联合用药,形成联合用药剂量-反应矩阵。强的松龙和双嘧达莫作为单独药物的剂量反应分别位于底部一行和左列。组合剂量填写矩阵和成分浓度可从行和列标签读。将联合剂量-反应矩阵应用于脂多糖(LPS)刺激的人外周血单个核细胞(PBMCs), 18小时后用ELISA法测定上清液中的肿瘤坏死因子(TNF)-α。相对于对照组,基质中每个细胞中TNF-α分泌的抑制百分率显示,并用颜色标度表示,其中暖色表示更多的抑制(左)。抑制矩阵的等谱分析(蓝线)在70%的抑制水平(右)下比较了结合的活性与理论加性相互作用(红线)。协同作用低于加性阈值并接近原点,拮抗作用位于红色加性线上方。(b)测量组合矩阵,包括固定剂量的RU486在相应剂量响应矩阵中每个点的指示浓度。相对于载体处理的对照组,lps诱导的TNF-α分泌的抑制百分率显示在基质的每个细胞中。
用浓度为50 nmol/l的GR拮抗剂RU486治疗可消除泼尼松龙的活性和联合效应,但潘生丁的活性不受影响(图1)1 b).如此低剂量的RU486的拮抗作用表明,这种作用可能主要是由二聚体GR的gres依赖的转录激活活性介导的。
在活的有机体内抗炎测定
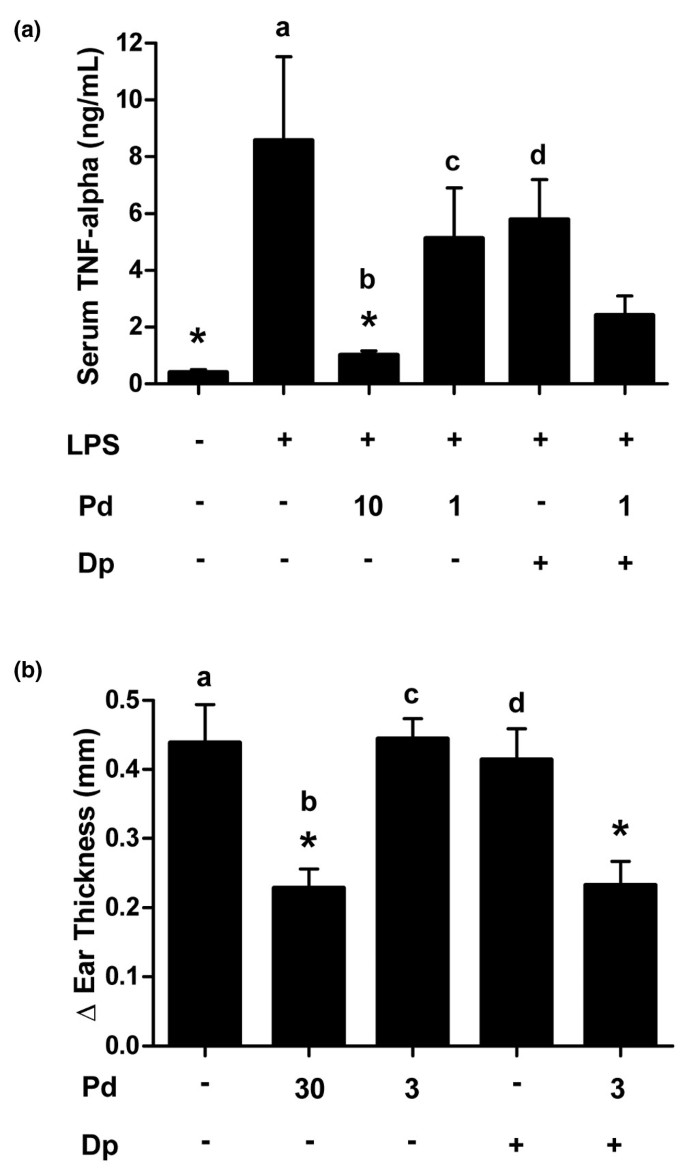
泼尼松龙和双嘧达莫的组合抑制TNF-α在急性炎症模型,与疾病活动在CIA的影响。前2小时LPS攻击口服高剂量的泼尼松龙(10毫克/千克)能够显著减少内毒素血症的大鼠的急性模型血清TNF-α[37].泼尼松龙以1毫克/千克,和潘生丁在150毫克/千克,得到在TNF-α释放没有显着的减少相比,LPS对照。在TNF-α释放,这是低剂量和高剂量的泼尼松龙的效果之间的中间两种药剂组合的产生减少(图2).这些趋势也分别在LPS攻击模型的重复观测。
泼尼松龙和潘生丁联合使用可抑制急性炎症在活的有机体内。(一)Lewis大鼠按指示口服化合物(mg/kg) 2小时,然后用脂多糖(LPS)攻毒。90 min后取血清,ELISA法测定肿瘤坏死因子-α水平。*P.< 0.01与LPS对照;一种P.= 0.06,B.P.= 0.98,CP.= 0.81,D.P.= 0.59。(b)小鼠用化学刺激物2,4-二硝基氟苯(DNFB)致敏。五天后,动物通过口服管饲法以所示剂量施用测试剂(毫克/千克)和激发与DNFB溶液耳。耳厚度的变化24小时,测量攻击后(Δ耳厚度(mm))。*P.与车辆控制相比< 0.05;一种P.= 0.02,B.P.= 1.0,CP.= 0.02,D.P.=0.05与联合用药相比。双嘧达莫的剂量为150 mg/kg。误差条为+平均值的标准误差。通过与Tukey、Dp、双嘧达莫、Pd、泼尼松龙的方差分析进行统计比较。
高剂量泼尼松龙在30口服给予毫克/千克是能够抑制化学诱导的超敏反应耳肿胀(图2 b).作为单个试剂的泼尼松龙(3mg / kg)和二吡啶酰胺(150mg / kg)的十倍相对于载体处理的对照没有效果。该组合证明了等于高剂量泼尼松龙的疗效,表明在该急性模型中的低剂量泼尼松龙的抗炎活性的二倍葡萄胶10倍。
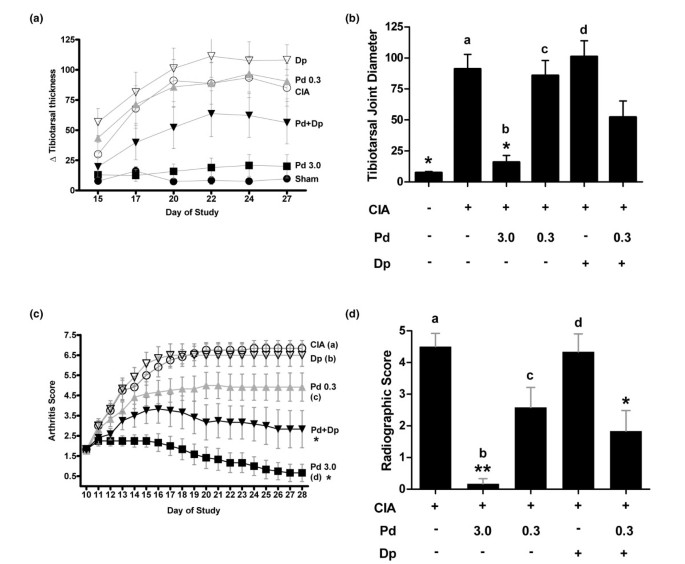
在Lewis和Louvain大鼠中CIA模型中的泼尼松龙和二吡哚组合也抑制了疾病活性。为了测试这种慢性炎症模型中的组合的活性,大鼠用胶原蛋白和后爪关节炎致敏,在未来10天内发育[38那39].与未经胶原诱导的动物相比,经泼尼松龙(口服3 mg/kg)治疗的Lewis大鼠的胫跖关节肿胀可忽略不计,且经0.3 mg/kg泼尼松龙或150 mg/kg潘生丁治疗的大鼠的胫跖关节炎症水平与经CIA诱导、载体治疗的对照组相似(图1)3a,b).在整个研究过程中,胫跗骨关节一直保持肿胀趋势。与单用双嘧达莫相比,强的松龙和双嘧达莫(0.3/150 mg/kg)联合治疗可显著减少肿胀,在研究的各个点,联合治疗组的胫骨跗骨肿胀处于低剂量和高剂量强的松龙组之间。
泼尼松龙和双嘧达莫合并抑制胶原蛋白诱导的关节炎在活的有机体内. Lewis大鼠出现胶原诱导性关节炎(CIA),持续10天,然后在接下来的17天每天口服所示化合物(mg/kg)。报告了与第3天测量值相关的后肢胫距关节直径的变化(一)在研究过程中和(b)在学习完成。*P.< 0.001与CIA对照;一种P.= 0.29,B.P.= 0.10,CP.= 0.14,D.P.= 0.004与组合。(c)CIA在Louvain大鼠中诱导10天,并每天10至28天口服一次施用试剂,如所示(Mg / kg)。关节炎严重程度每日评分为红斑和肿胀。*P.< 0.001与CIA对照;一种P.= 0.0003,B.P.= 0.001,CP.= 0.15,D.P.= 0.12相对于第28天的组合。(d)研究完成后,对后肢进行影像学关节指数评分。**P.<0.0001,*P.< 0.01与CIA控制;一种P.= 0.005,B.P.= 0.17,CP.= 0.84,D.P.= 0.01与第28天的组合。双嘧达莫含量为150mg / kg。误差条是±标准误差的平均值,统计比较是通过与Tukey的差异分析。Dp双嘧达莫;PD,泼尼松龙。
CIA的模型也在鲁汶大鼠身上重复了[39]从第10天到第28天每天测量关节炎评分(图3C,D).在研究(第28天)用载体或约6.5的双嘧达莫有关节炎评分处理的动物,这是从所述组合中的分数和高剂量泼尼松龙组显著不同的结论。组合治疗的动物(0.3 / 150毫克/千克)的平均关节炎得分的2.8,这是低剂量泼尼松龙(4.9)和高剂量的泼尼松龙(0.7)的效果之间的中间,这表明双嘧达莫可以放大的活性低剂量泼尼松龙在抑制红斑和关节肿胀。在研究结束时,后肢的射线照相分析表明,该组合相对于车辆控制组织损伤显著降低,并且类似于低剂量单独类固醇上关节间隙变窄的措施和糜烂和/或关节强直的存在(数字3 d).
在佐剂诱导的关节炎模型中进行了另一项联合试验[40[观察到相似的组合的抗炎活性。需要更高剂量的双嘧达莫(300mg / kg)来观察在该特定模型中的效果。收集组织并为基于炎症性浸润,培训组和软骨和骨变性的炎症和骨髓关节的组织学评估。泼尼松龙和双嘧达莫的组合在胫骨关节中的软骨损伤降低,类似于为高剂量泼尼松龙(5mg / kg)阳性对照组观察到的。如组织学分析所指出的表明,该组合强烈抑制了角膜关节的软骨损伤以及炎症,肺部形成和骨损伤[见附加数据文件中的图S21].
在活的有机体内安全分析
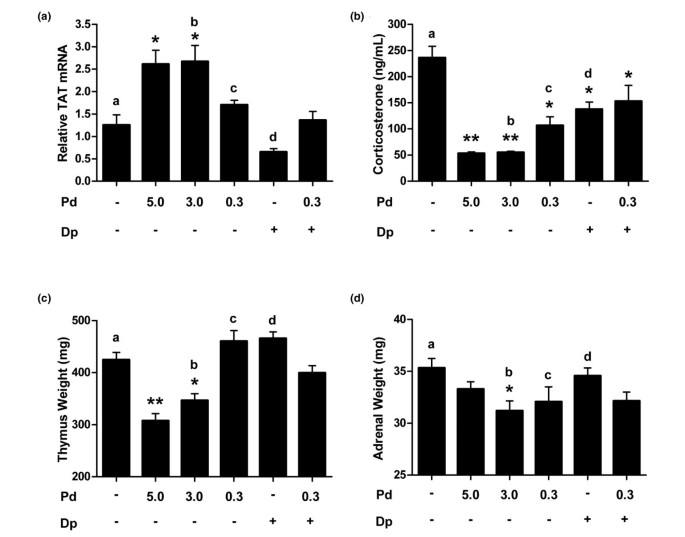
由泼尼松龙的抗炎活性的双嘧达莫被观察者放大并没有扩展到经典的糖皮质激素的不利影响。Lewis大鼠每天一次治疗10天与泼尼松龙的口服剂量组中的那些相同的CIA模型中使用。双嘧达莫的放大剂量增加2倍至300毫克/公斤的安全性研究。潘生丁的这种剂量的增加已经证明增加了某些型号的抗炎作用。在给药结束时,收获相应的组织来衡量安全参数。TAT,糖皮质激素激活的糖代谢的标志物,肝脏mRNA水平通过RT-PCR用单独的泼尼松龙和双嘧达莫重复治疗后进行了评价,并且在组合。每日与3或5毫克/千克的泼尼松龙治疗10天的动物经历了TAT mRNA在肝脏中的表达(2.6倍增加图4).相比之下,0.3 mg/kg泼尼松龙组的TAT mRNA在每日口服剂量下增加了1.7倍。与强的松龙高剂量组(3 mg/kg)相比,强的松龙和双嘧达莫(0.3/300 mg/kg)联合治疗导致TAT mRNA水平显著降低,但与强的松龙单独成分剂量(0.3 mg/kg)的效果无差异(图)4).
双嘧达莫不会改变低剂量泼尼松龙的安全性。(一)如图所示,重复给药10天后,通过RT-PCR评估Lewis大鼠肝脏中的酪氨酸氨基转移酶(TAT)mRNA水平。β-肌动蛋白用作内源性对照,结果显示TAT mRNA在载体上增加了倍*P.< 0.01与车辆控制相比,一种P.= 1.0,B.P.= 0.01,CP.= 0.90,D.P.= 0.30。(b)血清中皮质酮水平通过ELISA评估了慢性给药10天后的ELISA。**P.<0.0001,*P.与车辆控制相比< 0.05;一种P.= 0.03,B.P.= 0.01,CP.= 0.44,D.P.=0.98与组合。(c)在研究结束时测量了胸腺重量。**P.<0.0001,*P.<0.01对车辆控制;一种P.= 0.83,B.P.= 0.14,CP.= 0.06,D.P.= 0.03与组合。(d)肾上腺重量也在研究完成后评估。*P.与车辆控制相比< 0.05;一种P.= 0.21,B.P.= 0.98,CP.= 1.0,D.P.= 0.50相对于组合。双嘧达莫剂量为300 mg/kg。误差柱为+平均标准误差,统计比较采用与Tukey的方差分析。Dp双嘧达莫;PD,泼尼松龙。
糖皮质激素可以抑制HPA轴的产物,包括血清皮质酮。在用组合或单个组分10天的慢性处理Lewis大鼠后,收集血清以定量皮质酮水平。3和5 mg / kg泼尼松龙组显着抑制了血清皮质酮(图4 b).0.3 mg/kg的强的松龙对皮质酮的影响较小,当与双嘧达莫(300 mg/kg)联合使用时,这种影响没有被放大。慢性给药后还测量了胸腺和肾上腺的重量。3和5 mg/kg的强的松龙可抑制胸腺重量,但0.3 mg/kg的强的松龙单独或联合用药与对照相比对胸腺重量没有显著影响(图)4摄氏度).联合应用(0.3/300 mg/kg)对肾上腺重量的影响与单独应用0.3 mg/kg强的松龙的效果相同,与对照无显著差异(图)4 d).
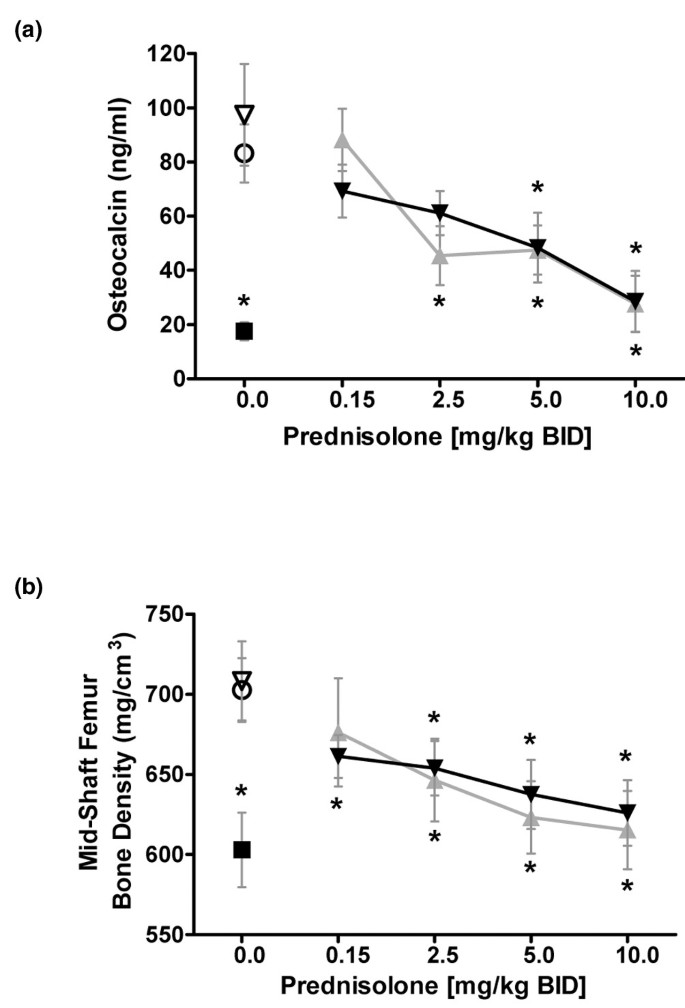
用糖皮质激素治疗慢性可以改变骨质疏松的各种标记物,包括骨钙素和骨的密度和质量的结构措施的表达。雌性小鼠口服,每天两次用单独的各种剂量的泼尼松龙,双嘧达莫,或骨质疏松症的这些替代标志的定量之前不同剂量的泼尼松龙与双嘧达莫,8周的组合处理。地塞米松(5毫克,每天一次/ kg)的用载体处理的对照相比降低显著骨钙素和中间轴的股骨骨密度。泼尼松龙与骨钙蛋白和中间的股骨骨密度(37.5一剂量依赖性降低,这不是通过加入双嘧达莫的改变相关联的mg,每天两次/公斤;图5.).
双嘧达莫不扩增泼尼松对骨质疏松症的替代标志物的影响。BL / 6小鼠每天服用两次,试剂共8周,以测量对骨稳态标志物的影响。(一)在研究结束时收集血清,并通过ELISA测定骨钙素。(b)研究中间轴股骨骨密度的后端被flurochrome标记测量,切片,和外周定量计算机断层扫描。泼尼松龙单独(灰色曲线);泼尼松龙与双嘧达莫的组合,每日两次(黑色曲线);双嘧达莫和单独车辆控制用空心三角和空心圆,分别表示;皮下地塞米松(5mg / kg的每日一次)阳性对照表示有黑色正方形。*P.<0.05与载体对照。双嘧达莫在37.5毫克剂量每天在这项研究中(从大鼠的每日总剂量为150毫克/千克allometrically缩放)两次/公斤。误差棒为±标准偏差和统计比较是通过使用Tukey方差分析。
体外corticotroph化验
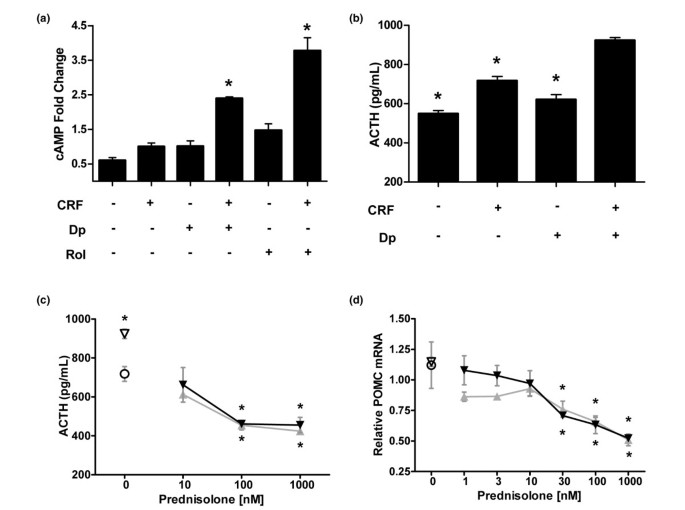
双嘧达莫对泼尼松龙抗炎活性的放大作用并没有达到抑制作用体外POMC基因和促肾上腺皮质激素分泌的抑制。在小鼠垂体前叶细胞系AtT-20/D16v-F2 (AtT-20)中测定了强的松龙、双嘧达莫和联合作用的影响,AtT-20是一种研究很好的皮质营养模型系统[41]用潘生丁和CRF刺激治疗后,AtT-20细胞中cAMP的相对含量增加了1.5倍(图6)在这些条件下,原型磷酸二酯酶(PDE)4抑制剂罗利普兰使cAMP增加了三倍。CRF刺激使未经治疗的对照细胞在3小时后的ACTH分泌增加,与单独刺激CRF相比,双嘧达莫(10μmol/l)预处理显著增加ACTH释放(图6 b).用泼尼松龙,双嘧达莫或组合进行24小时预处理ATT-20细胞,然后用CRF(100nmol / L)刺激以诱导acth分泌。与CRF刺激的对照相比,预处理捕获的分泌减少了acth分泌,并且与任何剂量的泼尼松龙(图)组合未观察到二嘧达莫(10μmol/ L)对acth分泌的刺激作用(图6摄氏度).强的松龙降低POMC mRNA表达,在24小时时间点观察到最大下降约50%(图)6 d).双嘧达莫(10 μmol/l)的添加不能增强强的松龙对POMC mRNA水平的影响,并能补偿极低剂量强的松龙的抑制作用。
双吡酰胺不能扩增HPA轴的标记的抑制体外。(一)用二吡酰胺(DP;10μmol/ L)或Rolipram(ROL;10μmol/ L)预处理ATT-20皮质细胞。在定量CAMP水平之前用Corticotropin释放因子(CRF)或载体控制刺激细胞。误差栏是+标准偏差(SD)。*P.< 0.01与单独CRF比较。(b)ATT-20细胞与DP或24小时的控制进行预处理。培养基用化合物刷新,然后用CRF或载体对照刺激额外的3小时。收集培养基用于通过ELISA测定ACTH水平的。误差杠+ SD。*P.< 0.001 vs CRF + Dp。(c)ATT-20细胞与在不存在(灰色曲线)或DP(10μmol/ L的)的存在(黑色曲线)中24小时增加剂量的泼尼松龙的预处理。培养基用化合物加CRF刷新。3小时后,ACTH水平通过ELISA确定。*P.< 0.001 vs单独对照。(d)ATT-20细胞用24小时在不存在(灰色曲线)或存在(黑色曲线)DP的增加剂量的泼尼松龙一起孵育。POMC mRNA水平通过RT-PCR分析测定的,使用β肌动蛋白作为内源对照。DP单独(为10μmol/ l)和车辆控制响应以表示一个开放的三角形和圆圈分别。误差棒为±SD,和统计分析是通过使用Tukey方差分析。HPA,下丘脑 - 垂体 - 肾上腺。
讨论
糖皮质激素具有强大的抗炎活性和改善疾病的作用是有充分证据的[42]但是用慢性给药观察到的安全问题[2]已经创建了具有扩展的治疗窗更安全的糖皮质激素的愿望。许多团体都在寻求与药物化学方法这一目标。显著已经取得了进展通过鉴定新的配位体GR保留大量的抗炎活性,同时减少键的糖皮质激素诱导的不利影响[10-15].鉴于GR系统的极端复杂性以及显影最低分子量化合物的挑战,其在选择性地消除不期望的效果的同时,鉴于GR系统的极端复杂性以及显影天然配体的期望活性的低分子量化合物的挑战,其取得了令人印象深刻。不幸的是,这些配体通常保留在一个或多个不利影响的措施不可接受活性,这可能需要对糖皮质激素分解的替代方法。
可以设想一种多组分治疗,利用系统生物学在炎症细胞网络环境中选择性地放大糖皮质激素活性,而不是介导不良反应的替代细胞网络。在这种多靶点方法中,一种增强剂被用来使免疫细胞网络对极低剂量的强的松龙的作用敏感,通过调节交叉信号通路,选择性地放大糖皮质激素的抗炎活性。介导糖皮质激素不良反应(例如,促皮质激素或肝细胞)的细胞网络的不同分子背景不支持扩增,因此极低剂量糖皮质激素的安全性得到维持。在机体水平上,联合作用产生所需的抗炎活性的糖皮质激素与增强治疗窗口。
泼尼松龙和抗血栓药物双嘧达莫的组合协同抑制了用LPS刺激的人PBMCs的TNF-α和其他促炎介质的分泌(图1),但也佛波醇肉豆蔻醋酸酯/离子霉素刺激的和αCD3 / CD28α-刺激的培养物[见图S1中附加信息文件1].因为组分的多目标的行动,该抗炎活性的剂量,其中泼尼松龙和双嘧达莫有边缘活性个人代理实现。的组合中的组分,包括双嘧达莫,是已知的以抑制TNF-α单独[43]但是协同组合效应意外[26].In secondary assays the combination was found to inhibit production of a unique profile of cytokines, chemokines, and proteases from LPS-stimulated mouse bone-derived macrophages, including synergistic suppression of TNF-α, IL-6, and chemokine (C-C motif) ligand 5, which are validated targets in rheumatic disease (Fraser CC, unpublished data).
强的松龙的活性及与双嘧达莫的协同作用被阻断体外由GR拮抗剂RU486(图1 b),证明该组合的抗炎作用是至少部分,GR依赖性,可能需要二聚化和转录激活。糖皮质激素核因子κB介导的转录的GRE独立镇压不显著10-100 nmol / L的RU486拮抗,但GRE相关的转录是强烈抑制[44]这一结果可能将该组合的活性与解离的GR配体区分开来,后者在反式抑制方面比反式激活更有效[12那13那15]强的松和潘生丁的联合使用,但不是单独的组分,已被证明能上调LPS刺激的小鼠巨噬细胞中糖皮质激素诱导的亮氨酸拉链和双特异性磷酸酶-1(DUSP1/MKP1)mRNA的表达(Fraser CC,未发表的数据).DUSP1诱导在一些系统中显示需要GR二聚[45],但在GR中没有观察到这一点暗淡小鼠巨噬细胞(46].总之,这些数据表明,转录激活可向组合的抗炎活性的重要贡献。
泼尼松龙和潘生丁的联合应用在急性和慢性炎症模型中均具有抗炎活性在活的有机体内。低剂量泼尼松龙和双嘧达莫有最小的影响作为单一药剂,但该组合能够抑制血清TNF-α在LPS攻击模型,并在迟发型超敏反应模型耳肿胀(图2).这些数据表明,二嘧胺的分子效应可以扩增三个和十倍之间的低剂量泼尼松龙的抗炎活性在活的有机体内。低剂量泼尼松龙来抑制病情活动性关节炎慢性模型的能力也被放大潘生丁。用于组合的关节炎得分减少为2.1单位(4.9低剂量泼尼松龙和2.8的组合),或一个半还原低剂量(0.3毫克/千克)和高剂量之间观察到(3毫克/ kg)的泼尼松龙(4.9 - 0.7 = 4.2Hz)。这些结果表明,扩增可以在的范围内五倍的关节炎模型中,假设一个线性剂量响应(图3.).泼尼松龙和双吡酰胺还结合以抑制佐剂诱导的关节炎模型中炎症的组织学标志物。有趣的是,组合的效果最明显在肺脉搏接头中,观察到炎症的组织学标志物和骨骼和软骨变性的临床相关抑制(见附加数据文件中的图S21).然而,该模型需要更高剂量的双嘧达莫(300 mg/kg),也显示出显著的活性。这种组合的组织保留效应可能源于巨噬细胞对促炎介质的有效抑制(Fraser CC,未发表的数据)。在这些动物模型中观察到的联合活性表明,双嘧达莫的分子效应可以放大极低剂量泼尼松龙的亚治疗性抗炎活性,从而产生疾病修饰作用。
双嘧达莫未发现扩增重复每日给药的严格条件下泼尼松龙的糖皮质激素引起的毒性的标志物的影响在活的有机体内。导致高血糖血症的葡糖生成增加是慢性糖皮质激素治疗的常见副作用[2].泼尼松龙和双嘧达莫的糖异生电位通过测量从用所述组合或其组件处理的大鼠上通过肝组织的RT-PCR分析的经典转录激活目标TAT的作用进行评价。低剂量泼尼松龙的影响不是通过同时给药300毫克/公斤的双嘧达莫改变(图4),提示泼尼松龙对肝细胞的作用没有增强。这一结果表明,阳性gres介导的糖皮质激素不良反应,包括高血糖,可能不会被双嘧达莫同时治疗放大。肾上腺机能不全是慢性糖皮质激素治疗的另一常见不良反应[8.,这是由于系统复杂的负反馈控制造成的。强的松龙剂量依赖性地降低了血清皮质酮,双嘧达莫并没有进一步抑制低剂量强的松龙的作用(图)4 b)这一结果表明,在泼尼松龙和潘生丁之间观察到的抗炎协同作用并没有延伸到HPA轴的不良抑制。本研究还监测了胸腺和肾上腺重量,发现高剂量类固醇在每日一次给药10天后可降低这些器官重量。无显著效果对于单独或组合的成分剂量,观察到与溶媒对照相关的ECT。
潘生丁做了骨退化的标志物不能扩增泼尼松龙诱导效应在活的有机体内。骨质疏松症是慢性治疗与糖皮质激素的常见不利影响,脊柱和臀部的骨损失估计每年1.5%,每日剂量为9毫克泼尼松龙或等同物[2]双嘧达莫作为单一药物没有表现出任何作用,也没有改变强的松对骨钙素或股骨中段骨密度的剂量反应,表明这些标记物缺乏联合作用(图1)5.),治疗8周。本研究中双嘧达莫的剂量为37.5 mg/kg,每日2次,是在CIA大鼠总剂量150mg /kg的基础上异速测定的,发现双嘧达莫能增强低剂量泼尼松龙的抗炎活性。骨钙素是骨形成的一种标记物,已知它被糖皮质激素抑制,这是由启动子中负的GRE引起的[47].这些数据表明,双嘧达莫不能放大低剂量糖皮质激素治疗的dna结合依赖(gres介导的)跨抑制效应。这项小鼠研究的结果表明,双嘧达莫的免疫选择作用可能不会放大与极低剂量泼尼松龙相关的骨质疏松效应和骨折风险[48]在临床环境中具有长期给药。
为了进一步探索该组合的HPA轴效应,双嘧达莫的个体效应在AtT20促肾上腺皮质激素细胞的独特信号网络中进行了表征。双嘧达莫治疗显示抑制PDE活性(PDE-2、-4、-10和-11)并增加cAMP水平[49那50].与单独CRF刺激相比,双嘧达莫处理AtT-20细胞可使cAMP适度增加1.5倍,但其效果不如强效PDE-4抑制剂罗利普兰的3倍增加(图)6).增加的cAMP先前显示出增加的AtT20细胞ACTH分泌[51,而双嘧达莫治疗可引起crf依赖性促肾上腺皮质激素分泌的少量但显著增加(图)6 b),这可能是由于增加的cAMP。有趣的是,双嘧达莫不增加cAMP在小鼠骨髓衍生的巨噬细胞(弗雷泽CC,未发表的数据),与细胞的AtT20的促肾上腺皮质激素相比网络表明双嘧达莫在免疫细胞网络上下文的差分的作用。激活GR还已知的是激活的负GRE和拮抗的cAMP的诱导的转录因子的作用,抑制POMC表达[52].我们观察到强的松龙剂量依赖性地降低了at20细胞的POMC表达和ACTH分泌体外,这反应是通过加入双嘧达莫的未受影响(图6C,D).这些实验表明,泼尼松龙和二吡酰胺在皮质萎缩细胞中的穴位表达或acth分泌物之间缺乏协同作用,与人类PBMC,小鼠巨噬细胞和大鼠关节炎模型中的组合的协同抗炎活性不同。对组合治疗的差异响应可能是由于细胞网络上下文的差异,包括分子靶标的表达水平和/或空间关系,相关信号途径的激活状态和转录因子表达或激活的细胞类型特异性差异。定义负责介导免疫细胞网络组合的选择性的目标集合,这些目标在替代细胞背景上是正在进行的研究的重点。
考虑到GR系统的极端复杂性,迄今为止,SEGRAs和选择性GR调制器的成功令人印象深刻。SEGRAs已被证实能有效抑制刺激性皮炎[10那11那13],角叉菜胶诱导的和佐剂诱导的关节炎[12,以及中央情报局[15]例如,解离配体ZK 216348在剂量高达30 mg/kg时禁食6小时后,禁食大鼠的血糖没有增加,而泼尼松龙在剂量为10 mg/kg时的血糖增加约60%[13].通过ZK 216348的急性剂量来微小地增加这些大鼠的TAT活性,而Prednisolone以10mg / kg的等同剂量的血上六倍增加[13].类似地,解离的GR配体LGD5552比抑制4周的研究中抑制骨形成速率的泼尼松龙(Prednisolone)的脂肪醇少的效力较小。15].不幸的是,在GR信令网络的复杂性,其控制转录抑制和活化,和活化的GR的转录后影响,使人们非常具有挑战性的开发保留天然配体的期望的活动,同时有选择地消除不需要的低分子量化合物效果。
的抗炎作用和肾上腺皮质功能不全离解一直是游离GR配体的方法特别有问题。从肾上腺糖皮质激素释放是由GR的两个DNA结合依赖性和非依赖性(transrepressive)的影响[调节53].这可能是因为所有解离的GR配体具有等同于糖皮质激素transrepressive效果会显示某种程度的对HPA轴不期望的影响。例如,大鼠ZK 216348的急性皮下处理导致抑制ACTH与效力相当于泼尼松龙[13].事实上,GR的糖皮质激素活性和安全性研究暗淡小鼠表明,未激活GR的所有抗炎作用被保持在不存在二聚化,也不都是糖皮质激素诱导的不良影响消除[54].在大鼠重复给药研究中,未发现双嘧达莫能增强低剂量泼尼松龙对皮质酮的抑制作用(图4 b),以及不改变为POMC的抑制和ACTH的促肾上腺皮质激素细胞系中的泼尼松龙剂量响应(图6C,D).这些结果表明,通过低剂量强的松龙和双嘧达莫的多靶点机制,细胞网络选择性放大糖皮质激素的活性,可能为解离糖皮质激素诱导的HPA轴抑制提供解决方案。
结论
药物发现行业越来越意识到需要解决疾病系统生物学的新疗法,而且存在一种新的趋势,即从单一药物、单一靶点的范式转向更侧重于途径或多靶点的药物发现方法[22那55-57].迄今为止,糖皮质激素解离的研究主要集中在调节GR二聚体或与共激活因子和共抑制因子的相互作用,以分离糖皮质激素的理想效应和不良效应。本文提出的系统生物学方法利用多靶点作用,在炎症细胞独特的网络环境中选择性地放大糖皮质激素的活性,而不是试图剖析GR生物学的各个方面。这种方法是有利的,因为组合的抗炎活性因此来自于天然糖皮质激素作用的放大,无论是转抑制或转激活。介导传统糖皮质激素不良反应的细胞网络不支持低剂量糖皮质激素效应的放大,因为节点或差异信号通路相互作用的缺失,导致选择性作用和治疗窗口的增加。联合药物的多靶点作用可能为实现细胞型特异性治疗效果提供了一般途径。
缩写
- acth:
-
肾上腺皮质激素
- CCL2:
-
单核细胞趋化蛋白-1
- CI:
-
组合索引
- 情报局:
-
胶原诱导的关节炎
- CRF:
-
促肾上腺皮质激素的释放因子
- CXCL2:
-
巨噬细胞炎性protein-2
- CXCL10:
-
干扰素γ诱导蛋白-10
- DNFB:
-
2,4-二硝氟苯苯.
- Dusp1:
-
dual-specificity phosphatase-1
- ELISA:
-
酶联免疫吸附试验
- FBS:
-
胎牛血清
- GR:
-
糖皮质激素受体
- GRE考试:
-
糖皮质激素反应元素
- HPA:
-
肾上腺皮质
- IL:
-
白细胞介素
- 有限合伙人:
-
脂多糖
- PBMC:
-
外周血单个核细胞
- PDE:
-
磷酸二酯酶
- POMC:
-
阿黑皮素原
- ra:
-
类风湿关节炎
- rt - pcr:
-
逆转录聚合酶链反应
- SEGRA:
-
选择性糖皮质激素受体激动剂
- 答:
-
酪氨酸转氨酶
- TNF:
-
肿瘤坏死因子。
参考文献
- 1.
Da Silva Ja,Jacobs JW,Bijlsma JW:重新审视低剂量糖皮质激素的毒性:风险和恐惧。Ann N Y ACAD SCI。2006,1069:275-288。10.1196 / angn.1351.026。
- 2.
Da Silva JA, Jacobs JW, Kirwan JR, Boers M, Saag KG, Ines LB, de Koning EJ, Buttgereit F, Cutolo M, Capell H, Rau R, Bijlsma JW:低剂量糖皮质激素治疗类风湿性关节炎的安全性:已发表的证据和前瞻性试验数据。《中国科学:地球科学》2006年第4期。10.1136 / ard.2005.038638。
- 3.
普拉特WB,托夫特DO:热休克蛋白和免疫亲和伴侣类固醇受体相互作用。Endocr 1997年修订版,18:306-360。10.1210 / er.18.3.306。
- 4.
Necela BM,Cidlowski JA:在非炎性和炎性细胞糖皮质激素受体的作用机制。proc am thorac soc。2004年,1:239-246。10.1513 / pats.200402-005MS。
- 5.
Stellato C:糖皮质激素的转录后和非基因组效应。中国海洋大学学报(自然科学版),2004,1:255-263。10.1513 / pats.200402 - 015 ms。
- 6.
Tuckermann JP, Reichardt HM, Arribas R, Richter KH, Schütz G, Angel P:糖皮质激素受体的DNA结合独立功能介导了皮肤中ap -1依赖基因的抑制。中国生物医学工程学报,1999,13(4):497 - 503。10.1083 / jcb.147.7.1365。
- 7.
Reichardt HM,Tuckermann JP,GöttlicherM,Vujic M,Weih F,Angel P,Herrlich P,Schützg:糖皮质激素受体没有DNA结合的抑制症抑制炎症反应。Embo J. 2001,20:7168-7173。10.1093 / EMBOJ / 20.24.7168。
- 8.
Schäcke H,Docke WD,Asadullah K:糖皮质激素副作用的相关机制,《药理学治疗》,2002,96:23-43.10.1016/S0163-7258(02)00297-8。
- 9。
多斯特A,海因泽尔T:糖皮质激素受体负反应元件及其在糖皮质激素作用中的作用,《当代药学》2004,10:2807-2816.10.2174/1381612043383601。
- 10.
VayssièreBM,杜邦S,Choquart A,珀蒂楼加西亚T,Marchandeau C,格罗内迈尔H,Resche-Rigon L:合成的糖皮质激素,其在体内解离反式激活和AP-1的反式阻抑表现出抗炎活性。mol内分泌。1997年,11:1245年至1255年。10.1210 / me.11.9.1245。
- 11.
Belvisi MG, Wicks SL, Battram CH, Bottoms SE, Redford JE, Woodman P, Brown TJ, Webber SE, Foster ML:游离糖皮质激素的治疗益处和体外分离转抑制与转激活活性的相关性。中国生物医学工程杂志。
- 12.
Coghlan MJ,Jacobson PB,Lane B,Nakane M,Lin CW,Elmore SW,Kym PR,Luly JR,Carter GW,Turner R,Tyree CM,Hu J,Elgort M,Rosen J,Miner JN:一种新型抗炎药,在降低副作用的同时维持糖皮质激素疗效。摩尔内分泌。2003,17:860-869。10.1210/me.2002-0355。
- 13.
SchäckeH,Schottelius A,Docke WD,Strehlke P,Jaroch S,Schmees N,Rehwinkel H,Hennekes H,阿萨杜拉K:通过选择性的糖皮质激素受体激动剂导致的副作用的治疗效果的分离从式阻抑反式激活的解离。Proc Natl Acad Sci USA。2004年,101:227-232。10.1073 / pnas.0300372101。
- 14.
De Bosscher K,Berghe Vanden W,Beck Im,Van Molle W,Hennuyer N,Hapgood J,Libert C,Staels B,Louw A,Haegeman G:一种完全解除的炎症基因抑制的植物来源化合物。Proc Natl Acad Sci USA。2005,102:15827-15832。10.1073 / pnas.05055554102。
- 15.
Miner JN、Ardecky B、Benbatoul K、Griffiths K、Larson CJ、Mais DE、Marschke K、Rosen J、Vajda E、Zhi L、Negro Vilar A:具有减少副作用的抗炎性糖皮质激素受体配体表现出蛋白质-蛋白质相互作用谱的改变。美国科学院刊2007,104:19244-19249。10.1073/pnas.0705517104。
- 16.
Lim LH,Pervaiz S:Annexin 1:旧分子的新面孔。FASEB J. 2007,21:968-975。10.1096 / FJ.06-7464REV。
- 17.
科恩Berrebi将D, Bruscoli年代,N, Foussat, Migliorati G, Bouchet-Delbos L,紧身衣MC,口感,Couderc J, Galanaud P, Peuchmaur M, Riccardi C,艾米莉D:合成激素性亮氨酸拉链(GILZ)巨噬细胞:糖皮质激素的抗炎和免疫抑制机制共享和il - 10。血液。2003,101:729-738。10.1182 / - 2002 - 02 - 0538血。
- 18.
糖皮质激素诱导蛋白GILZ对AP-1的抑制。中国生物化学杂志。2001,27(6):593 - 598。10.1074 / jbc.M101522200。
- 19.
以实FT,方X,Galdiero MR,阿塔索伊U,Rigby的WF,Gorospe男,奇德尔C,Stellato C:在糖皮质激素介导的基因调控的RNA结合蛋白tristetraprolin中的作用。J免疫酚。2008年,180:8342-8353。
- 20
Tuckermann JP,Kleiman A,Moriggl R,Spanbroek R,Neumann A,Illing A,Clausen,Stride B,Forster I,Habenicht Aj,Reichardt HM,Tronche F,Schmid W,Schützg:巨噬细胞和中性粒细胞是免疫的目标糖皮质激素在接触过敏中抑制。J Clin Invest。2007,117:1381-1390。10.1172 / JCI28034。
- 21
分离转抑制和转激活:糖皮质激素受体的痛苦离婚?中国药理学报,2003,22(4):421 - 427。10.1124 / mol.107.038794。
- 22.
Keith CT, Borisy AA, Stockwell BR:网络系统的多组分疗法。药物研究,2005,4:71-78。10.1038 / nrd1609。
- 23.
Zimmermann GR, Lehár J, Keith CT:多靶点疗法:整体大于部分之和。《今日药物发现》,2007,12:34-42。10.1016 / j.drudis.2006.11.008。
- 24.
Kim Hh,Liao JK:双层唑烷的翻译治疗剂。动脉克隆血栓血栓。2008,28:S39-S42。10.1161 / ATVBAHA.107.160226。
- 25.
Weyrich AS, Denis MM, Kuhlmann-Eyre JR, Spencer ED, Dixon DA, Marathe GK, McIntyre TM, Zimmerman GA, Prescott SM:双嘧达莫选择性抑制血小板-单核细胞聚集的炎症基因表达。《中国科学:地球科学》2005年第4期。cir.0000154607.90506.45 10.1161/01.。
- 26.
Borisy AA,Elliott PJ,Hurst NW,Lee Ms,LehárJ,价格er,Serbedzija G,Zimmermann Gr,Foley Ma,Stockwell Br,Keith CT:系统发现多组分治疗。Proc Natl Acad Sci USA。2003,100:7977-7982。10.1073 / PNA.133708100。
- 27.
姚TC,郭ML,见LC,欧LS,李WI,陈CK,黄JL:RANTES和患者幼年类风湿性关节炎疾病活动的敏感指标单核细胞趋化蛋白1:六年的纵向研究。关节炎Rheum。2006年,54:2585年至2593年。10.1002 / art.21962。
- 28.
Stanczyk J, Kowalski ML, Grzegorczyk J, Szkudlinska B, Jarzebska M, Marciniak M, Synder M:类风湿关节炎和骨关节炎患者滑膜液中RANTES和趋化活性。炎症介质。2005,2005:343-348。10.1155 / MI.2005.343。
- 29.
PEAKE NJ,福斯特·赫卡,Khawaja K,Cawston Te,Rowan AD:使用定量蛋白质底物酶谱评估幼年特发性关节炎患者肠果酶活性的临床意义。ann Rheum dis。2006,65:501-507。10.1136 / ard.2005.039032。
- 30.
炎症滑膜液中钙依赖性基质金属蛋白酶-2和-9的自动激活谱:焦磷酸盐和二磷酸盐的影响Acta photonica sinica, 2005, 358: 182-191。10.1016 / j.cccn.2005.03.012。
- 31。
Nishimoto N, Hashimoto J, Miyasaka N, Yamamoto K, Kawai S, Takeuchi T, Murata N, Heijde van der D, Kishimoto T: IL-6抑制剂(SAMURAI)用于类风湿性关节炎的主动控制单药治疗的研究:tocilizumab x线随机对照试验的临床和影像学获益证据。王志强,王志强。10.1136 / ard.2006.068064。
- 32
Hafstrom I,Rohani M,Deneberg S,Wornert M,Jogestrand T,Frostegard J:小剂量泼尼松龙对类风湿性关节炎患者内皮功能、动脉粥样硬化和动脉粥样硬化传统危险因素的影响:一项随机研究。风湿杂志,2007,34:1810-1816。
- 33
锄头约,雅各布斯JW,波尔人M, Boumpas D, F Buttgereit, Caeyers N,白菜呃,Cutolo M Da Silva是的,Esselens G, Guillevin L, Hafstrom我科文JR Rovensky J,罗素,Saag公斤,Svensson B, Westhovens R, Zeidler H, Bijlsma JW:欧拉以证据为基础的建议的管理系统性糖皮质激素治疗风湿性疾病。《中国科学院院刊》2007年第4期。10.1136 / ard.2007.072157。
- 34.
Kvien TK, Fjeld E, Slatkowsky-Christensen B, Nichols M, Zhang Y, Proven A, Mikkelsen K, Palm O, Borisy AA, Lessem J:新型增效候选药物CRx-102在手部骨关节炎中的疗效和安全性。王志强,王志强。10.1136 / ard.2007.074401。
- 35.
Loewe S:药理学的定量问题[德语]。ergebn physiol。1928年,27:47-187。
- 36.
周TC,的Talalay,P:剂量 - 效应关系的定量分析:多种药物或酶抑制剂的联合作用。进阶酶雷古尔。1984年,22:27-55。10.1016 / 0065-2571(84)90007-4。
- 37.
Perretti男,邓肯GS,花RJ,对等体SH:血清皮质酮,白细胞介素-1和肿瘤坏死因子在大鼠实验内毒素血症:路易斯和Wistar菌株之间比较。BR J Pharmacol。1993年,110:868-874。
- 38.
2 .陈志强,陈志强,陈志强,等。特急医学杂志,1997,46:857-868。10.1084 / jem.146.3.857。
- 39.
Brahn E,孔雀DJ,Banquerigo ML:通过组合环孢菌素A和甲氨蝶呤治疗胶原诱导的关节炎的抑制。关节炎Rheum。1991年,34:1282-1288。10.1002 / art.1780341012。
- 40.
配第RE,约翰斯顿W,味好AQ,亨特DW,RootmanĴ,罗林DF:葡萄膜炎和关节炎由佐剂诱导的:临床,免疫学和组织学特征。j类rheumatol。1989,16:499-505。
- 41。
糖皮质激素对垂体衍生AtT-20细胞促肾上腺皮质激素释放因子1受体表达的调控。中国药理学杂志,1996,16(5):514 - 514。
- 42。
科万JR,BIJLSMA JW,布尔人男,乳木果BJ:对类风湿性关节炎影像上的进展糖皮质激素的影响。科克伦数据库SYST 2007年修订版,CD006356-
- 43。
研究发现腺苷受体激动剂抑制人单核细胞TNF的产生。生命科学。1993,52:1917-1924。10.1016 / 0024 - 3205 (93) 90632 - d。
- 44。
Chivers Je,Cambridge Lm,CaTley Mc,Mak Jc,Donnelly Le,Barnes PJ,Newton R:Ru486的差异效果显示出糖型抑制前列腺素释放的糖皮质激素抑制的不同机制。EUR J Biochem。2004,271:4042-4052。10.1111 / J.1432-1033.2004.04342.x。
- 45
Kassel O, Sancono A, Kratzschmar J, Kreft B, Stassen M, Cato AC:糖皮质激素通过增加mmp -1的表达和降低mmp -1的降解来抑制MAP激酶。中国科学(d辑),2001,20(4):457 - 461。10.1093 / emboj / 20.24.7108。
- 46.
亚伯拉罕SM,劳伦斯T,克莱曼A,看守P,Medghalchi男,TuckermannĴ,SaklatvalaĴ,克拉克AR:地塞米松的抗炎作用是部分地依赖于双重特异性的诱导磷酸酶1,实验医学杂志。2006年,203:1883年至1889年。10.1084 / jem.20060336。
- 47.
Meyer T, Carlstedt-Duke J, Starr DB:一个弱的TATA盒是糖皮质激素依赖抑制骨钙素基因的先决条件。中国生物医学工程学报,1996,13(4):513 - 514。10.1074 / jbc.272.49.30709。
- 48.
凡STA-A TP,Leufkens HG,Abenhaim L,张B,库珀C:口服皮质类固醇和骨折的风险的用途。J Bone Miner Res。2000年,15:993-1000。10.1359 / jbmr.2000.15.6.993。
- 49.
德尔AT,Beavo JA:环核苷酸磷酸:分子调控到临床使用。药理学2006年修订版,58:488-520。10.1124 / pr.58.3.5。
- 50
Lugnier C:环核苷酸磷酸二酯酶(PDE)超家族:开发特异性治疗药物的新靶点中国药理学报,2006,27(6):457 - 461。10.1016 / j.pharmthera.2005.07.003。
- 51.
LIMM MC,Shipston MJ,Antoni Fa:去极化抵消了糖皮质神经皮肤科细胞的糖皮质激素抑制。BR J Pharmacol。1998,124:1735-1743。10.1038 / sj.bjp.0702024。
- 52.
马氏C,比洛S,马伊拉男,高塞尔Y,德劳Y:蛋白质 - 蛋白质相互作用和NGFI-B / Nur77亚科孤儿核受体和糖皮质激素受体之间的转录的拮抗作用。mol内分泌。2005年,19:885-897。10.1210 / me.2004-0333。
- 53。
Reichardt HM, Schütz G:糖皮质激素信号——一个共同主题的多种变体。中国生物医学工程学报,1998,22(1):1-6。10.1016 / s0303 - 7207(98) 00208 - 1。
- 54。
克莱曼A,JP Tuckermann:从条件性敲除小鼠的经验:在类固醇治疗的有益副作用糖皮质激素受体作用。分子细胞内分泌。2007年,275:98-108。10.1016 / j.mce.2007.05.009。
- 55。
菲什曼MC,波特JA:医药:药物发现的一个新的语法。自然。2005年,437:491-493。10.1038 / 437491a。
- 56。
Vogelstein B,Kinzler KW:癌症基因及其控制的途径。国家医学院,2004,10:789-799.10.1038/nm1087。
- 57
琼斯年代,张X,帕森斯DW,林JC,马克瑞RJ Angenendt P, Mankoo P,卡特H, Kamiyama H,港务局,香港SM,傅B,林太,卡尔霍恩,Kamiyama M,沃尔特·K Nikolskaya T, Nikolsky Y,哈J,史密斯博士,伊达尔戈M,浸出SD,克莱因美联社,贾菲EM,郭金M, Maitra, Iacobuzio-Donahue C, Eshleman JR Kern SE, Hruban RH,等:全球基因组分析揭示人类胰腺癌的核心信号通路。科学通报。2008,32(4):457 - 461。10.1126 / science.1164368。
确认
作者要感谢许多过去和现在的同事在CombinatoRx的贡献。特别是,努力ER的价格,C基思,J莱哈尔,J·尼科尔斯,男基冈,P埃利奥特,男斯拉夫,G诺兰,K·凯莱赫,J贡萨洛,Y王,d·克劳,J Luterman,J兰德尔和L贝尔德表示诚挚的谢意。
作者信息
隶属关系
通讯作者
额外的信息
利益争夺
作者受雇于CombinatoRx, Incorporated。
作者的贡献
GRZ,WA,ALF,MF,CCF和AAB设计的研究和实验。WA,ALF,和MF进行的实验。GRZ,WA,ALF,MF,CCF和AAB分析数据。GRZ写的稿子。
电子补充材料
13075_2008_2450_MOESM1_ESM.doc
附加文件1:含有图S1和S2 Word文件。图S1报告用佛波醇肉豆蔻酸乙酸酯(PMA),用于TNF-α释放的来自人PBMC的抑制的剂量 - 响应矩阵数据刺激/离子霉素通过泼尼松龙和双嘧达莫的组合。图S2示出了炎症组织学标志物通过在大鼠佐剂诱导的关节炎模型中的组合的抑制。(DOC 3 MB)
作者为图像提交的原始文件
权利和权限
关于这篇文章
引用这篇文章
齐默尔曼,g.r.,艾弗里,W.,菲内利,A.L.等通过组合药物的协同多目标作用选择性扩增糖皮质激素抗炎活性。关节炎Res其他11,R12(2009)。https://doi.org/10.1186/ar2602.
已收到:
修改后的:
公认:
发表:
关键词
- 泼尼松龙
- 糖皮质激素受体
- 双嘧达莫
- 其他数据文件
- 组合索引