摘要
背景
香港已发现与甲型流感H5N1亚型相关的致命人类呼吸道疾病,最近越南、泰国和柬埔寨也有记录。我们以前证明H5N1疾病患者的血清IP-10(干扰素- γ诱导蛋白-10)水平异常高。此外,与人流感病毒亚型H1N1相比,1997年的H5N1病毒(A/香港/483/97)(H5N1/97)是来自原代人巨噬细胞的促炎细胞因子(例如肿瘤坏死因子- A)和趋化因子(例如IP-10)的更有效的诱导剂体外,提示细胞因子失调可能在H5N1疾病的发病机制中发挥作用。由于呼吸道上皮细胞是流感病毒复制的主要靶细胞,因此研究H5N1病毒在这些细胞中的细胞因子诱导谱具有重要意义。
方法
采用定量RT-PCR和ELISA方法,比较H5N1病毒A/HK/483/97 (H5N1/97)、A/越南/1194/04和A/越南/3046/04(均为H5N1/04)与人H1N1病毒在人原代肺泡和支气管上皮细胞中诱导的细胞因子和趋化因子基因表达谱体外.
结果
我们证明,与人H1N1病毒相比,H5N1/97和H5N1/04病毒在人初级肺泡和支气管上皮细胞中是更有效的IP-10、干扰素- β、RANTES(调节激活、正常T细胞表达和分泌)和白细胞介素6 (IL-6)的诱导剂体外.最近来自越南的H5N1病毒(H5N1/04)似乎比H5N1/97病毒更能诱导IP-10。
结论
H5N1/97和H5N1/04亚型甲型流感病毒比H1N1亚型病毒更能诱导原代人呼吸道上皮细胞的促炎细胞因子和趋化因子。我们认为这种细胞因子的超诱导可能与人类H5N1疾病的发病机制有关。
背景
流感大流行起因于禽流感病毒与人流感病毒之间的基因重组,或禽流感病毒直接适应于有效的人传人[1].一九九七年由家禽传染给人类的甲型H5N1亚型禽流感(H5N1/97),导致致命的人类呼吸道疾病[2,3.].随后中国人体H5N1病的再出现[4)、越南(5]、泰国及柬埔寨[6引发了新一轮流感大流行的恐慌。虽然H5N1亚型流感病毒的人际传播迄今似乎没有效果,但在受影响的人群中,该疾病的严重程度异常,报告的死亡率从1997年香港的33%到2004年泰国和越南的55%不等。人类疾病如此严重的原因尚不清楚。
虽然呼吸道传播外人类H5N1病并没有表现出在1997年和2003年[4,7],有一些证据表明,最近的H5N1病毒可能会偶尔散发到多个器官造成不寻常的疾病表现,如脑膜脑炎[8].然而,大多数患者的H5N1疾病的有原发性病毒性肺炎急性呼吸窘迫和多脏器功能障碍[证候复杂4- - - - - -7,9]与淋巴细胞和haemophagocytosis是显着的发现。急性呼吸窘迫和多器官功能障碍以及haemophagocytosis的综合征先前已经与细胞因子失调相关[10,11].
血液单核细胞来源的小鼠及人感染流感病毒[12,13]巨噬细胞和猪肺泡巨噬细胞[14已经被证明能诱导促炎细胞因子。此外,我们之前已经证明,与人H1N1和H3N2流感病毒相比,h5n1 /97样病毒感染导致人原代巨噬细胞培养中促炎细胞因子的超诱导体外[12].我们还报告H5N1疾病患者血清中趋化因子IP-10(干扰素- γ诱导蛋白10)和MIG(干扰素γ诱导的单因子)浓度异常高[4].因此,我们已经假设这种细胞因子和趋化因子的这种差异超诱导可能导致人H5N1疾病的不寻常严重程度[4,12].
虽然巨噬细胞是免疫系统的关键前哨细胞,并允许流感病毒复制,但病毒的主要靶细胞是呼吸道上皮细胞[15].在实验感染H5N1/97病毒的灵长类动物中,发现I型和II型肺细胞和肺泡巨噬细胞含有病毒抗原[16].患有致命H5N1疾病的患者的肺部还在肺泡肺细胞病毒感染[17].人肺泡上皮细胞是肺功能的维护和肺部空气血屏障至关重要。另外,人呼吸道上皮细胞通过安装细胞因子应答,有助于两者的先天和适应性宿主防御[响应病毒感染18].此外,II型肺细胞表达II类主要组织相容性复合体(MHC)分子在活的有机体内[19].II类MHC的表达通常局限于免疫系统的特化细胞,其作用是将外源抗原呈递给辅助T细胞[20.,21].这些分子在肺泡上皮细胞上的表达可能与适应性免疫反应有关。因此,研究包括H5N1病毒在内的流感病毒感染上皮细胞诱导的细胞因子应答具有重要意义。
人类甲型流感病毒以前曾有过诱导白细胞介素6 (IL-6)、白细胞介素8 (IL-8)和RANTES(激活、正常T细胞表达和分泌调节)的报道。体外从转化的支气管上皮细胞系(NCI-H292) [18].然而,转化细胞系的研究结果的生理相关性尚不确定,原代肺泡上皮细胞培养可能是一个更相关的模型[22].在这里,我们比较了H5N1/97和H1N1病毒在人初级II型肺细胞和支气管上皮细胞中诱导的细胞因子谱体外目的:验证H5N1/97和H5N1/04病毒在呼吸道上皮细胞中差异诱导促炎细胞因子的假设。
材料和方法
病毒
流感病毒分离出一个致命的流感患者H5N1疾病于1997年在香港/香港/ 483/97 (H5N1/97),病毒H5N1疾病患者在越南2004年/越南/ 1194/04 /越南/ 3046/04(缩写为H5N1/04)和人类H1N1病毒/香港/ 54/98 (H1N1)进行了研究。病毒最初在Madin-Darby犬肾(MDCK)细胞中分离。采用限制性稀释法克隆,并在MDCK细胞中制备种子病毒储备。采用组织培养感染剂量50% (TCID)滴定法测定病毒感染性50)在MDCK细胞。在这项研究中所使用的H5N1流感病毒在BL3生物防护设施进行了处理。
细胞
原代人支气管上皮细胞(NHBE)取自Cambrex Bio Science (Walkersville, Inc., Maryland, USA)。NHBE细胞按供应商说明在无血清和激素补充的支气管上皮生长培养基(BEGM)中生长,其中添加13 g/l牛垂体提取物,0.5 g/l氢化可的松,0.5 mg/l人重组表皮生长因子,0.5 g/l肾上腺素,10 g/l转铁蛋白,5 g/l胰岛素,0.1 mg/l维甲酸,6.5 mg/l 3,3',5-三碘- l -thryonine, 50 g/l庆大霉素,50 mg/l两性霉素B (Cambrex Bio Science, Walkersville, Inc., Maryland, USA)。从播种后的第一天开始,每天更换培养基。细胞在大约9至10天内达到融合,用胰蛋白酶/EDTA (Cambrex)按1:5的比例传代。实验是在第3到4代的同一批细胞上进行的。细胞在湿润的环境中培养(5% CO2, 37°C)。
原发性人肺泡上皮细胞(II型肺细胞)从13名患者获得的人非肿瘤肺组织中分离出来(平均65岁,46-77 YR],10名男性和3名女性)在格兰特汉医院进行肺切除,香港。该研究议定书由香港及医院管理局大学伦理委员会批准。使用先前描述的方法的修饰分离了人类II型肺细胞[19,23].简单地说,在去除可见支气管后,用组织切割器将肺组织切成0.5 mm厚的>块,用平衡盐溶液(BSS, 137 mm NaCl, 5 mm KCl, 0.7 mm Na)清洗2HPO4,10 mm Hepes,5.5mm葡萄糖,pH7.4)在37℃下30分钟,三次部分去除巨噬细胞和血细胞。使用胰蛋白酶(0.5%,Gibco Brl,Gaithersburg,MD,USA)和Elastase(2个单元/ ml,Worthington生物化学公司,Lakewood,NJ,USA)的组合物消化了组织两次在37°C中持续15分钟摇动水浴。在DMEM / F12培养基和DNase I(350单位/ mL)(Gibco Brl,Gaithersburg,MD,USA)中,将部分消化的组织切碎于40%胎牛血清(FBS)中(350单位/ mL)和通过反复移液分散的细胞丛细胞悬浮液10分钟。过滤通过纱布和40μm细胞滤过者以确保单细胞悬浮液,将细胞与DMEM / F12培养基和小型气道生长培养基的1:1混合物一起温育(Sagm,Cambrex Bio Science Walkersville,Inc.,Maryland,美国)含有5%FBS和350单位/ ml DNase I,在潮湿的培养箱中的组织培养物处理的塑料培养皿(5%CO2让巨噬细胞附着在塑料表面2小时。非贴壁细胞按不连续的Percoll密度梯度(密度1.089和1.040 g/ml)分层,25 × g离心20 min。收集两种梯度界面的细胞层,用BSS洗涤4次,去除Percoll。为了去除剩余的肺泡巨噬细胞,将细胞悬液与涂有抗cd -14抗体的磁珠在室温恒定混合下孵育20分钟。用磁体去除小球并通过台台蓝排除评估细胞活力后,将纯化的II型肺细胞悬液悬浮在添加了1%胎牛血清、100单位/ml青霉素和100 μg/ml链霉素的SAGM中,并以细胞密度为300000细胞/cm的培养基上2.将细胞保持在潮湿的气氛中(5%CO2在液体覆盖的条件下,从电镀60小时开始,每天更换培养基。
人II型肺的表征
碱性磷酸酶染色
通过碱性磷酸酶染色鉴定人II型肺细胞。新鲜分离的细胞在玻片上纺丝,风干,室温染色20分钟。将10 mg萘酚AS二磷酸(Sigma)溶于40 μl DMSO中,稀释到10 ml含有10 mg耐蚀红(Sigma)的0.125 M 2-氨基-2-甲基丙醇缓冲液(pH 8.9, Sigma)中。载玻片用1%亚甲基绿(Sigma)洗涤并复染30秒,并安装在水介质中[19].
透射电子显微镜法
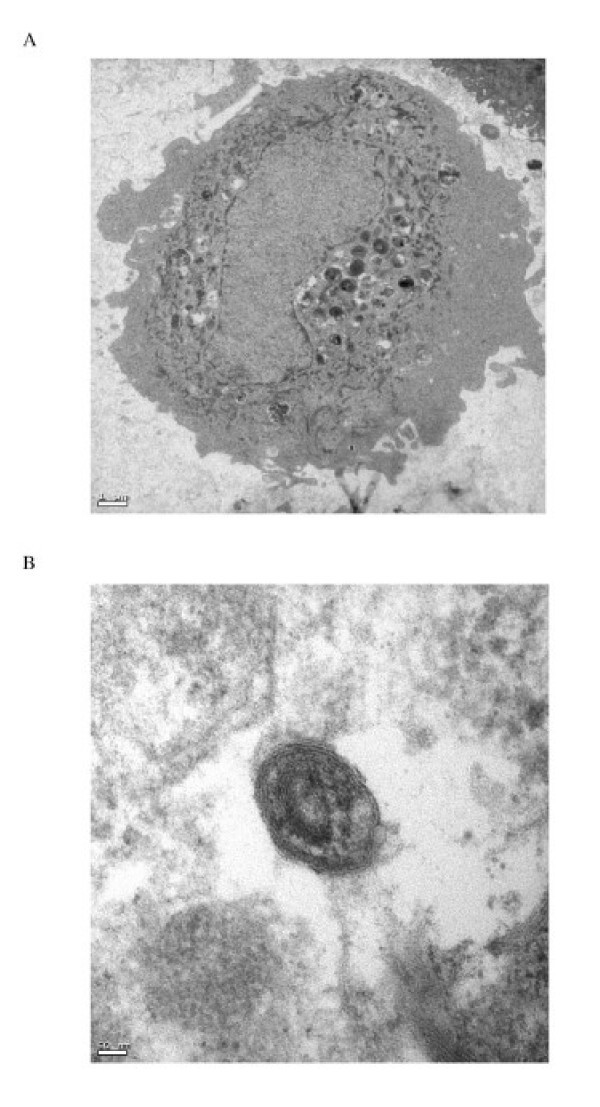
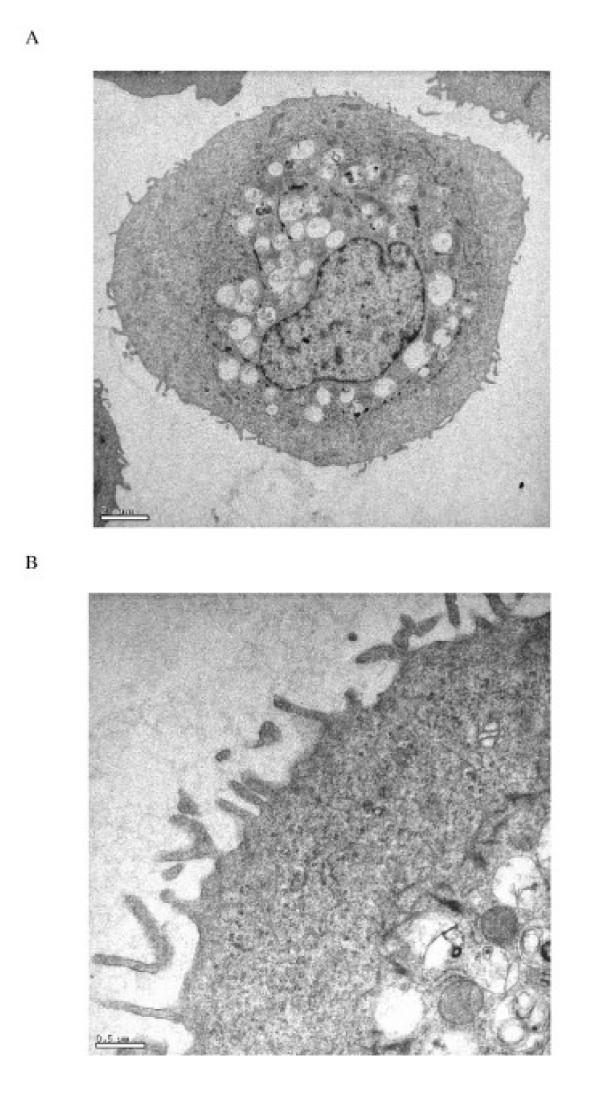
细胞在2%戊二醛中固定(电镜科学,华盛顿,PA,美国),在磷酸盐缓冲盐水中洗涤三次,在丙酮中连续脱水。组织在1%四氧化锇后固定,并嵌入Araldite树脂(Polysciences, Inc., Washington, PS, USA)。用金刚石刀(Reichert Ultracut S, Leica Aktiengesellscharft, Wien, Australia)切割半薄切片(1 μm),甲磺蓝染色进行光镜检查。将安装在铜网格上的超薄切片(80 nm)与醋酸铀酰(1.5小时,30°C,电子显微镜科学)和柠檬酸铅(40分钟,20°C,电子显微镜科学,华盛顿,PA,美国)进行电子对比,并使用透射电子显微镜(EM 208S, FEI公司,Hillsboro, Oregon, USA)进行检查。
流式细胞仪
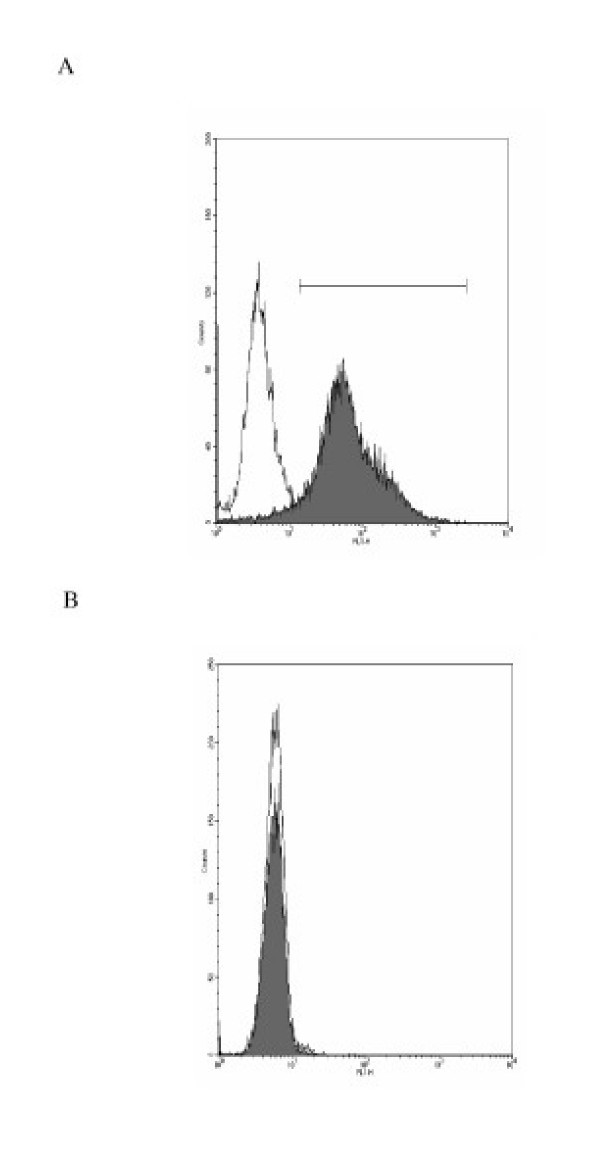
用最优稀释兔抗人表面活性剂蛋白C (SP-C)单克隆抗体(24°C, 30分钟)对纯化的II型肺细胞进行染色,然后用异硫氰酸荧光素(fitc标记山羊抗小鼠IgG抗体;Sigma, F-0257, 24°C, 30分钟)。每个细胞制剂也用单核细胞/巨噬细胞表面抗原特异性抗体(CD14与FITC结合,MCA2185F;Serotec。英国牛津大学)。流式细胞术(FACSSCalibur;Becton Dickinson),通过测量530 nm发出的绿光(FL1通道)检测fitc染色细胞。测定表达上皮细胞和巨噬细胞标记物的细胞百分比。
II型肺细胞和支气管上皮细胞的流感病毒感染
人II型肺细胞和支气管上皮细胞(接种于1 × 106在24孔组织培养板上每孔的细胞),除非另有说明,否则感染的多重性(MOI)为2。吸附病毒60 min后,取去病毒接种物,用温培养基(II型肺细胞用SAGM,支气管上皮细胞用BEBM)洗涤细胞,置于添加0.6 mg/L青霉素、60 mg/L链霉素、2 mg/L n -对甲苯-L-苯丙氨酸氯甲基酮处理胰蛋白酶(Sigma,圣路易斯,MO, USA)。收集等量的培养上清液,在-80℃冷冻,用于随后的病毒滴定和细胞因子分析。上清液在MDCK细胞上滴定,病毒滴度为对数10TCID50/毫升。从细胞中提取RNA,用于细胞因子基因表达分析。感染10小时后,固定复制细胞单层,采用流感病毒核蛋白特异性免疫荧光染色(DAKO Imagen, DAKO Diagnostics Ltd, Ely, UK)分析,以确定感染细胞的比例。
通过实时定量RT-PCR定量细胞因子mRNA
用RNeasy Mini试剂盒(Qiagen, Hilden, Germany)分离dnase处理的总RNA。用poly(dT)引物和Superscript II逆转录酶(Life Technologies, Rockville, MD, USA)从mRNA中合成cDNA,并用LightCycler (Roche, Mannheim, Germany)进行实时荧光定量分析。real-time RT-PCR检测IP-10、干扰素- β、IL-6、RANTES和肿瘤坏死因子(TNF)的mRNA水平。用于实时定量细胞因子、病毒基质基因和管家基因产物γ-actin mRNA的寡核苷酸引物和方法已在前面描述[12,24].
细胞因子蛋白的ELISA定量分析
采用特异性ELISA法(R&D Systems, Minneapolis, MN, USA)测定人初级支气管和肺泡上皮细胞上清中IP-10、RANTES、白介素6和干扰素β蛋白的浓度。培养上清样品用紫外线(CL-100紫外线交联剂)照射15分钟,使任何感染性病毒失活,然后进行ELISA检测。之前的实验已经证实,使用的紫外光剂量对酶联免疫吸附测定的细胞因子浓度没有影响(数据未显示)。
统计分析
使用单向ANOVA比较定量细胞因子和趋化因子mRNA和蛋白表达谱,然后是Bonferroni多重比较试验。差异被认为是显着的p< 0.05。
结果
体外人类II型肺细胞感染
原发人II型肺细胞产率为3.5±0.9 × 106这表现在II型肺细胞特异性标记物的表面活性剂蛋白C(SP-C)的表达在92±5%的细胞纯度细胞/ g肺组织,缺乏单核细胞/巨噬细胞细胞表面抗原(CD14)(图的。1和1 b),并通过染色检测碱性磷酸酶活性。污染细胞主要为成纤维细胞,单核细胞/巨噬细胞少于2%。细胞存活率为91±7% (n = 13)。肺供体的年龄和性别差异对细胞分离产量和细胞培养性能没有明显影响。分离的细胞扩散形成融合的单层细胞,细胞核突出,周围有薄的细胞质延伸。通过薄片电子显微镜显示板层小体和微绒毛的存在,证实培养的细胞为人II型肺细胞(图)2).
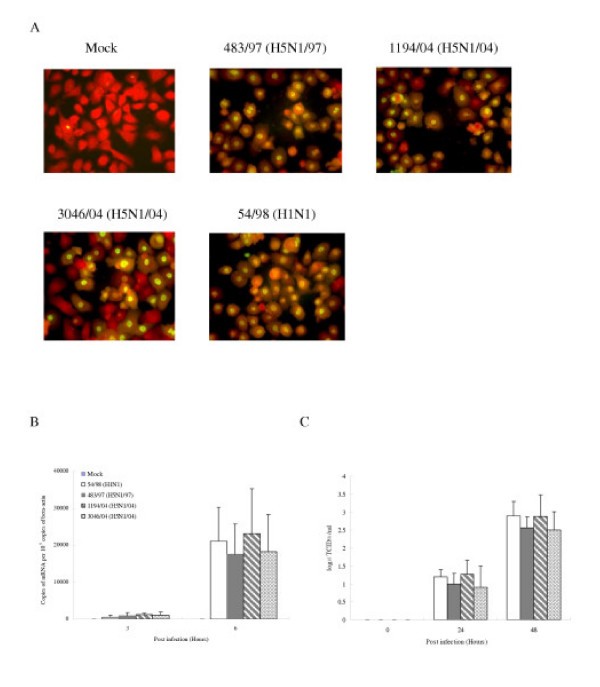
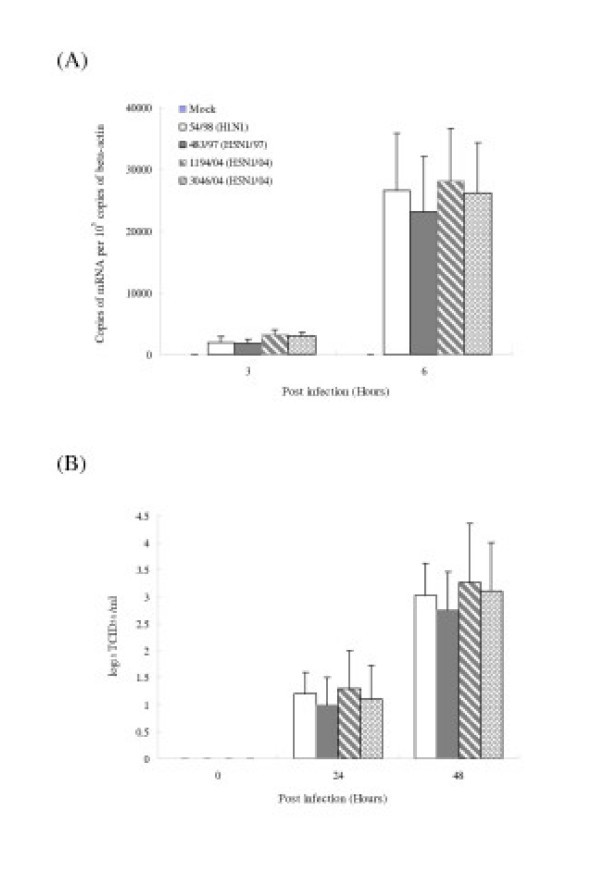
先前的研究表明,禽流感病毒可感染人呼吸道上皮细胞[25].我们首先想确定肺内组成部分的肺泡上皮细胞是否会被禽流感和人流感病毒感染体外.细胞感染了甲型流感亚型H5N1(483/97、1194/04和3046/04)和H1N1的莫伊(54/98)2和细胞表达甲型流感病毒蛋白质的比例进行了分析在感染后10小时immunofluorescent染色使用特定病毒抗体蛋白质(DAKO画像,DAKO诊断,伊利,英国)。类似比例(93-100%)的II型肺细胞感染H5N1和H1N1病毒有病毒抗原(核蛋白)的证据(图4).流感M-基因拷贝的感染在感染了H5N1和H1N1病毒的细胞后3小时和6小时的定量显示出相当的结果在3和6小时后的感染(图4 b).同样,感染后24小时和48小时,感染H5N1和H1N1病毒的肺泡上皮细胞的感染性病毒产量没有显著差异(图)4摄氏度).
II型肺细胞中促炎细胞因子和趋化因子的诱导
我们研究了在原代人Ⅱ型肺H1N1和H5N1病毒引起的细胞因子诱导的轮廓。具体来说,我们也想确定这两个病毒诱导的细胞因子的轮廓定性或定量不同。使用定量RT-PCR在3小时和6小时后的感染(表几种细胞因子和趋化因子的mRNA进行定量我).IP-10的mRNA水平,干扰素β,RANTES和IL-6显著由流感病毒时与模拟感染的细胞相比上调,对IP-10和干扰素β基因被最高度诱导。没有可检测的肿瘤坏死因子α诱导这些上皮细胞(数据未显示)。病毒由肺泡上皮细胞的感染前的紫外线照射的失活消除细胞因子诱导(数据未显示),这表明在需要细胞因子诱导该病毒的复制。
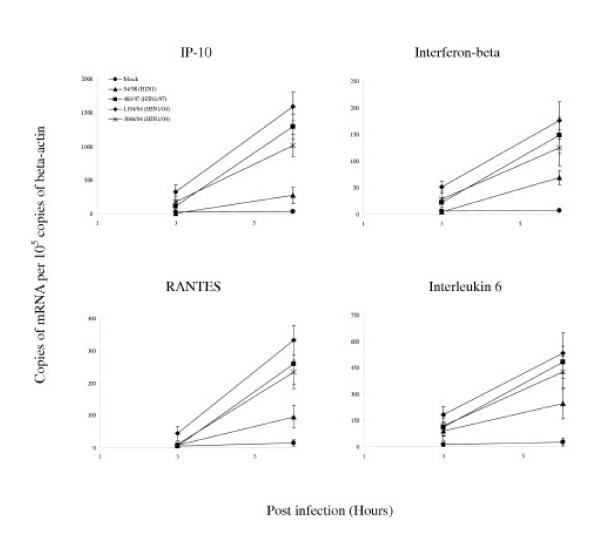
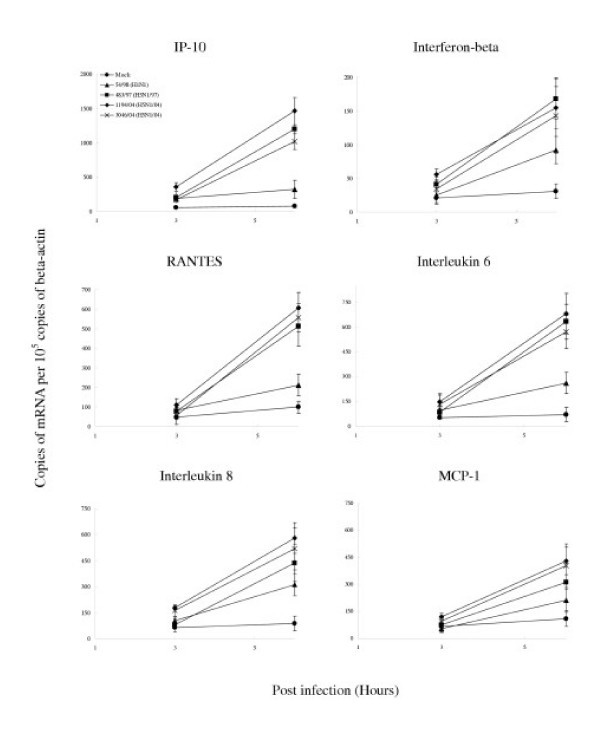
与人H1N1流感病毒相比,H5N1/97和H5N1/04病毒有差异地上调IP-10、干扰素- β、RANTES和IL-6的转录水平,显著提高(p<0.001)(图5).这些差异不能用病毒抗原免疫荧光显示的感染细胞比例的差异或病毒滴度的差异来解释(图)4).此外,54/98 (H1N1)病毒感染的多重性从2增加到10,并没有导致类似于H5N1/97和H5N1/04诱导的细胞因子mRNA浓度(数据未显示)。
总的来说,细胞因子基因转录有两种模式。从感染后3小时开始上调的细胞因子包括IP-10、干扰素- β和IL-6,而RANTES mRNA仅在感染后6小时上调(表)1).的细胞因子mRNA表达的数据是否用或不用正常化γ肌动蛋白mRNA的浓度进行分析的观察仍然有效。
原代人支气管上皮细胞的感染和细胞因子诱导谱
同样研究了由H1N1,H5N1 / 97和H5N1 / 04病毒诱导的细胞因子和趋化因子谱进行了初级人支气管上皮细胞病毒。通过薄截面电子显微镜确认作为人支气管上皮细胞的培养细胞的特性(图3.).总体基因表达分布型与用Ⅱ型肺看出。该M-基因转录拷贝数(图6)和传染性病毒产量(图6 b)从感染H5N1和H1N1病毒以2的MOI支气管上皮细胞是相当的。的H5N1 / 97和H5N1 / 04病毒的差异上调IP-10的转录,干扰素β,RANTES和IL-6至显著水平高于人H1N1病毒(pIP-10、RANTES、IL-6和p< 0.01的干扰素β)(图7).此外,两种H5N1/04病毒(1194/04和3046/04)差异上调单核细胞趋化蛋白1 (MCP-1)和IL-8的转录水平,显著高于人类H1N1和H5N1/97病毒(p< 0.05)。这些病毒都没有在这些细胞中诱导TNF。
定量RT-PCR检测流感病毒感染人支气管上皮细胞的细胞因子和趋化因子基因表达谱分别在感染H5N1/97、1194/04、3046/04 (H5N1/04和A/Hong Kong 54/98 (H1N1)流感病毒后3h和6h或模拟感染细胞中检测细胞因子和趋化因子mRNA的浓度。与H1N1感染细胞相比,H5N1/97和H5N1/04流感病毒在感染后6小时显著上调IP-10、RANTES和IL-6 (p < 0.001)和干扰素beta (p < 0.01) (Bonferroni多重比较试验)。H5N1/04病毒均显著上调MCP-1和IL-8水平,高于H1N1和H5N1/97感染细胞(p < 0.05, Bonferroni多重比较试验)。细胞因子和趋化因子mRNA的浓度与β-肌动蛋白mRNA的浓度归一化。显示了重复培养和测定的平均值和标准偏差。
从支气管和肺泡上皮细胞分泌细胞因子蛋白
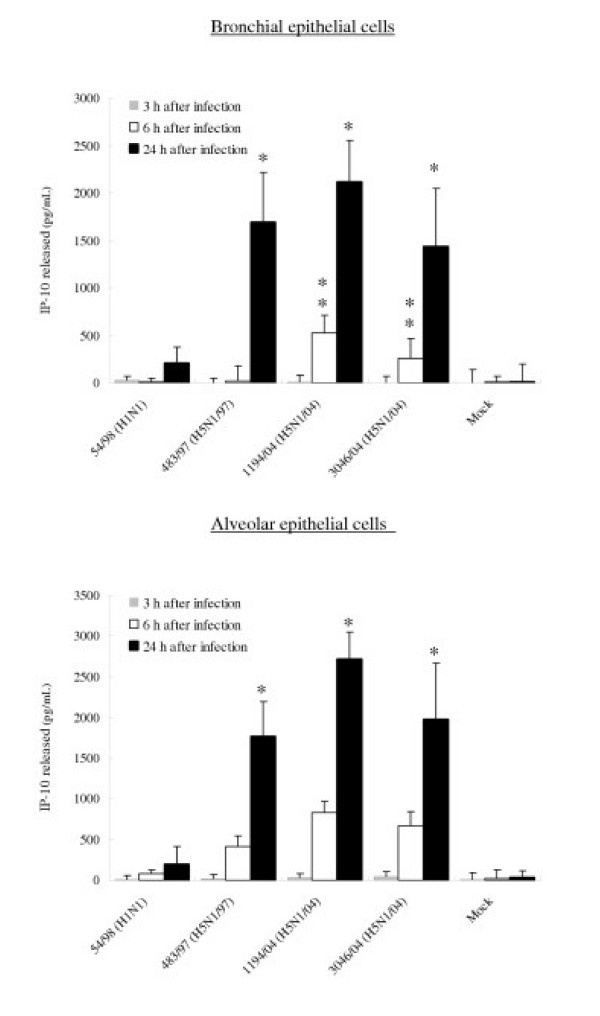
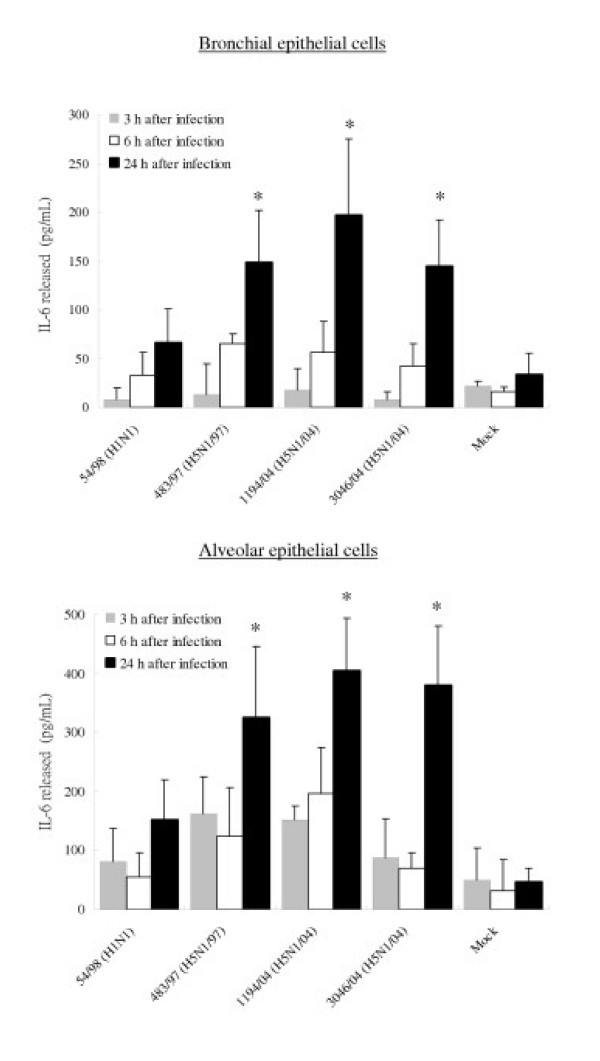
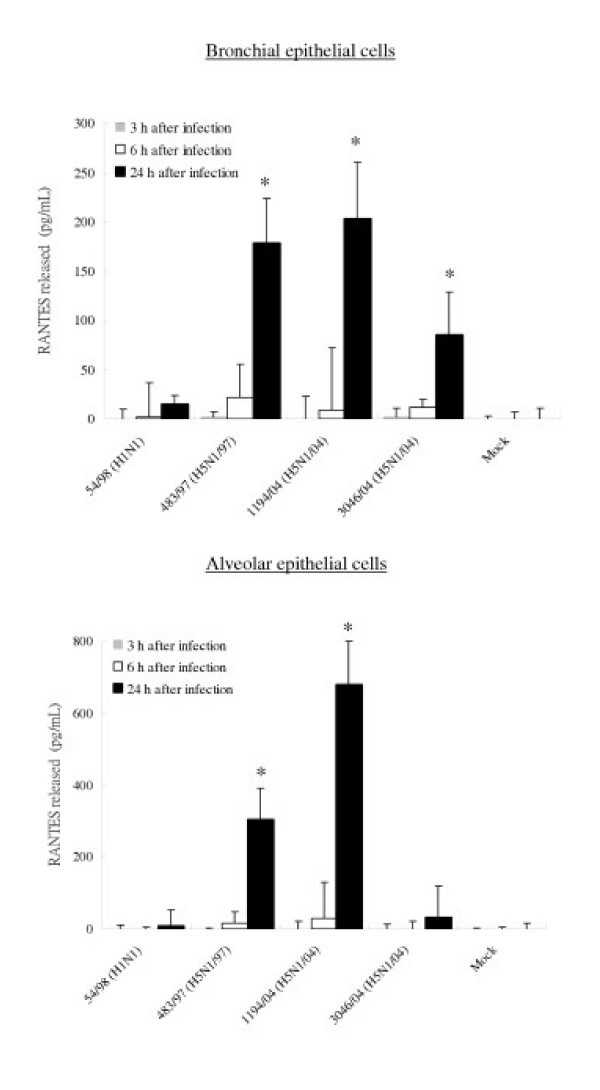
为了证实所观察到的mRNA的差异反映在细胞因子和趋化因子的分泌水平上,用ELISA法测定了感染的支气管和肺泡上皮细胞培养上清中IP-10、RANTES、白介素6和干扰素- β蛋白的浓度。感染所有三种H5N1病毒24小时后,支气管和肺泡上皮细胞分泌的IP-10和IL-6数量显著增加(p< 0.01)8和9).在感染24小时后,H5N1/97和H5N1/04病毒诱导的IP-10水平具有可比性。然而,在感染6小时后,最近的H5N1/04病毒1194/04和3046/04似乎比H5N1/97病毒更能诱导IP-10 (p< 0.05)(图8).H5N1/97和1194/04 (H5N1/04)诱导的支气管和肺泡上皮细胞分泌的RANTES蛋白明显高于H1N1病毒诱导的RANTES蛋白。虽然3046/04 (H5N1/04)感染细胞在感染6小时后的RANTES mRNA水平显著高于H1N1感染细胞,但这些细胞在感染24小时后分泌的RANTES蛋白仅增加4倍(p= 0.062;不显著(图)5和10).我们未能检测到流感病毒感染后支气管和肺泡上皮细胞上清分泌的任何干扰素- β蛋白(数据未显示),但应该注意的是,干扰素- β ELISA的检测限较高(250 pg/ml)。
由感染A/香港/483/97 (H5N1/97)、A/越南/1194/04、A/越南/3046/04(都是H5N1/04)和A/香港54/98 (H1N1)流感病毒或模拟感染细胞的原代人支气管和肺泡上皮细胞产生IP-10、白介素-6和RANTES。在感染H5N1和H1N1病毒后3 h、6 h和24 h收集流感病毒感染的人呼吸道上皮细胞培养上清,用ELISA检测IP-10(图8)、白细胞介素-6(图9)和RANTES(图10)。在感染后3 h和6 h检测IP-10、白细胞介素-6和RANTES mRNA水平(数据未显示),结果与图5和图7类似。支气管上皮细胞的结果代表三次独立实验的平均值和标准差(来自同一供体)。肺泡上皮细胞结果的平均值和标准差是基于六个独立供体的实验。*表示与mock相比p < 0.01, **表示与H5N1/97和H1N1感染细胞相比p < 0.05。
由感染A/香港/483/97 (H5N1/97)、A/越南/1194/04、A/越南/3046/04(都是H5N1/04)和A/香港54/98 (H1N1)流感病毒或模拟感染细胞的原代人支气管和肺泡上皮细胞产生IP-10、白介素-6和RANTES。在感染H5N1和H1N1病毒后3 h、6 h和24 h收集流感病毒感染的人呼吸道上皮细胞培养上清,用ELISA检测IP-10(图8)、白细胞介素-6(图9)和RANTES(图10)。在感染后3 h和6 h检测IP-10、白细胞介素-6和RANTES mRNA水平(数据未显示),结果与图5和图7类似。支气管上皮细胞的结果代表三次独立实验的平均值和标准差(来自同一供体)。肺泡上皮细胞结果的平均值和标准差是基于六个独立供体的实验。*表示与mock相比p < 0.01, **表示与H5N1/97和H1N1感染细胞相比p < 0.05。
由感染A/香港/483/97 (H5N1/97)、A/越南/1194/04、A/越南/3046/04(都是H5N1/04)和A/香港54/98 (H1N1)流感病毒或模拟感染细胞的原代人支气管和肺泡上皮细胞产生IP-10、白介素-6和RANTES。在感染H5N1和H1N1病毒后3 h、6 h和24 h收集流感病毒感染的人呼吸道上皮细胞培养上清,用ELISA检测IP-10(图8)、白细胞介素-6(图9)和RANTES(图10)。在感染后3 h和6 h检测IP-10、白细胞介素-6和RANTES mRNA水平(数据未显示),结果与图5和图7类似。支气管上皮细胞的结果代表三次独立实验的平均值和标准差(来自同一供体)。肺泡上皮细胞结果的平均值和标准差是基于六个独立供体的实验。*表示与mock相比p < 0.01, **表示与H5N1/97和H1N1感染细胞相比p < 0.05。
讨论
我们发现H5N1和H1N1病毒在两种原始人类肺泡中的复制效率相似(图)4)和支气管上皮细胞(图6).两种流感病毒亚型均诱导了IP-10、干扰素- β、RANTES和IL-6应答。细胞因子的诱导依赖于病毒的复制,因为紫外线灭活病毒没有诱导任何作用。有趣的是,我们发现H5N1/97和1194/04 (H5N1/04)病毒比人类H1N1病毒更能诱导IP-10、干扰素-beta、RANTES和IL-6 mRNA和蛋白(图)5,7,8来10).因此,观察到的mRNA差异反映在分泌的细胞因子和趋化因子蛋白水平(图8来10).3046/04 (H5N1/04)的结果与1194/04 (H5N1/04)大体相似,只是与H1N1病毒感染的细胞相比,II型肺细胞的RANTES蛋白水平没有显著升高(图)10)虽然mRNA水平(图5).在我们的实验中,尽管有明显的mRNA诱导,但我们无法检测到任何干扰素- β蛋白,这可能与干扰素- ELISA的敏感性有限有关。为此目的,可能需要一种更敏感的干扰素生物测定法。在这些实验中使用的II型肺细胞来自于总共13个捐献者,每组实验数据都是基于至少3个捐献者的独立实验的结果,因此排除了捐献者的特定伪影。支气管上皮细胞从商业来源和来自一个供体。然而,由于这些细胞的结果与II型肺细胞的结果大体一致,我们再次认为,供体特异性伪象不太可能解释我们获得的结果。最后,这些结果也可与我们之前对原始人类单核细胞来源的巨噬细胞的观察结果相比较[12除了与巨噬细胞形成对比的情况下,没有通过任何测试的病毒在呼吸上皮细胞中诱导TNFα和IL-1β。
这种细胞因子的差异超诱导不能用两种病毒亚型之间复制动力学的差异来解释。1997年在香港、2004年在越南从感染H5N1病毒的病人身上分离出的H5N1病毒,以及H1N1亚型的人类流感病毒,都以类似的效率复制。H1N1病毒MOI的增加并没有导致细胞因子对可与H5N1病毒水平相媲美的水平的反应增加。目前尚不清楚H5N1病毒导致这种不同细胞因子超诱导的细胞机制。之前对转化的支气管上皮细胞系A549的研究表明toll样受体3 (TLR-3)参与了流感病毒A启动的细胞因子反应[27].目前尚不清楚H5N1病毒是否也通过TLR-3信号在原代人类上皮细胞中起作用。
细胞因子和趋化因子反应在活的有机体内由涉及多种细胞类型的自分泌和旁分泌相互作用产生。趋化因子如IP-10和MCP-1是巨噬细胞的趋化引诱剂,并通过进一步招募循环白细胞进入炎症组织介导炎症反应。我们之前已经证明,IP-10和MCP-1在原代人巨噬细胞中被sars冠状病毒上调[28].肺微环境中趋化因子的强烈诱导可能解释致死性H5N1患者肺中显著巨噬细胞浸润[4]以及SARS [29].
RANTES吸引单核细胞、嗜酸性粒细胞、嗜碱性粒细胞和T细胞,并选择性地吸引CD4+ T细胞。它由支气管上皮细胞产生,有助于气道病毒感染中炎症细胞的浸润[18].IL-6是一种多功能细胞因子,可以调节涉及活化,生长和分化的免疫和炎症反应[30.并可促进T细胞介导的炎症反应。事实上,尸检显示H5N1疾病患者肺间质中CD3+ T细胞增多[4].此外,IL-6已被证明在肺损伤时由巨噬细胞和上皮细胞释放[31] IL-6的效果与IL-1和TNF-alpha的影响是协同的[32].我们之前已经证明,其他促炎细胞因子如IL-1、TNF-alpha和IL-6在H5N1感染的巨噬细胞中是超诱导的[12].因此,H5N1病毒在巨噬细胞中诱导的人呼吸上皮细胞中IL-6表达的差异上调和在巨噬细胞中诱导的细胞因子可能与人H5N1疾病的发病机制协同作用。
H5N1病毒继续重组,从其他源自禽类的流感病毒获得不同的内部基因[33,34].H5N1/04病毒、A/越南/1194/04和A/越南/3046/04代表Z基因型病毒,它们是影响东南亚家禽的主要病毒基因型[27,35].因此,在超诱导细胞因子的特性和高毒力之间似乎存在关联。此外,在猪上皮细胞中,H5N1/97病毒被发现能抵抗干扰素的抗病毒作用[36这也可能与发病机制有关。值得注意的是,感染禽流感(H5N1)的患者血清中IP-10水平似乎高于感染人流感病毒的患者[4)提供在活的有机体内与我们现在的调查结果相似的数据体外.研究重组病毒携带的HA和1918年“西班牙流感”的NA流行病毒表明,这些病毒具有增强小鼠的毒力,诱导更高水平的巨噬细胞衍生趋化因子在活的有机体内在老鼠37].然而,细胞因子的超感应的这样的观察在活的有机体内可能只是反映了各自的病毒的更广泛的复制。该研究体外H5N1病毒排除了这些潜在的混杂因素,因此研究1918年重组病毒的细胞因子谱具有重要意义体外模型与这里描述的类似。
结论
与人类疾病相关的H5N1亚型甲型流感病毒比人H1N1病毒更能从受感染的人初级肺泡和支气管上皮细胞中诱导促炎细胞因子和趋化因子,包括IP-10、干扰素- β、IL-6和RANTES体外.以前的研究结果表明,H5N1/97病毒还能从巨噬细胞中高度诱导细胞因子,H5N1疾病患者血清中IP-10和其他趋化因子水平较高。这些发现可能与H5N1疾病的发病机制有关。最近在人类中重新出现的H5N1疾病是重新引起大流行关注的一个原因,并突出表明有必要更好地了解人类H5N1疾病的发病机制。这种认识将导致管理人类H5N1疾病的新战略,并加强我们应对大流行性流感(无论是来自H5N1型还是其他A型流感)的准备。
参考
- 1.
Webster RG, Bean WJ, Gorman OT, Chambers TM, Kawaoka Y:进化与A型流感病毒生态学。Microbiol牧师1992年,56(1):152-79。
- 2.
CLAAS EC,Osterhaus Ad,Van Beek R,De Jong Jc,Rimmelzwaan GF,Senne da,Krauss S,Shortridge Kf,Webster RG:人甲型H5N1流感病毒与一种高致病性禽流感病毒有关。《柳叶刀》1998年,351:472 - 77。
- 3.
Subbarao K,Klimov A,Katz J,Regenery H,Lim W,H Hall H,Perdue M,Swayne D,Bender C,Huang J,Hemphill M,Rowe T,Shaw M,Xu X,Fukuda K,Cox N:从一名患有致命呼吸道疾病的儿童分离的甲型禽流感(H5N1)病毒的特征。科学1998年,279:393-396。
- 4.
Peiris JSM, Yu WC, Leung CW,张CY, NG WF, Nicholls JM, NG TK, Chan KH, Lai ST, Lim WL, Yuen KY, Guan Y:致命的人类甲型H5N1流感亚型疾病再次出现。《柳叶刀》2004年,363:617 - 619。
- 5.
Tran TH,阮TL, Nguyen TD陈德良TS,范教授点,阮VC,范教授TS,签证官CD, Le TQ非政府组织TT,刀BK, PP,阮TT,黄平君TL,曹VT, TG,阮DT, Le HN,阮KT, Le HS VT,克丽丝汀D, Tran TT Menno de J Schultsz C、P、Lim W, Horby P,法勒J,世界卫生组织国际禽流感调查小组:越南10名患者感染甲型H5N1禽流感。N Eng J Med2004年,350:1179年至1188年。
- 6.
世界卫生组织:禽流感 - 累计案例 - 更新18。[http://www.who.int/csr/don/2005_05_19/en/index.html]
- 7.
至KF,CHAN PKS,CHAN KF,LEE WK,LAM WY,WONG KF,TANG NLS,TSANG DNC,SUNG RYT,BUCKLEY TA,TAM JS,Cheng AF:与甲型H5N1禽流感病毒相关的致命人类感染的病理医学病毒学杂志2001年,63:242-246。
- 8.
德容缅d,巴赫范凸轮,潘涂魁,武胡志明HIEN,陈谭清,阮巴赫色调,马塞尔Beld,黎氏PHUONG,张庭胡庆,阮文荣洲,陈静省HIEN,难道广哈,杰里米法拉:致命禽流感A(H5N1)在患有腹泻的孩子中,然后是昏迷。新英格兰医学杂志2005年,352:686-691。
- 9.
Yuen Ky,Chan PK,Peiris M,Tsang DN,Que TL,Shortridge Kf,Cheung Pt,To WK,Ho Et,Sung R,Cheng AF:甲型H5N1禽流感病毒相关人类疾病的临床特征和快速病毒诊断《柳叶刀》1998年,351:467 - 71。
- 10.
Fisman DN:噬血细胞综合征和感染。紧急情况感染说2000,6:601-08。
- 11.
BERDLEY AS,TOLLEY E,MEDURI GU:急性呼吸窘迫综合征中的感染与炎症反应。胸部1997年,111:1306-21。
- 12.
张CY, Poon LLM, Lu AS, luw, Lau YL, Shortridge KF, Gordon S, Guan Y, Peiris JSM:甲型流感(H5N1)病毒在人巨噬细胞中诱导促炎细胞因子:人类疾病异常严重程度的一种机制?《柳叶刀》2002,360:1831-1837。
- 13.
Fesq H,Bacher M,Nain M,Gemsa D:甲型流感病毒感染人单核细胞的程序性细胞死亡(凋亡)免疫学1994年,190:175 - 182。
- 14.
徐SH,威比R,韦伯斯特RG:肺泡巨噬细胞感染流感病毒无凋亡死亡和不同程度的炎症细胞因子诱导。病毒学2004年,329:270 - 279。
- 15.
Ebisawa IT, Kitamoto O, Takeuchi Y, Makino M:流行性感冒鼻上皮细胞的免疫细胞学研究。AM Rev Respir Dis1969年,99:507-15。
- 16.
Kuiken T, Rimmelzwaan GF, Van Amerongen G, Osterhaus AD:食蟹猕猴(束状猕猴)人甲型H5N1流感病毒感染的病理。兽医病理学2003年,40:304-10。
- 17.
UIPRASERTKUL M,PutihAvathana P,Sangsiriwut K,Sruk P,Srisook K,Peiris M,Nicholls JM,Chokephaibulkit K,Vanprapar N,Auewarakul P:甲型流感H5N1在人类中的复制位点。紧急情况感染说2005年,11:1036 - 41。
- 18.
Adachi M, Matsukura S, Tokunaga H, Kokubu F:甲型流感病毒诱导人支气管上皮细胞中细胞因子的表达国际花生过敏免疫1997年,113:307-311。
- 19.
坎宁安交流,米尔恩DS,威尔克斯Ĵ,黑暗JH,泰特利TD,柯比JA:从人肺分离的肺泡上皮细胞(II型肺细胞)MHC和粘附分子的组成性表达及其免疫细胞化学结果的比较。杂志细胞科学1994年,107:443 - 449。
- 20.
格兰维尔AR,Tazelaar HD,西奥多Ĵ,井本E,劳斯RV,鲍德温JC,罗宾ED:MHC I类和II类抗原在支气管上皮上的分布。阿米尔·雷斯皮尔1989年,139:330 - 334。
- 21.
peter U, Papadopoulos T, Muller-Hermelink HK:MHC II类抗原对人胎儿和新生儿的肺部上皮。感染组织学证据的肺组织和表达。实验室投资1990年,63:中山。
- 22.
Cheek JM, Kim KJ, Crandall ED:大鼠肺泡上皮细胞的紧密单层:生物电性能和活性钠转运。是杂志1989年,256:C688-C693。
- 23.
Elbert KJ, Schafer UF, Schafers HJ, Kim KJ, Lee VHL, Lehr CM:人肺泡上皮细胞原代培养肺吸收和运输研究的单层。医药研究1999年,16(5):601-08。
- 24.
Blaschke V,Reich K,Blaschke S,Neumann C:在小组织样本和单核细胞来源的树突细胞中快速定量促炎和趋化细胞因子的表达:一种新的实时RT-PCR技术的验证。J Immunol方法2000,246:79 - 90。
- 25.
Matrosovich MN, Matrosovich TY, Gray T, Roberts NA, Klent HD:人流感病毒和禽流感病毒针对人气道上皮培养的不同类型的细胞。Proc Natl Acad Sci USA2004年,101(13):4620 - 4624。
- 26.
Matrosovich MN, Zhou N, Kawaoka Y, Webster R:H5流感病毒的表面糖蛋白从人,鸡和野生鸟类中分离出来的性质。J Virol.1999年,73:1146 - 1155。
- 27.
Guillot L, Le Goffie R, Bloch S, Escriou N, Akira S, Chignard M, Si-Tahar M:toll样受体3参与肺上皮细胞对双链RNA和甲型流感病毒的免疫应答J Biol Chem.2005年,280:5571 - 5580。
- 28.
翔CY,潘LL,伍1H,漉W,Sia的SF,吴MH,陈KH,玄KY,戈登S,关Y,佩里斯JS:重症急性呼吸综合征冠状病毒感染巨噬细胞的细胞因子反应体外:可能与发病机制有关。J Virol.2005年,79:7819-26。
- 29.
Nicholls JM, Poon LLM, Lee KC, Ng WF, Lai ST, Leung CY, Chu CM, Hui PK, makl, Lim WL, Yan KW, Chan KH, Tsang NC, Guan Y, Yuen KY, Peiris JSM:致命严重急性呼吸综合征的肺病理学。《柳叶刀》2003年,361:1173 - 78。
- 30.
范切珍:白细胞介素-6:概述。为Immunol1990年,8:253 - 78。
- 31。
Hierholzer C,卡尔夫JC,Omert L,冢田K,Loeffert JE,金丝SC,Billiar TR,Tweardy DJ:失血性休克中白细胞介素-6的产生伴随着中性粒细胞募集和肺损伤。是杂志1998年,275:611-21。
- 32.
Le JM, Fredrickson G, Reis LF, Diamantstein T, Hirano T, Kishimoto T, Vilcek J:白介素6调控胸腺细胞功能的白细胞介素2依赖和白细胞介素2不依赖途径。Proc Natl Acad Sci USA1988年,85(22):8643 - 7。
- 33.
Guan Y, Peiris JS, Lipatov AS, Ellis TM, Dyrting KC, Krauss S, Zhang LJ, Webster RG, Shortridge KF:香港特别行政区出现多基因型H5N1禽流感病毒。Proc Natl Acad Sci USA2002,99(13):8950 - 5。
- 34.
Guan Y, Poon LL,张CY, Ellis TM, Lim W, Lipatov AS, Chan KH, Sturm-Ramirez KM,张CL, Leung YH, Yuen KY, Webster RG, Peiris JS:H5N1流感:千变万化的大流行威胁。Proc Natl Acad Sci USA2004年,101(21):8156 - 61。
- 35.
李克,关益,王家,史密斯GJ,Xu km,段l,rahardjo ap,puthavathana p,buranathai c,nguyen td,estopangestie,chaisingh a,auewarakul p,long ht,hanh nt,webby rj,poon ll,陈H,Shortridge Kf,Yuen Ky,Webster Rg,Peiris JS:东亚高致病性和潜在大流行的H5N1流感病毒的起源。自然2004年,430:209-13。
- 36.
Seo SH, Hoffmann E, Webster RG:致死的H5N1流感病毒逃脱宿主抗病毒药物响应。Nat地中海2002,8:950 - 54。
- 37.
Kobasa D, Takada A, Shinya K, hata M, Halfmann P, Theriault S, Suzuki H, Nishimura H, Mitamura K, Sugaya N, Usui T, Murata T, Maeda Y, Watanabe S, Suresh M, Suzuki T, Suzuki Y, Feldmann H, Kawaoka Y:用1918年大流行病毒的血凝素增强甲型流感病毒的毒性自然2004年,431:703 - 7。
确认
这项研究受到了陈调幅波的研究资助的研究基金的控制传染病(RFCID 03040712)和小项目资金,CRGC,香港大学和研究资助地产裴伟士研究基金会的传染病的控制(RFCID 01030172),香港大学研究资助局(HKU 7459/03M)及香港大学研究成就奖,2005。
作者信息
从属关系
相应的作者
附加信息
相互竞争的利益
作者声明他们没有相互竞争的利益。
作者的贡献
JSM Peiris, MCW Chan和CY张构思了研究,策划了整体实验设计并撰写了手稿。MCW Chan进行了实验;MCW Chan, CY张和YO Chan在BL3实验室进行实验,RWY Chan在BL2实验室协助实验。WH Chui提供肺活检标本,SW Tsao帮助开发人肺泡上皮细胞原代培养方法,JM Nicholls建议形态学研究,LLM Poon和Y Guan建议实验设计。所有作者都对手稿进行了严格的审查。
权利和权限
188滚球软件本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章188滚球软件,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
陈,M,张,C,崔,W。等等。甲型流感(H5N1)病毒在原代人肺泡和支气管上皮细胞中诱导的促炎细胞因子反应和物6,135(2005)。https://doi.org/10.1186/1465-9921-6-135
已收到:
接受:
发表:
- 禽流感
- 趋化因子
- IP-10
- 发病机理
评论
查看存档评论(1)