摘要
细菌基因组以频繁的未甲基化胞嘧啶-磷酸-鸟嘌呤(CpG)基序为特征。有害影响可发生时,合成寡核苷酸(ODN)与未甲基化的CpG二核苷酸(CpG-ODN)给药系统的方式。我们旨在评估气管内CpG-ODN对肺部炎症和全身炎症反应的影响。C57BL/6J小鼠气管内注射CpG-ODN(0.01、0.1、1.0、10、100 μM)或不含CpG基序的对照ODN。在灌注后3、6小时或1、2、7、14天取支气管肺泡灌洗液,并进行细胞计数和细胞因子测定。用安乐死前1小时注射人血清白蛋白浓度的BAL液血比评价肺通透性。核因子(NF)-κB DNA结合活性也在肺匀浆中进行了评估。气管内注射10 μM或更高浓度的CpG-ODN可诱导炎性细胞大量聚集到气道内。中性粒细胞和淋巴细胞的聚集高峰分别出现在CpG-ODN给药后1天和2天。10 μM CpG-ODN作用后1 d肺通透性增加。 CpG-ODN also induced nuclear translocation of NF-κB and upregulation of various inflammatory cytokines in BAL fluid and plasma. Histopathology of the lungs and liver revealed acute lung injury and liver damage with necrosis, respectively. Control ODN without CpG motif did not induce any inflammatory change. Since intratracheal CpG-ODN induced acute lung injury as well as systemic inflammatory response, therapeutic strategies to neutralize bacterial DNA that is released after administration of bactericidal agents should be considered.
背景
急性呼吸窘迫综合征(ARDS)是急性肺损伤(ALI)的最严重形式,是一种死亡率高的危重疾病。ALI/ARDS可与直接肺损伤(包括肺炎、胃内容物误吸和吸入有毒气体)或间接肺损伤(如败血症、输血和休克)有关。在各种诱发因素中,重症肺炎是最常见的诱因之一[1].气管内给药内毒素(脂多糖;LPS)是革兰氏阴性细菌的细胞壁成分,已被广泛用作严重肺炎后ALI/ARDS的实验模型[2].然而,其他细菌成分,如基因组DNA,在肺损伤和全身炎症反应的发展中所起的作用仍有待确定。
与脊椎动物DNA相比,细菌基因组含有更高频率的未甲基胞嘧啶-磷酸-鸟嘌呤(CpG)二核苷酸。含有未甲基化CpG二核苷酸(CpG-ODN)的小寡脱氧核苷酸(ODN)能够模拟细菌DNA的免疫刺激活性,因为细菌DNA和合成的ODN具有相似的碱基序列,并与相同的受体系统结合[3.- - - - - -5].
toll样受体(TLRs)已被证明通过识别微生物成分的特定模式在先天免疫的激活中发挥重要作用[6].在TLRs中,TLR9识别细菌或病毒DNA,尽管现在已知TLR9也识别未甲基化的含有cpg的DNA序列,包括哺乳动物起源和合成ODN [4,7].在肺中,在内皮细胞和巨噬细胞中检测到TLR9的组成性表达[8,9].有报道称腹腔或气管内注射CpG-ODN可引起肺部炎症[10- - - - - -12].然而,对于肺通透性的改变,细胞因子水平的时间进程,以及气管内CpG-ODN刺激的全身效应,我们知之甚少。
在这项研究中,我们评估了气管内给药CpG-ODN后炎症细胞的积累和水肿的形成。肺和肝脏的组织病理学也进行了分析。在CpG-ODN给药后不同时间点检测血浆和支气管肺泡灌洗液中细胞因子水平。用肺匀浆评价核因子-κB DNA结合活性。
方法
材料
合成的CpG-ODN (5'-tccatgacgttcctgatgct-3')和不含CpG基元的对照组ODN (5'-gcttgatgactcagccggaa-3')购自HyCult Biotechnology (Uden, Netherlands)。
老鼠
8周龄雄性C57BL/6J小鼠来自日本查尔斯河实验室(横滨,日本)。老鼠被免费提供水和标准的啮齿动物食物,并被关在无病原体的笼子里。所有动物实验均由庆应大学医学院动物保护与使用委员会批准。
小鼠肺损伤模型
评估肺损伤的炎症细胞积聚和水肿形成以及病理。用氯胺酮(120 mg/kg)和甲苯嗪(12 mg/kg)腹腔麻醉小鼠(20-25 g)。气管内灌注CpG-ODN、对照ODN或载体(磷酸盐缓冲盐水;PBS)在100 μL的体积中通过Microsprayer (PennCentury, Philadelphia, PA)进行。所有小鼠均于注药后3、6 h或1、2、7、14 d深度麻醉后处死。
支气管肺泡灌洗
小鼠腹腔注射戊巴比妥钠(50 mg/kg)麻醉后安乐死。暴露了气管,插入并固定了一个20号导管。分别用0.7 ml的冰冷PBS灌洗肺部。支气管肺泡灌洗液(BAL) 4℃,400 × g离心10 min,将细胞部分制成颗粒状,上清保存于-80℃,待测定细胞因子和人血清白蛋白水平,计算渗透指数。将细胞颗粒重悬于400 μL冷生理盐水中,用血细胞计测定细胞总数。使用Diff-Quik (Sysmex, Kobe, Japan)染色的细胞离心机涂片进行细胞计数。
支气管肺泡灌洗液和血浆中促炎介质的测定
使用多重细胞因子珠阵系统(Bio-Plex™;Bio-Rad, Hercules, CA)根据制造商的说明。简单地说,BAL液上清液或血浆用标记有针对上述一种细胞因子的特异性抗体的微珠孵育30分钟。孵育后清洗样品,然后用检测抗体鸡尾酒孵育,每种抗体都针对单一细胞因子。这一步之后是另一个洗涤步骤,用链霉亲和素-藻红菊酯孵育10分钟,再次洗涤,使用阵列读取器确定每种细胞因子的浓度。使用Bio-Plex™Manager软件程序对数据进行分析。
肺通透性指数
在安乐死前1小时,给予10 mg/kg人血清白蛋白(HSA) 100 μL生理盐水静脉注射。在献祭时,从下腔静脉抽血。渗透性指数定义为BAL液中HSA浓度与血浆中HSA浓度的比率,以百分数表示[13].HSA浓度用免疫分析法和人白蛋白ELISA定量试剂盒(Bethyl Laboratories, Montgomery, TX)测定。检测下限为5 ng/mL。
肺和肝的组织病理学
在另一系列实验中,肺在气管内灌注24小时后取样,在22 cm h的压力下气管内灌注10%中性磷酸盐缓冲福尔马林固定2O和嵌在石蜡里。肝脏也用10%中性磷酸盐缓冲福尔马林固定,并用石蜡包埋。将组织切成3 μm切片,用苏木精-伊红染色进行病理检查。
NF-κB (p65)在肺中的dna结合活性
核蛋白提取
在进行BAL后,采集左肺并在液氮中快速冷冻,然后在-80°C保存,直到分析。肺在2 mL冰冷的Buffer A (10 mM HEPES, 1.5 mM MgCl)中均质2, 10mm KCl, 0.5 mM DTT, 0.5 mM PMSF),用0.1%体积的Nonidet P-40和蛋白酶抑制剂鸡尾酒(1mg /mL leupeptin, 1mg /mL抑肽酶,10mg /mL大豆胰蛋白酶抑制剂,1mg /mL pepstain)。在冰上孵育10分钟后,在4°C下以850 × g离心10分钟。将颗粒重悬于2 mL Buffer A中,在4°C下以1200 × g离心10 min。粗核颗粒重悬于40 mL Buffer B (20 mM HEPES, 1.5 mM MgCl)中2, 0.42 M NaCl, 0.2 mM EDTA, 25% vol/vol甘油,0.5 mM DTT, 0.5 mM PMSF)与蛋白酶抑制剂鸡尾酒(如上所述),在冰上孵育30分钟。核提取液在2万× g离心15 min, 4℃下回收,-80℃保存。核提取物的蛋白浓度用BCA蛋白测定试剂盒(Pierce, Rockford, IL)测定,以牛血清白蛋白为标准。
NF-κB (p65) dna结合活性测定
NF-κB (p65) dna结合活性使用TransAM™ELISA试剂盒(Active Motif, Carlsbad, CA)根据制造商的方案进行检测。简而言之,将0.5 μg核提取物与96孔板中固定一致序列(5'-GGGACTTTCC-3')结合,并加入一抗和二抗。比色反应后,用分光光度计在450nm波长下测定样品。以重组NF-κB p65 (Active Motif)为蛋白标准。DNA结合特异性用野生型或突变寡核苷酸进行评估。
统计分析
数据以均数±SEM报告。用方差分析确定各组间的差异,然后用Bonferroni多重比较检验进行事后分析。p值小于0.05为有统计学意义。
结果
气管内CpG-ODN攻毒后炎症细胞的积累
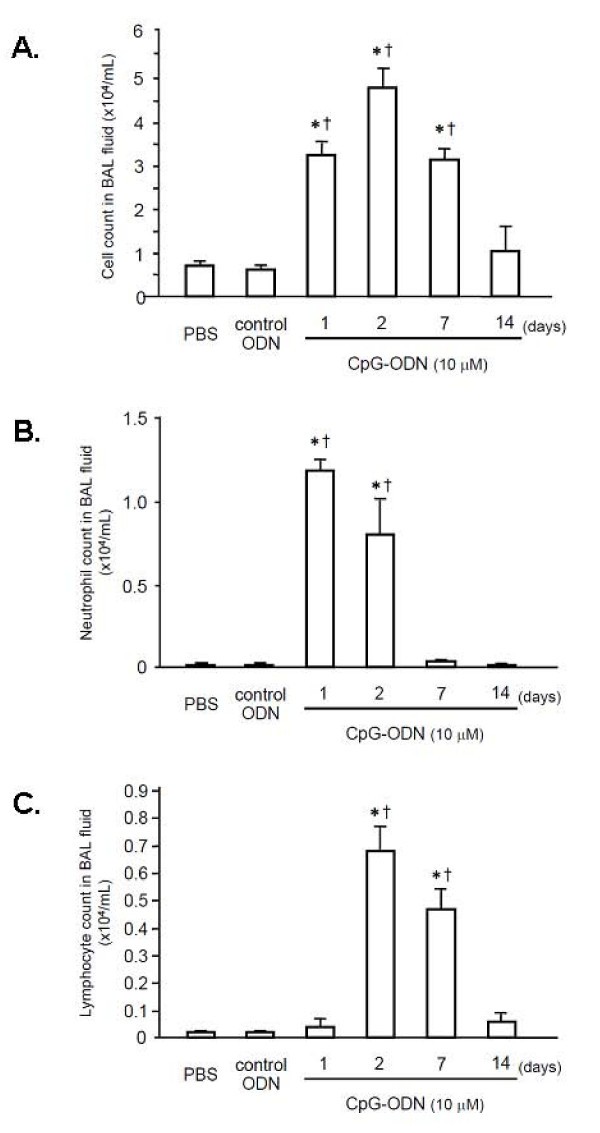
在第一组实验中,小鼠气管内灌注CpG-ODN(0.01、0.1、1.0、10或100 μM)或对照剂。两天后,获得BAL液,以评估炎症细胞在气道内的积聚(图1).PBS对照组与0.01、0.1、1.0 μM CpG-ODN处理组的细胞计数无显著差异。与PBS对照组相比,较高浓度(10和100 μM)的CpG-ODN可使BAL液中细胞计数显著增加(p < 0.05)。由于我们在接受10 μM或更高浓度CpG-ODN的小鼠中观察到明显的炎症细胞积聚到气道中,我们在接下来的实验中使用10 μM的CpG-ODN。
在接下来的一系列实验中,小鼠气管内灌注CpG-ODN (10 μM);6小时或1、2、7或14天后,取BAL液进行细胞计数。我们还在对照组ODN或PBS灌注24小时后收集BAL液。图中显示了BAL液中细胞总数和差异计数2.与对照组ODN或PBS相比,CpG-ODN灌注诱导炎症细胞招募到肺泡间隙显著增加(图2).第1天,与对照组ODN组和PBS组相比,BAL液中细胞总数显著增加(p < 0.05)。细胞总数在第2天进一步增加,然后在第14天下降。对照组ODN组和PBS组BAL液中细胞总数无差异。CpG-ODN攻毒后BAL液中中性粒细胞计数也显著增加(图2 b).在第1天和第2天,中性粒细胞计数显著高于对照组ODN或PBS (p < 0.01)。中性粒细胞计数在第7天恢复到基线。如图所示2摄氏度第2、7天BAL液淋巴细胞计数明显高于对照组(p < 0.05)。第1天和第14天的淋巴细胞计数与对照组无差异。结果表明,气管内给药CpG-ODN可在24小时内诱导中性粒细胞积聚到肺泡间隙,随后淋巴细胞积聚持续到CpG-ODN攻毒后7天。
气管内CpG-ODN给药后肺通透性的变化
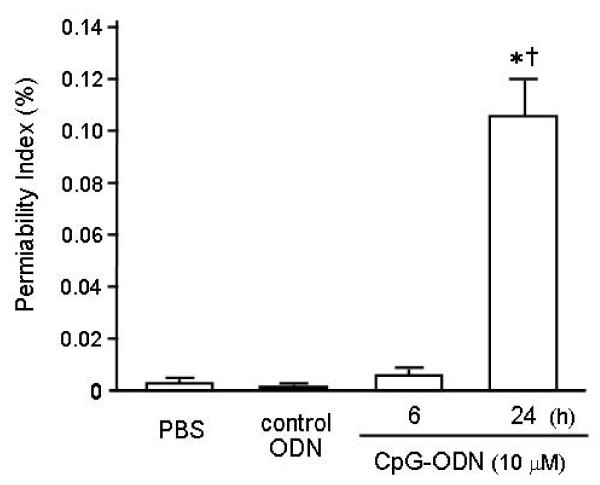
渗透性指数计算为牺牲前1小时静脉注射人白蛋白浓度的BAL液浆比(图3.).因此,该指标反映了肺内皮和肺泡间隔的通透性。CpG-ODN灌注后6 h,对照组和对照组的通透性指数无差异(分别为0.043±0.010%和0.066±0.013%)。CpG-ODN攻毒24 h后通透性指数高达1.043±0.269%,显著高于其他两组(p < 0.01)。这些结果表明CpG-ODN不仅引起炎症细胞的聚集,而且引起肺通透性的增加。
气管内CpG-ODN对BAL液和血浆细胞因子水平的影响
在气管内灌注后6 h或1、2、7 d收集BAL液和血浆,测定BAL液中IL-1β、TNF-α、IL-6、IL-10、IL-12p40、IFN-γ、MIP-1α、MIP-1β、MCP-1和KC的浓度。如表所示1CpG-ODN灌注后24 h内,肺泡腔内促炎细胞因子和趋化因子水平显著升高。除KC在灌注后6 h达到峰值外,大多数炎症介质的浓度在CpG-ODN攻毒后24 h达到最高。在6 h时,只有KC、IL-1β和IL-12p40与接受PBS或对照ODN的小鼠相比表现出显著升高。抗炎细胞因子IL-10浓度在CpG-ODN给药后2天达到最高。对照组ODN灌注组与PBS灌注组细胞因子浓度无显著差异。
在血浆中,与对照组ODN相比,CpG-ODN还诱导IL-1β、IL-6、IL-10、IL-12p40、KC、MCP-1和MIP-1β上调(表2)2).血浆中IL-12p40水平早在CpG-ODN刺激后6小时就显著升高。血浆中其他促炎介质的水平在24小时达到峰值,尽管IL-10水平在灌注后48小时达到最高,BAL液中也是如此。血浆细胞因子水平在第7天恢复到基线水平。在任何时间点,ODN灌注对照组小鼠和PBS灌注组小鼠的血浆细胞因子浓度均无显著差异。
CpG-ODN诱导肺、肝组织病理学改变
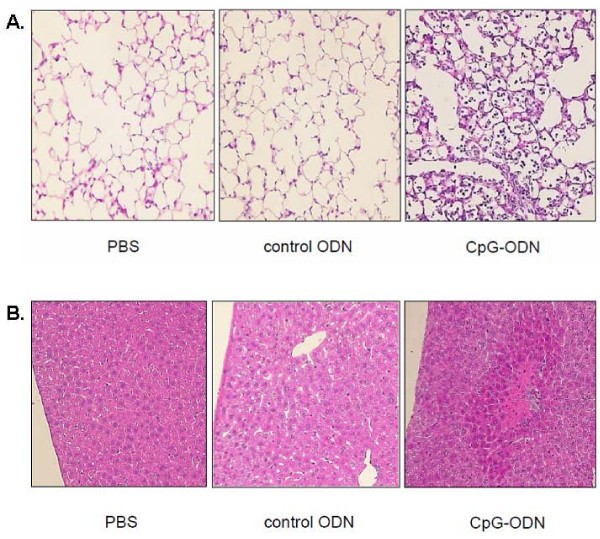
h - e染色肺标本的代表性显微表现见图4.在PBS或对照ODN处理的小鼠中,气管内灌注24小时后未观察到明显的中性粒细胞募集。CpG-ODN刺激引起肺泡间隙明显中性粒细胞堆积,肺泡间隔增厚,出血区域,提示急性肺损伤。
由于我们观察到血浆中炎症介质水平升高,肝脏也进行了组织病理学检查。如图所示4 b,气管内接受CpG-ODN的小鼠肝脏出现明显损伤,包括正常结构的破坏、坏死、中性粒细胞浸润和出血。PBS和对照组ODN处理的小鼠肝小叶结构和肝细胞正常。
CpG-ODN对肺NF-κB dna结合活性的影响
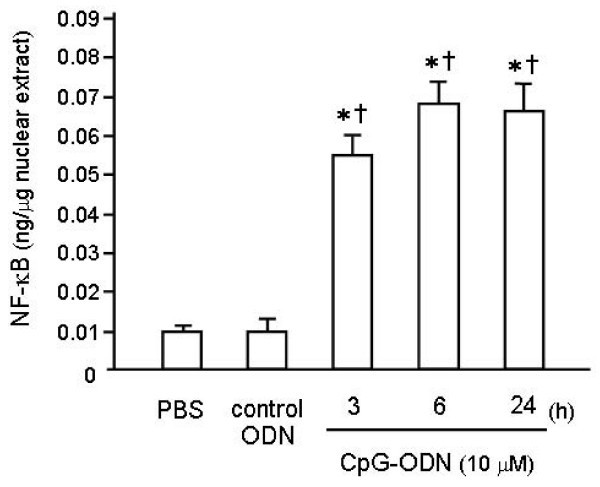
为了评价CpG-ODN对肺NF-κB信号通路上调的影响,采用TransAM™ELISA试剂盒分析肺匀浆核提取物。因为NF-κB在TLR信号通路中最常被激活的形式是由Rel a (p65)-p50组成的异源二聚体[14]和p50缺乏转录激活域,我们用p65作为NF-κB激活的标志。如图所示5, CpG-ODN攻毒诱导NF-κB dna结合活性在6 h内升高,到第2天减弱至基线水平。此外,结合是特异性的,因为野生型共识寡核苷酸阻止NF-κB与固定在平板上的探针结合;相反,突变的寡核苷酸对NF-κB结合无影响(数据未显示)。
讨论
在本研究中,我们证明了气管内给药CpG-ODN可诱导炎症细胞积聚和通透性水肿,以及肺泡间隙炎症介质的上调。此外,CpG-ODN挑战引起以高细胞活力血症和肝损伤为特征的全身炎症反应。相反,没有CpG基序的对照组ODN没有这种病理作用。这些结果表明,在抗生素治疗期间可以释放的微生物DNA可能不仅有助于ALI/ARDS的发展,而且还有助于肺炎后的全身炎症反应。据我们所知,这是关于气管内给药合成CpG-ODN对局部和全身炎症反应影响的第一篇报道。
既往研究表明CpG-ODN全身给药或吸入可增强抗菌免疫[15- - - - - -17].例如,邓等人证明了气管内CpG-ODN预处理提高了气管内接种的生存率克雷伯氏菌[15].另一方面,据报道,当细菌DNA或CpG-ODN以系统方式给药时,会产生有害影响[12,18].尽管CpG-ODN的隔室给药已被报道具有良好的耐受性和对呼吸道病原体的保护作用,但我们的结果显示气管内CpG-ODN的有害作用。这种差异可能是由于本研究中使用了相对较多的CpG-ODN (1.0 nmol)。综上所述,CpG-ODN增强了宿主的防御能力,过量使用可能会导致组织损伤。
中性粒细胞被认为是ALI/ARDS发病的重要因素[1,19].在本研究中,经气管内注射CpG-ODN可诱导明显的中性粒细胞流入肺泡间隙。此外,24 h时肝脏病理显示中性粒细胞浸润,出血坏死,提示炎症介质上调可能发生在较早的时间点。我们观察到,在CpG-ODN刺激后6小时,KC和IL-12p40的血浆水平升高,而其他介质的水平与对照组ODN或PBS处理的小鼠在该时间点的水平没有差异。在小鼠中,KC或CXCL8是中性粒细胞募集最重要的趋化因子之一[20.].由于我们观察到早在CpG-ODN灌注后6小时BAL液中KC水平显著升高,KC可能是促进中性粒细胞积聚到肺的关键介质。此外,血浆KC水平在24小时升高,这表明KC可能有助于进一步的中性粒细胞募集到肺和肝脏。Stefanovic和Stefanovic报道KC过表达导致2天内大量肝坏死,KC诱导促炎基因立即表达[21].我们的结论是,KC可能在CpG-ODN挑战后的肺部和全身炎症中发挥核心作用。
IL-12是dc介导的诱导Th1细胞分化的关键细胞因子,也被称为T细胞刺激因子,刺激T细胞和自然杀伤细胞产生IFN-γ和TNF-α。此前有报道称,CpG-DNA刺激可延长NF-κB在IL-12p40启动子上的活性,并延长肝dc产生IL-12p40的时间[22,23].此外,Tanaka和同事报告了抗il -12单抗被阻断丙酸菌属曼秀雷敦IL-12可能是T细胞依赖性肝损伤过程中必不可少的细胞因子[24].在本研究中,IL-12p40是唯一在6 h时血浆中升高的介质。我们认为CpG-ODN刺激可能诱导IL-12的产生,IL-12可能在肝损伤的发展中起关键作用。
我们之前报道过,在网状内皮系统(RES)中,lps诱导的肺反应可通过单核细胞吞噬增强[25].激活的RES可能有助于炎症介质的进一步上调。在较晚的时间点,血浆炎症介质是否从肺泡间隙或肝脏或脾脏的RES中释放仍有待确定。
我们观察到的远端肝损伤有两种可能的机制。一种是由炎症介质从肺泡间隙渗漏或释放引起的肝损伤。另一种说法是CpG-ODN从肺部进入血液直接造成损伤。Slotta等报道腹腔注射CpG-ODN可在第1天引起肝损伤,其特征为窦性白质淤滞、微循环恶化和肝细胞凋亡[26].考虑到CpG-ODN的分子大小(2.6 kDa),我们推测CpG-ODN可以通过肺的上皮和内皮屏障进入血流。
重症肺炎是导致急性呼吸道感染/急性呼吸窘迫综合征的主要危险因素之一[1].亦有报告显示,即使使用适当的抗生素治疗肺炎,仍会出现急性呼吸道感染/急性呼吸窘迫综合征[27].当细菌被抗生素杀死时,细菌细胞成分或其碎片被释放到周围环境中,如血液或肺泡上皮衬液。众所周知,细胞壁成分,如LPS和肽聚糖,分别通过TLR4和tlr2信号通路引起急性肺损伤[6].我们的研究结果表明,微生物DNA也可能参与组织损伤的发病机制。未甲基化细菌DNA的病原体相关分子模式可被TLR9识别,其免疫调节作用可被含有未甲基化CpG基序的odn模仿[4,5].在核内体中识别出富含cpg的序列后,由B细胞、巨噬细胞和树突状细胞(dc)表达的TLR9启动保守的TLR家族信号级联,该信号级联始于适配器蛋白MyD88的募集,导致NF-κB转位到细胞核[28].cpg诱导的NF-κB活化启动了共刺激分子的上调和促炎细胞因子的分泌,如TNF-α和IL-6。由于我们观察到CpG给药后NF-κB显著激活以及炎症因子的上调,该途径可能与肺部和全身炎症的发展有关。
可能很难将目前的数据外推到临床环境中,部分原因是基因组中CpG基序的数量或频率在不同类型的生物体之间是不同的。此外,CpG-ODN的局部浓度不仅由细菌负担决定,还由空气中液体的量决定。例如,伴有脱水的肺炎患者,其分泌物量较少,胸片显示轻度浸润,可能在气道中有浓缩的CpG-ODN。
本研究的主要局限性在于CpG-ODN挑战后的各种炎症事件是否真正依赖于tlr9仍不清楚。一些报道描述了tlr9独立的细菌DNA识别[29,30.].例如,细菌双链DNA转染激活巨噬细胞和dc以tlr9独立的方式产生TNF [29].此外,DAI-1,以前被命名为DLM-1或Z-DNA结合蛋白1,已被确定为一种细胞质受体,可感知并被DNA激活,导致I型IFN基因诱导[31].cpg - odn诱导的肺部和全身炎症过程的机制应该是未来研究的主题。
结论
气管内给药CpG-ODN可引起肺炎症细胞堆积和通透性水肿,并引起细胞分裂和肝脏炎症改变。结果表明,微生物DNA可引起全身炎症性肺损伤。在各种微生物衍生产品中,我们可能不仅要考虑LPS等细胞壁成分,还必须考虑基因片段作为预防肺炎后ALI/ARDS的关键材料和治疗靶点。
参考文献
- 1.
Ware LB, Matthay MA:急性呼吸窘迫综合征。N英语J医学2000,342(18):1334 - 1349。
- 2.
Brigham KL, Meyrick B:内毒素与肺损伤。Am Rev Respir Dis1986年,133(5):913 - 927。
- 3.
Hemmi H, Takeuchi O, Kawai T, Kaisho T, Sato S, Sanjo H, Matsumoto M,星野K, Wagner H,武田K, Akira S:toll样受体识别细菌DNA。自然2000,408(6813):740 - 745。
- 4.
Bauer S, Kirschning CJ, Häcker H, Redecke V, Hausmann S, Akira S, Wagner H, Lipford GB:人类TLR9通过物种特异性CpG基序识别对细菌DNA做出反应。美国国家科学研究院2001,98(16):9237 - 9242。
- 5.
克里格问:细菌DNA中的CpG基序及其免疫效应。免疫年鉴2002年,20:709 - 760。
- 6.
武田K, Akira S:TLR信号通路。Semin Immunol2004年,16(1):3 - 9。
- 7.
Krieg AM, Yi AK, Matson S, Waldschmidt TJ, Bishop GA, Teasdale R, Koretzky GA, Klinman DM:细菌DNA中的CpG基序直接触发b细胞激活。自然1995年,374(6522):546 - 549。
- 8.
李俊,马铮,唐志林,Stevens T, Pitt B, Li S:CpG dna介导的肺内皮细胞免疫应答Am J Physiol肺细胞Mol Physiol2004年,287(3):l552 - 558。
- 9.
郭z, Garg S, Hill KM, Jayashankar L, Mooney MR, Hoelscher M, Katz JM, Boss JM, Sambhara S:TLR9基因的组成和IFN-β诱导的表达需要远端调控区。J Immunol2005年,175(11):7407 - 7418。
- 10.
Schwartz DA, Quinn TJ, Thorne PS, Sayeed S, Yi AK, Krieg AM:细菌DNA中的CpG基序引起下呼吸道炎症。J临床投资1997年,One hundred.(1):68 - 73。
- 11.
山田H,石井KJ, Klinman DM:抑制性寡核苷酸抑制cpg诱导的小鼠肺部炎症。重症监护医学2004年,32(10):2045 - 2049。
- 12.
Knuefermann P, Baumgarten G, Koch A, Schwederski M, Velten M, Ehrentraut H, Mersmann J, Meyer R, Hoeft A, Zacharowski K, Grohé C:CpG寡核苷酸激活toll样受体9,在体内引起肺部炎症。和物2007年,8:72.
- 13.
张H,田坂S,白石Y,福永K,山田W,关H,小川Y,宫本K,中野Y,长谷川N,宫正T,丸山I,石中A:晚期糖基化终产物可溶性受体在内毒素致肺损伤中的作用。J呼吸急救医疗吗2008年,178(4):356 - 362。
- 14.
海登MS,西AP,高希S:NF-κB与免疫反应。致癌基因2006年,25(51):6758 - 6780。
- 15.
邓景杰,Moore TA, Newstead MW,曾X, Krieg AM, Standiford TJ:CpG寡脱氧核苷酸刺激保护性先天免疫对抗肺部克雷伯氏菌感染。J Immunol2004年,173(8):5148 - 5155。
- 16.
Juffermans NP, Leemans JC, Florquin S, Verbon A, Kolk AH, Speelman P, van Deventer SJ, Poll T:CpG寡脱氧核苷酸在小鼠结核病期间增强宿主防御。感染Immun2002年,70(1):147 - 152。
- 17.
Bozza S, Gaziano R, Lipford GB, Montagnoli C, Bacci A, Di Francesco P, Kurup VP, Wagner H, Romani L:重组菌对小鼠侵袭性曲霉病的免疫曲霉属真菌蛋白质和CpG寡脱氧核苷酸作为佐剂。微生物感染2002年,4(13):1281 - 1290。
- 18.
Sparwasser T, Miethke T, Lipford G, Borschert K, Hacker H, Heeg K, Wagner H:细菌DNA导致感染性休克。自然1997年,386(6623):336 - 337。
- 19.
马Matthay:会议总结:急性肺损伤。胸部1999年,116(1):119年代- 126年代。
- 20.
merser - jones MA, Shrotri MS, Peyton JC, Remick DG, Cheadle WG:在实验性腹膜炎期间,C-X-C趋化因子对肝和肺中的中性粒细胞隔离有差异调节。炎症1999年,23(4):305 - 319。
- 21.
Stefanovic L, Stefanovic B:KC趋化因子的直接肝毒性作用机制:基因表达的顺序激活和从炎症到坏死的进展。干扰素细胞因子2006年,26(10):760 - 770。
- 22.
Bode KA, Schmitz F, Vargas L, Heeg K, Dalpke AH:RelA激活的动力学控制着tlr介导的IL-12p40诱导的大小。J Immunol2009年,182(4):2176 - 2184。
- 23.
舒萨,连正喜,庄永华,杨国祥,Moritoki Y, Comstock SS,钟RQ, Ansari AA,刘玉杰,Gershwin ME:CD11c(+)肝树突状细胞在诱导先天免疫反应中的作用临床试验免疫2007年,149(2):335 - 343。
- 24.
田中Y,高桥A,渡边K,高山K,八幡T,羽部S,西村T:IL-12在th1依赖性小鼠肝损伤中的关键作用。Int Immunol1996年,8(4):569 - 576。
- 25.
石中A,长谷川N,早山K,浦野T,中村H,坂木F,苏岛K, Waki Y, Tasaka S,中村M,松原H,金泽M:网状内皮系统中单个核细胞吞噬增强内毒素诱导的肺反应。重症监护医学1996年,24(6):1034 - 1040。
- 26.
Slotta JE, Scheuer C, Menger MD, Vollmar B:免疫刺激cpg -寡脱氧核苷酸(CpG-ODN)诱导早期肝损伤,但提供了一个较晚的保护窗口,以防止内毒素介导的肝损伤。J乙醇2006年,44(3):576 - 585。
- 27.
Seidenfeld JJ, Pohl DF, Bell RC, Harris GD, Johanson WG Jr:成人呼吸窘迫综合征患者感染的发生率、部位和结局。Am Rev Respir Dis1986年,134(1):12日至16日。
- 28.
权海俊,李kw,余硕,韩俊华,金世德:cpg -寡核苷酸对NF-κ b依赖性肿瘤坏死因子-α基因表达的调控生物化学生物物理Res公社2003年,311(1):129 - 138。
- 29.
安田K,小川Y,山根I,三川M,高仓Y:DNA/阳离子脂质体复合物激活巨噬细胞需要内体酸化和tlr9依赖和-独立途径。白细胞生物学2005年,77(1):71 - 79。
- 30.
安田K,余P,科诗宁CJ,施莱特D,施密茨F,海特A,鲍尔S,贺希林H,瓦格纳H:脊椎动物DNA内体易位通过tlr9依赖和-独立途径激活树突状细胞。J Immunol2005年,174(10):6129 - 6136。
- 31.
高冈A,王志c,崔MK,柳井H,根岸H,坂T,陆Y,宫垣M, Kodama T,本田K,大叶Y,谷口T:DAI (DLM-1/ZBP1)是一种细胞质DNA传感器和先天性免疫反应的激活剂。自然2007年,448(7152):501 - 505。
确认
作者感谢庆应义塾大学医学院的Miyuki Yamamoto的技术支持。我们也感谢庆应义塾大学医学院病理科龟山薰博士的有益讨论。
给予的支持:部分由日本厚生劳动省的一项科学研究补助金资助(no. 1)。19590913)(海运)。
作者信息
从属关系
相应的作者
额外的信息
利益冲突
作者宣称他们之间没有利益冲突。
作者的贡献
ST设计了研究并起草了手稿。HK进行了最多的体内实验,并进行了统计分析。KM、YN、HS、YK、HF、NH和SF对实验有帮助。TM采用悬浮法测定细胞因子。AI监督了这项研究。所有作者都阅读并批准了手稿。
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,188滚球软件根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
田中,S, Kamata, H,宫本,K。et al。气管内合成CpG寡脱氧核苷酸可引起急性肺损伤并伴有全身炎症反应。和物10,84(2009)。https://doi.org/10.1186/1465-9921-10-84
收到了:
接受:
发表:
关键字
- 急性肺损伤
- 肺泡空间
- 气管内的滴注法
- 渗透率指数
- 气管内的管理