摘要
背景
炎症可能参与了各种形式的肺动脉高压(PH)的发病机制。最近对特发性PH或与基础疾病相关的PH患者的研究表明,白细胞介素-6 (IL-6)与PH有关。
方法
为了确定内源性IL-6是否有助于介导的缺氧pH和肺炎,我们研究了IL-6缺陷(IL-6-/-)和野生型(IL-6+/+)暴露于缺氧环境2周。
结果
IL-6降低右心室收缩压、右心室肥厚、肺肌血管数量和中膜厚度-/-虽然急性缺氧的压力反应在IL-6中相似+/+和IL-6-/-老鼠。IL-6缺氧暴露+/+小鼠在第一周内IL-6 mRNA和蛋白水平显著升高,肺血管壁IL-6免疫染色阳性。缺氧1周和2周后,肺IL-6受体和gp 130 (IL-6信号传感器)mRNA水平升高。体外培养的人肺动脉平滑肌细胞(PA-SMCs)和微血管内皮细胞的研究表明,在缺氧的进一步刺激下,PA-SMCs能显著合成IL-6。IL-6还能显著促进PA-SMC的迁移而不影响其增殖。缺氧il - 6-/-与肺蛋白水平和特异性巨噬细胞标记物F4 / 80的免疫染色评估相比,小鼠在肺中募集肺部较少炎症细胞募集,与肺蛋白水平和免疫染色,粘附分子或细胞因子的肺部表达没有差异。
结论
这些数据提示IL-6可能参与了缺氧诱导的小鼠肺炎症和肺血管重建。
背景
炎症现在被认为是特发性肺动脉高压(PH)和与基础疾病相关的PH发病机制的潜在因素[1,2].在PH值或慢性阻塞性肺疾病(COPD)患者的肺中可发现血管周围炎症细胞浸润[2,3.].与健康对照组相比,特发性或相关PH患者表现出更高的循环水平和各种炎症细胞因子和趋化因子的肺部表达,包括白介素-1β (IL-1β)、IL-6、单核细胞趋化蛋白(MCP-1)、RANTES和fractalkine [4- - - - - -10.].在近期对COPD患者的研究中,我们发现肺动脉压力与两种细胞因子IL-6和MCP-1的循环水平呈正相关[11.].此外,在我们的COPD患者中发现IL-6基因G(-174)C多态性与PH的严重程度密切相关。这种多态性影响循环中IL-6的水平,提示循环中IL-6的高水平在COPD患者PH的发病机制中具有因果作用。
IL-6是一种多功能促炎细胞因子,与包括全身和肺血管疾病在内的许多疾病有关[12.].IL-6现在被认为是心血管风险的主要生物标志物,也是肝脏产生c反应蛋白的主要刺激物,c反应蛋白是一种广泛用于动脉粥样硬化的生物标志物[13.].临床和实验研究表明IL-6在各种形式的PH发病机制中的作用。有报道称,特发性PH或PH与炎性疾病(如硬皮病、狼疮和POEMS综合征)相关的患者血清IL-6浓度升高[4,14.- - - - - -16.,尽管其他研究没有在特发性PH或结缔组织疾病患者中证实这些发现[17.].从暴露于慢性缺氧的动物的肺部记录了IL-6水平的增加[18.].急性缺氧时报告的IL-6升高提示影响肺血管通透性和对缺氧的早期炎症反应[19.,20.].最近的研究发现,在暴露于慢性缺氧的小鼠中,外源性管理的IL-6加重了PH的发展,这表明IL-6在肺血管重塑中发挥了作用[21].输注IL-6也被证明会导致肺血管血栓形成和血管阻塞,表明与循环细胞的血栓前和炎症前相互作用[22,23].最近,IL-6过表达转基因小鼠已被证明发生自发性肺血管重构和PH [24].然而,内源性IL-6生理水平对PH发育的影响尚不清楚。因此,目前尚不清楚IL-6是否参与了慢性缺氧时肺血管重塑的过程,以及它如何影响肺血管系统。
本研究的目的是探讨IL-6缺乏是否影响慢性缺氧时肺血管重构和PH的发展。我们使用靶向破坏IL-6基因的小鼠来研究暴露于慢性缺氧期间PH的发展和肺巨噬细胞的浸润[25].
材料和方法
老鼠
缺乏IL-6的小鼠(IL-6-/-),在C57Bl/6和IL-6上同源重组生成-/-遗传背景(25].的野生型il - 6+/+和突变体纯合的IL-6-/-本研究中使用的小鼠是通过杂交杂合突变体获得的雄性窝伴。基因型是通过聚合酶链反应(PCR)对尾部活检进行分析,以检测是否存在失活的新霉素基因和/或存在中断的(IL-6)-/-或完整(IL-6+/+老鼠)il - 6基因。8-10周龄小鼠随机分为室内空气组和慢性缺氧组。所有动物护理和程序都符合机构指导方针。
常氧小鼠对急性缺氧的血流动力学反应
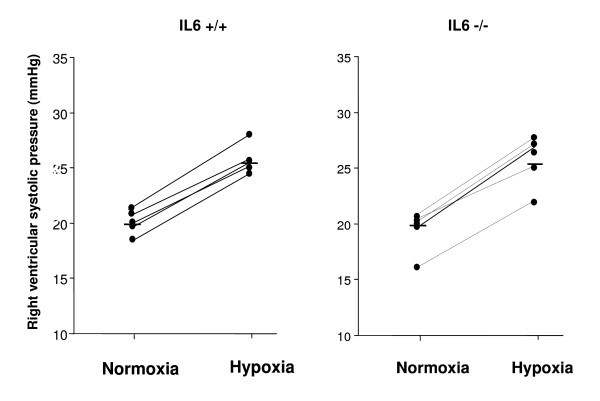
小鼠腹腔注射氯胺酮(6 mg/100 g)和氧拉嗪(1 mg/100 g)麻醉,气管插管,肺以0.2 ml潮气量、90次/ min的呼吸频率通室内空气。一根26号针经皮经棘突下入路进入右心室。测量右心室收缩压(RVSP)。首先记录动物室内空气通气时的RVSP和心率,然后在5分钟后用低氧气体混合物(8% O2, 92% N2).在这些条件下,心率在每分钟300到500之间。如果心率低于每分钟300次,则不进行测量。
接触慢性缺氧
小鼠暴露于慢性缺氧(10% O2)在通风室(500l容积;Flufrance,卡赞,法国)如前所述[26].用室内空气和氮气的混合物冲洗室,建立缺氧环境,气体再循环。用氧气分析仪监测舱内环境。用钠石灰颗粒去除二氧化碳,通过冷却循环回路来防止多余的湿度。常氧小鼠被关在一个用常氧气体冲洗的相似的房间里,在同一个房间里,有同样的光-暗循环。
肺动脉高压的评估
小鼠先前暴露于缺氧或室内空气1天,1周,或2周麻醉。腹部切开后,将连接压力传感器的26号针经膈肌插入右心室,立即记录RVSP。然后,打开胸腔,取出肺和心脏。从左室+室间隔(LV+S)中分离出右心室(RV),称重测定富尔顿指数(RV/LV+S)。气管内灌注4%缓冲福尔马林水溶液固定肺。右肺正中矢状面切片进行石蜡包埋。切片厚度为5 μm,苏木精-弗乐辛-藏红花染色,光镜下观察。在每只小鼠中,共有20至30条直径在50-200 μm范围内的腺泡内血管,伴随肺泡导管或肺泡,由不了解基因型的观察者进行检查。每条血管被分为非肌性(没有血管壁肌肉化的迹象)、部分肌性(平滑肌细胞[SMCs]小于血管周长的四分之三)或全肌性(SMCs大于血管周长的四分之三)。肺血管在每个肌肉化类别中的百分比是通过将该类别中的血管数量除以相关动物组中计数的总数量来确定的。 For fully muscular vessels, video images were obtained and arterial diameters were measured using image-analysis software. Percent wall thickness was then calculated as the diameter of the external elastic lamina minus the diameter of the internal lamina divided by the diameter of the external elastic lamina.
总RNA隔离
根据制造商的指示,使用Qiagen Rneasy Mini Kit(Qiagen Sa,Courtaboeuf,法国)从肺中提取总RNA,并使用光学密度测量(260至280nm吸光度比)估计。使用标准分光光度法测定RNA浓度,通过目视检查溴化乙锭染色的琼脂糖凝胶来评估RNA完整性。
cDNA制备和实时定量聚合酶链反应
第一链cDNA的合成使用SuperScript II逆转录酶系统(Life Technologies。公司,马里兰州盖瑟斯堡)。取总RNA 2 μg、三磷酸脱氧核苷酸混合物2 μL (10 nmol/L)、随机引物100 ng、总体积12 μL的混合物,在65℃下孵育5分钟,冷藏。然后是4 μL 1圣加入Strand Buffer、DTT (0.1 mol/L) 2 μL、核糖核酸酶抑制剂(RNAse-Out, Invitrogen, Carlsbad, CA) 40 U, 25℃加热2分钟。加入1 μL SuperScript逆转录酶II (200 U/μL)后,在25℃、42℃、70℃分别孵育10 min、50 min、15 min。cDNA以1:40稀释,用于实时定量聚合酶链反应。使用ABI Prism 7000系统(应用生物系统)进行重复扩增。促进城市,CA)。利用Primer Express软件(Applied Biosystems)设计PCR引物。为避免残留基因组DNA扩增不当,我们选择了内含子扩增引物,并提供了内控18S rRNA引物。表中列出了检测肺中IL-6、sIL-6-R、gp130、ET-1、MCP-1、ICAM、VCAM rna的引物1.使用SyberGreen mix和特异性引物对每个样品进行重复扩增反应。采用ABI-Prism 7000序列检测软件(Applied Biosystems)进行信号检测和结果分析。计算感兴趣基因相对于内标r18S mRNA表达量的相对表达量:relative mRNA = 1/2(Ct感兴趣的基因-ct.R18s.).
蛋白质提取和ELISA
从100毫克的快速冷冻组织样品中提取蛋白质,用适量的含有蛋白酶抑制剂的均质Rippa缓冲液均质。匀浆4℃离心,收集上清液。检测全肺IL-6匀浆中IL-6蛋白表达+/+暴露在24小时后,1周或2周的缺氧和常氧的小鼠。简而言之,将50μl肺匀浆与50μl的测定稀释剂在室温下,在涂有针对IL-6的单克隆抗体的96孔板中,在室温下孵育2小时。三次洗涤后,加入多克隆IL-6抗体和辣根过氧化物酶的缀合物并在室温下温育2小时。加入彩色试剂后,在ThermoMax微孔板读取器中以450nm测量吸光度。结果对于先前使用Bradford方法确定的蛋白质浓度标准化。对于标准化,同时测定重组小鼠IL-6的连续稀释液。
肺免疫组化标记IL-6和巨噬细胞
肺标本的石蜡切片,每5毫米厚,被安装在Superfrost Plus玻片上(Fisher Scientific, Illkirch,法国)。IL-6和巨噬细胞免疫染色,将载玻片在100%甲苯中脱蜡,然后将切片浸泡在降低浓度的乙醇(100%、95%和70%)中再水化,然后浸泡在蒸馏水中。H2O2在甲醇(0.3%Vol / Vol)中10分钟。在用PBS洗涤三次洗涤后,将该部分预孵育在补充有3%(Vol /体积)牛血清白蛋白的PBS中,然后用多克隆山羊抗IL-6(Santa Cruz Biotechnology,Santa Cruz,CA)或对特定小鼠巨噬细胞标记的大鼠抗体F4 / 80(ABD Serotec,Kidlington,England,England),每种稀释1:500在含有0.02%牛血清白蛋白的PBS中。将该部分暴露于同一缓冲液中的生物素标记的通用二抗(Dako,Trappes,France)将其暴露1小时,然后在同一缓冲液中达到链霉抗生物素蛋白生物素辣根过氧化物酶溶液。使用3,3'-二氨基苯并二甲基四氯化物二水合物(DAB,Sigma,St Louis,Mo)和过氧化氢进行过氧化物酶染色。最后,将该部分用苏木精和曙红染色。
F4/80免疫印迹
使用Bradford方法测定总肺匀浆中的蛋白质浓度后,将来自每个肺样品的30μg蛋白质重悬于3×Lemmli缓冲液中,煮沸5分钟,并通过电泳在8%丙烯酰胺凝胶上分离。将蛋白质电泳转移到聚偏二氟化物(PVDF)膜(Sigma-Aldrich)在室温下1小时。在室温下含有0.05%Tween 20(TTB)的Tris缓冲盐水中的5%非耐旱性干乳后,将膜与大鼠抗小鼠F4 / 80抗体一起温育(稀释1:1000; ABD Serotec)在4°C下用摇摆过夜。然后将膜在室温下与次级抗大鼠抗体孵育1小时。在TTB洗涤后,将膜在化学发光检测试剂(ECL,GE Healthcare Life Sciences)中孵育一分钟,然后暴露于柯达Biomax MS膜(GE Healthcare Life Sciences)2分钟。使用激光密度测定法量化蛋白质印迹结果。
人肺动脉平滑肌细胞(PA-SMCs)和肺血管内皮细胞(P-ECs)的分离与培养
从肺动脉外植体中培养人PA-SMCs,采用免疫磁纯化分离的P-ECs进行培养,如前所述[27].文化(5 ? 104分别制备P-ECs和PA-SMCs,并使用ELISA (R&D Systems, Lille, France)检测培养细胞裂解液中的IL-6水平。细胞被用于第3代和第6代之间的研究。
IL-6对人肺动脉平滑肌细胞迁移的影响
PA-SMC迁移采用改进的Boyden室(Transwell)进行评估®,康宁Costar公司,巴德霍夫多普,荷兰)。平板上装有嵌件,其底部由内径6.5 mm、孔径8 μm的聚碳酸酯膜密封。用100 μg/ml的I型胶原蛋白溶液涂膜。将培养的PA-SMCs胰酶化并悬浮在5·10的浓度下5在DMEM中添加10%胎牛血清(FCS)。PA-SMC悬液,200 μl,置于上腔,使其粘附24小时。然后取出培养基,在上腔用200 μl无fcs DMEM替代,在下腔用500 μl含有IL-6、sIL-6-R或两者(100 ng/ml)的无fcs DMEM替代。在37°C、5% CO下孵育24小时后2,采用Diff-Quick (Medion Diagnostic, Grafelfing, Germany)对细胞进行固定和染色。计算了从滤波器下表面随机选取的10个大功率(× 400)场中PA-SMCs的平均数量。
IL-6对人PA-SMC增殖的影响
将添加10% FCS的DMEM中的PA-SMCs以5·10的密度播种于24孔板中4细胞/孔并允许粘附。将细胞进行48小时的FCS-免培养基中的生长停滞,然后在DMEM中孵育0.3%FCS,其补充有0.6μCI/ mL [3.H]胸腺嘧啶与IL-6, sIL-6-R,或两者(各100 ng/ml)。细胞孵育24小时后,用PBS洗涤2次,置于10%三氯乙酸冰水中,0.1 N NaOH溶解(0.5 ml/well)。[3.以每孔每分钟计数(cpm)表达胸苷激酶。
统计分析
所有结果均表示为平均值±SEM。采用非参数Mann-Whitney检验比较野生型与IL-6的差异-/-常氧老鼠。采用双向方差分析评估IL-6的影响+/+和IL-6-/-小鼠,常氧或缺氧对血流动力学、右心室肥厚和肌肉化的影响,通过动脉壁厚度评估。当方差分析表明暴露条件和基因型之间存在交互作用时,IL-6+/+和IL-6-/-在每一种条件下,用非参数检验对小鼠进行进一步比较。为了比较两种基因型在每种情况下肺血管肌肉化的程度,将肺血管分为非肌肉型、部分肌肉型或肌肉型后,使用非参数Mann-Whitney检验。
结果
对急性缺氧的血流动力学反应
急性缺氧对正常小鼠RVSP的影响进行了研究。室内空气通风时,RVSP和心率在IL-6之间无差异+/+和IL-6-/-老鼠。接触8% O2引起RVSP大幅增加(图。1),在IL-6中同样+/+和IL-6-/-小鼠,(ΔRVSP, 5.2±0.4 mm Hg, n = 6;vs. 5.7±0.2 mm Hg, n = 5;分别;NS)。
常氧和缺氧时肺组织IL-6、IL-6- r和gp130的表达
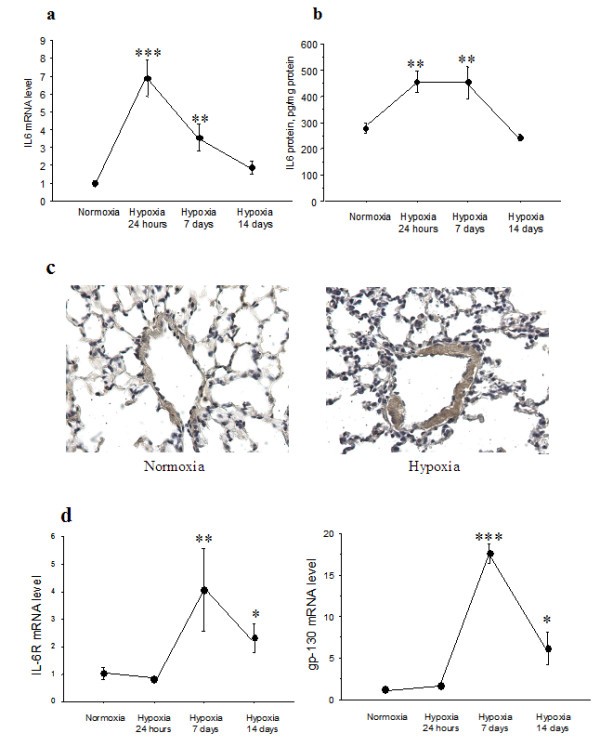
暴露于缺氧与野生型小鼠肺IL-6 mRNA和蛋白质水平的快速上升相关。肺IL-6 mRNA水平在24小时达到达到峰值,然后在第7天下降并在第14天返回基础值(图2).肺IL-6蛋白水平在24小时也升高,但在第7天仍然升高,然后在第14天恢复到基础值(图)2 b).相比之下,肺IL-6受体和gp 130 mRNA水平在缺氧1周后显著升高,在缺氧2周后仍保持升高(图)二维).免疫组化研究显示,缺氧7天野生型小鼠肺血管壁的IL-6免疫染色(图)2摄氏度).
白细胞介素-6在肺中的表达及免疫定位+/+缺氧暴露后的小鼠.实时定量RT-PCR检测肺组织中IL-6 mRNA水平(a), ELISA检测蛋白水平(b)。每个点是暴露于10% O后至少8次检测的平均值±SEM224小时,1周,或2周。Arunachal Pradesh,P< 0.01,* * *P< 0.001,与正常小鼠相比。IL-6肺切片的免疫染色+/+小鼠在常氧(c,左图)和缺氧后暴露7天(c,右图)。在暴露于缺氧的动物血管壁上可以看到强烈的IL-6免疫染色(箭头)。IL-6在全肺组织中IL-6R和gp-130 RNA表达+/+(d)。每个点是暴露于10% O后至少8个测定值的平均值±SEM224小时,1周,或2周。*P< 0.05,* *P< 0.01,* * *P< 0.001,与正常缺氧动物的值相比。
缺氧诱导的肺动脉高压和血管重塑的发展
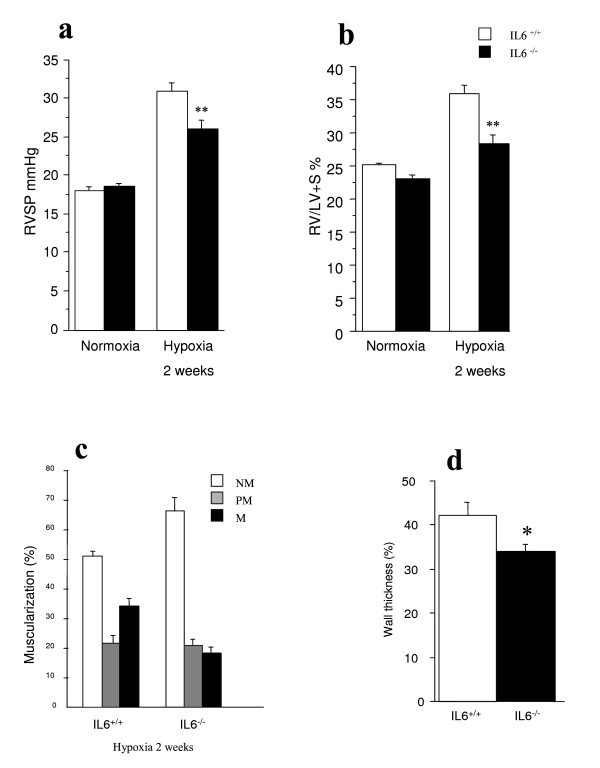
总体重(BW)在IL6组略高+/+比在IL6中-/-老鼠(表2).在常氧条件下,IL6-/-和白细胞介素6+/+左室重/体重、右室重/体重、心率无显著差异。暴露于缺氧与野生型和IL6的RVSP和Fulton指数增加相关-/-老鼠。然而,缺氧2周后,RVSP显著降低,IL-6右心室肥厚减轻-/-比在il - 6+/+老鼠(P< 0.01)(图3 a, b).此外,随着缺氧暴露的远端肺部血管肌肉化,IL-6的标记较小-/-小鼠比在IL-6中+/+如图所示,肌肉化的肺血管的百分比3 c)和肌动脉壁厚度(图3 d).
低氧性肺动脉高压的发展与IL-6的血管重建+/+和IL-6-/-老鼠.右心室收缩压(RVSP) (一个)和右心室/左心室+间隔重量(富尔顿指数)(b) il - 6+/+和IL-6-/-小鼠暴露于常氧或10%氧22周。Arunachal Pradesh,P与IL-6相比< 0.01+/+同样条件下的老鼠。野生型IL-6肌肉化血管的百分比+/+和IL-6-/-老鼠(c).缺氧2周后,检测各基因型小鼠每个肺的腺泡内血管20 ~ 30条。非肌肉(NM)、部分肌肉(PM)和全肌肉(M)血管的百分比在IL-6之间存在显著差异+/+缺氧2周后(P<0.05)。来自IL-6的肺部的完全肌肉动脉中测量的标准化壁厚-/-和IL-6+/+小鼠缺氧暴露2周(d).*P与IL-6相比< 0.05+/+小鼠缺氧2周。
慢性缺氧暴露下肺巨噬细胞募集和细胞因子表达
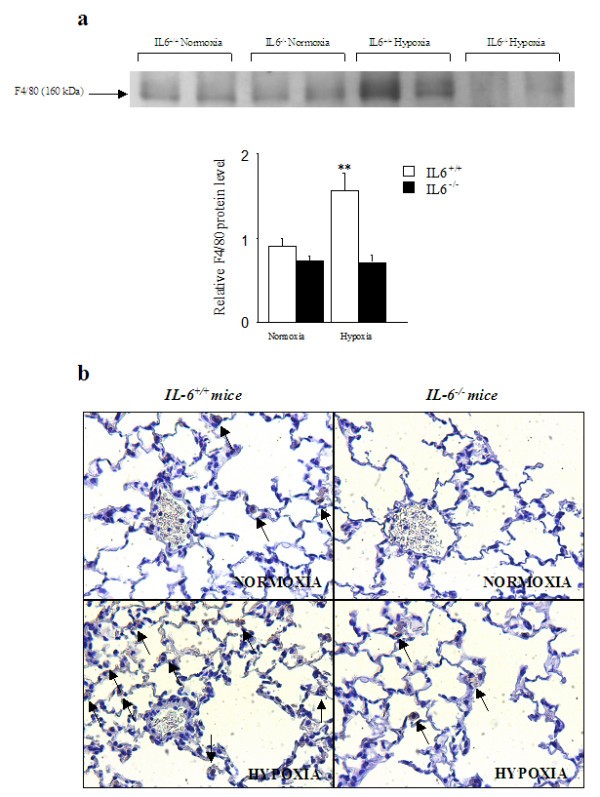
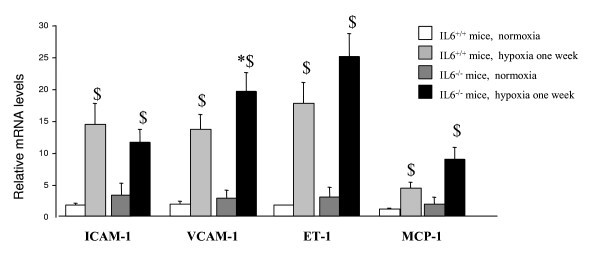
F4/80是一种识别小鼠巨噬细胞受限细胞表面糖蛋白的单克隆抗体,已被广泛用于免疫学研究中描述巨噬细胞群体的特征[28].Western blotting检测野生型小鼠肺F4/80蛋白水平从常氧到缺氧升高,但IL-6不升高-/-老鼠(图4).同样,在缺氧后,肺F4 / 80免疫染色来自IL-6的肺部不太明显-/-小鼠比IL-6更有效+/+老鼠(图4 b).肺炎症标志物VCAM-1、ICAM-1和MCP-1的mRNA水平以及内皮素-1 (ET-1)的mRNA水平在缺氧后明显高于正常缺氧后,而IL-6之间无差异-/-和野生型小鼠(图5).
IL-6和sIL-6-R对PA-SMCs生长和迁移的影响
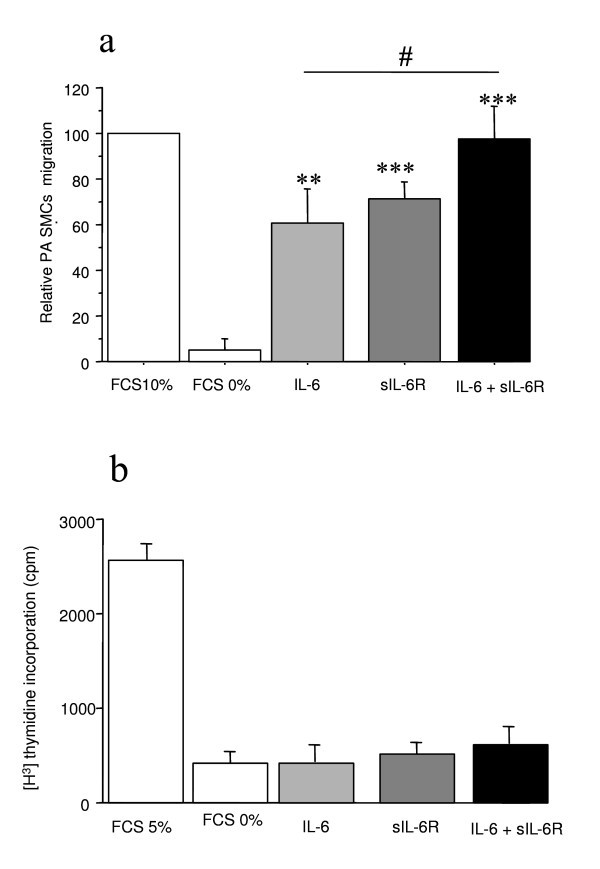
我们发现,静止培养的PA-SMCs中IL-6蛋白和mRNA水平明显高于P-ECs(1.5±0.56 vs. 29.3±5 ng/μg蛋白),P< 0.01和1.2±0.3 vs. 4.4±1.2任意单位,P分别为< 0.05)。缺氧暴露导致PA-SMCs中IL-6 mRNA水平增加3倍,在缺氧暴露4小时后达到峰值(数据未显示)。Transwell迁移实验表明,IL-6 (100 ng/ml)或sIL-6R (100 ng/ml)显著刺激人PA-SMC迁移。IL-6和sIL-6R联合使用进一步增加了PA-SMC的迁移(图)6).用IL-6、sIL-6R或两者治疗PA-SMCs均不会改变[3H]胸苷激酶在人PA-SMCs中的掺入(图)6 b).
IL-6及其可溶性受体sIL-6-R对人肺动脉平滑肌细胞迁移和增殖的影响.使用改良的Boyden’s chamber研究了IL-6及其可溶性受体sIL-6-R对人肺动脉平滑肌细胞迁移的影响(a)。transwell实验表明,IL-6和sIL-6R都能促进PA-SMC的迁移,当IL-6和sIL-6R联合使用时,这种作用更强。每条杠是5个人的平均值±SEM (*P< 0.01, * *P< 0.001 vs基础情况)。[3.h]胸苷掺入培养的肺动脉平滑肌细胞(PA-SMC),5例(B)。将细胞与IL-6,SIL-6R或两者(每种化合物的100ng / ml)孵育,在0.3%胎牛血清(FCS)存在下。值是平均值±SEM。
讨论
本文报道的结果表明,IL-6缺乏可减轻小鼠缺氧PH的发展。我们发现在IL-6中PH和右心室肥厚较轻-/-低氧2周后,小鼠比野生型小鼠的存活率高。il -6缺陷小鼠的肺肌血管数量更少。相反,急性缺氧刺激引起的RVSP升高与IL-6相似-/-和IL-6+/+在normoxia老鼠。暴露于缺氧与肺IL-6表达显著增加相关,体外研究显示,PA-SMCs显著合成IL-6,对急性缺氧的反应进一步增加。IL-6显著促进PA-SMC的迁移而不影响PA-SMC的增殖。缺氧il - 6-/-与低氧野生型小鼠相比,小鼠肺内炎症细胞募集较少,肺内黏附分子或细胞因子表达无差异。综上所述,这些结果支持IL-6在低氧PH进程中调节肺血管炎症和重塑的特定作用。
虽然有力的证据表明炎症细胞因子在pH的发病机制中的作用,但每种特异性细胞因子在肺血管重塑中的累积仍然尚不清楚。我们也没有知道细胞因子的多功能效应如何,协同或独立地影响肺容器壁中炎症和细胞增殖的过程。在这里,我们专注于IL-6,因为我们以前发现COPD患者的pH严重程度与IL-6的血浆水平和遗传变异密切相关[11.].此外,循环IL-6似乎在大多数形式的人pH中增加[4,14.- - - - - -16.],最近几项实验研究报道IL-6在小鼠肺血管重构和缺氧PH中发挥积极作用[24].为了评估IL-6在实验性PH变化中的具体作用,我们研究了暴露于慢性缺氧的小鼠。我们的研究的一个重要发现是,暴露于缺氧与IL-6 mRNA水平的显著和早期上升有关,这导致IL-6蛋白的增加时间更长,持续7天,但随后在第14天恢复到基础水平。在肺血管中,IL-6主要在SMCs中表达,通过对缺氧野生型小鼠肺组织的免疫组化检测和培养细胞的研究表明。我们发现IL-6在P-ECs和PA-SMCs中均有表达,但来自PA-SMCs的IL-6量远远大于来自P-ECs的IL-6量。短期缺氧暴露PA-SMCs也显著刺激IL-6的表达,提示PA-SMCs可能是肺中IL-6的主要来源,特别是在缺氧PH的发展过程中。
这些结果与之前的报道一致,即缺氧诱导培养的血管细胞产生IL-6,短期缺氧小鼠肺血管中IL-6免疫染色明显[20.].在这些研究中,缺氧诱导IL-6通过IL-6启动子中的核因子IL-6位点驱动的增强转录。因此,暴露于缺氧导致IL-6表达的瞬时升高,这并不模拟pH或COPD患者中可持续的IL-6升高。IL-6蛋白的升高持续最多7天,并且在缺氧小鼠2周内在2周内发生的pH,允许我们评估IL-6表达的变化是否影响了我们模型中的pH开发。
另一点是IL-6对靶细胞的作用是由含有IL-6受体(缺乏转导活性)和常见信号转导受体链糖蛋白(gp-130)的质膜受体复合物介导的。我们发现低氧肺中IL-6受体和gp 130的表达均显著增加,持续时间长达14天。因此,暴露于慢性缺氧不仅与肺IL-6水平的大幅增加有关,而且与IL-6受体的表达增加有关。
缺氧2周后,il -6缺陷小鼠的PH值较野生型同窝小鼠轻。慢性缺氧后肺动脉肌化也不明显-/-小鼠比在野生型小鼠中。这些结果与先前的报道一致,表明外源给予IL-6增强了小鼠缺氧pH的发育[21].因此,我们的研究结果支持IL-6在缺氧诱导的PH和肺血管重构的发展中发挥作用。为了研究肺血管重构和PH值的降低是否与肺血管对缺氧反应性的降低有关,我们检测了IL-6对急性缺氧的肺压力反应-/-和IL-6+/+老鼠。这种反应,根据RVSP的增加进行评估,在IL-6中类似-/-和IL-6+/+常氧老鼠。因此,在il -6缺陷小鼠中,PH值的衰减和血管重塑不能用肺血管对缺氧反应性的降低来解释。细胞因子也被证明通过间接机制影响阻力动脉的血管反应性[29].细胞因子不仅可以诱导血管舒张和对血管收缩剂的低反向性,而且还诱导由各种因素介导的内皮素-1和血栓素A2的收缩。虽然我们没有评估我们的小鼠中的肺前列腺素合成,但不太可能介导的ET-1介导的效果,鉴于肺et-1水平在缺氧IL-6之间没有差异没有差异-/-和IL-6+/+老鼠。此外,IL-6表达在许多类型的人和实验pH中似乎增加,包括大鼠中的偏异度诱导的pH,表明IL-6尽管没有缺氧肺血管收缩剂组分,但IL-6可以调节pH的程度。
基础IL-6水平影响肺血管重建和炎症的机制尚不清楚。IL-6是一种多功能细胞因子,影响多种细胞类型。IL-6被认为是一种主要的细胞因子,它可以刺激血管壁细胞表达粘附分子和趋化因子,从而通过刺激炎症细胞募集来增强局部炎症反应。根据这个观点,IL-6-/-小鼠在皮下空气袋中表现出白细胞积聚受损,以及趋化因子的原位产生减少[30.].IL-6刺激的另一个众所周知的作用是表达急性期蛋白,如c反应蛋白和胶原蛋白。另一方面,最近的研究对IL-6潜在的抗炎作用进行了研究。IL-6抑制暴露于脂多糖的巨噬细胞中促炎细胞因子IL-1和TNF的生成,并减弱气管内给予脂多糖的炎症反应[31,32].同样,最近据报道,IL-6缺乏症以增强Apoe中的动脉粥样硬化病变-/-老鼠(33].
因为在IL-6中已经报道了局部炎症反应的改变-/-老鼠(34],我们研究IL-6是否有反应-/-慢性缺氧小鼠与野生型小鼠在肺部炎症细胞募集、黏附分子和趋化因子表达方面存在差异。正如预期的那样,我们的肺F4/80蛋白水平和免疫染色结果表明,低氧的IL-6减少了肺中巨噬细胞的积聚-/-与野生型对照组相比。这些结果与IL-6对炎症细胞募集到炎症部位的体内刺激一致。我们没有明确指出缺氧在肺中产生局部炎症反应的机制。然而,我们发现,在野生型小鼠中,缺氧时粘附分子ICAM-1和VCAM-1以及细胞因子MCP-1的表达明显高于正常缺氧时的表达。令人惊讶的是,在缺氧时,IL-6也出现了类似的增加-/-提示ICAM-1、VCAM-1和MCP-1的表达仅部分受到IL-6的影响。因此,缺氧早期肺IL-6水平的升高可能被视为缺氧引起的全肺炎症反应的一部分,IL-6在介导炎症细胞募集中发挥作用。事实上,低氧PH在IL-6中不那么严重-/-尽管粘附分子和细胞因子有类似的增加,但IL-6在肺血管重塑过程中发挥了特定的作用,或通过炎症细胞募集介导的间接作用。
因此,我们研究了外源性添加IL-6是否影响PA-SMC的迁移和增殖,并发现IL-6或其可溶性受体sIL-6R显著刺激人PA-SMC的迁移。IL-6及其可溶性受体sIL-6R的结合进一步增加了PA-SMC的迁移。相比之下,用IL-6、sIL-6R或两者治疗PA-SMCs并没有改变[3H]胸苷激酶在人PA-SMCs中的掺入。这些作用与已经建立的含有IL-6受体(缺乏转导活性)和常见信号转导受体链gp-130(糖蛋白-130)的质膜受体复合物介导IL-6对靶细胞的作用是一致的。尽管信号传感器元件gp-130存在于许多细胞类型中,IL-6受体似乎只在对IL-6有生理反应的细胞中表达。外源IL-6添加到人PA-SMCs中,即使在sIL-6R存在的情况下也不能促进增殖。然而,IL-6显著刺激PA-SMC的迁移。这些数据,以及我们的发现,暴露于慢性缺氧与肺IL-6R和gp-130 mRNA水平的表达增加有关,强烈提示IL-6可能部分作为慢性缺氧期间PA-SMC迁移的诱导因子。
添加SIL-6R单独刺激的PA-SMC迁移,并添加IL-6和SIL-6R产生更高水平的刺激。我们将SIL-6R诱导的刺激单独解释为PA-SMC产生的IL-6的自分泌效果,除了人体主动脉的SMC也由其他人进行的观察结果[35].因此,用培养的PA-SMC获得的数据表明PA-SMC可以是IL-6的生理靶标,其作为P-EC或PA-SMC分别在P-EC或PA-SMS产生后作为旁静脉或作为自分泌因子。
本研究的一个结论是IL-6在暴露于缺氧期间肺炎和肺血管重塑。IL-6可能有助于血管重塑的机制是不完全理解的。IL-6受体不仅由炎性细胞表达,而且表达了本构型血管壁细胞。因此,肺容器细胞和炎性细胞都可以是IL-6的靶标。由于缺氧IL-6-/-我们研究中的小鼠在肺中表现出炎症 - 细胞募集和血管壁重塑的降低,目前尚不清楚IL-6是否通过直接靶向血管 - 壁细胞或通过炎性细胞介导的间接效应影响肺血管重塑。此外,已显示抗炎药物影响急性暴露于缺氧的早期表现[36].因此,目前的数据和先前发表的研究表明,IL-6可能通过多种机制影响血管重构,包括对血管通透性的短暂影响[37,对炎症细胞募集有积极作用[34,直接刺激血管平滑肌迁移或间接影响血管平滑肌增殖介导的血管壁重塑刺激
该研究的一个重要局限性是,与某些类型的人类PH值(如与COPD相关的PH值,甚至是特发性PH值)相比,IL-6的升高并没有持续。因此,需要进一步的研究来阐明IL-6和其他细胞因子的作用,它们可能协同或独立地参与与肺部炎症相关的各种形式的人类PH的进展。
参考资料
- 1。
Dorfmuller P,Perros F,Balabanian K,Humbert M:肺动脉高压炎症。EUR RESPIR J.2003年,22(2):358 - 363。
- 2。
Tuder RM, Voelkel NF:肺动脉高压和炎症。美国临床医学杂志1998,132(1):16-24。
- 3.
Peinado VI,Barbera Ja,Abate P,Ramirez J,Roca J,Santos S,Rodriguez-Roisin R:轻度慢性阻塞性肺疾病患者肺肌动脉炎症反应am j respir crit care med1999年,159(5 Pt 1):1605 - 1611。
- 4.
Humbert M,Monti G,Brenot F,Sitbon O,Portier A,Grangeot-Keros L,Duroux P,Galanaud P,Simonneau G,Emilie D:严重原发性肺动脉高压患者血清白细胞介素-1和白细胞介素-6浓度升高。am j respir crit care med1995年,151(5):1628 - 1631。
- 5.
Balabanian K, Foussat A, Dorfmuller P, Durand-Gasselin I, Capel F, Bouchet-Delbos L, Portier A, Marfaing-Koka A, Krzysiek R, Rimaniol AC,等.:CX(3)C趋化因子fractalkine在肺动脉高压中的作用。am j respir crit care med2002年,165(10):1419-1425。
- 6.
Schober A,Zernecke A:血管重塑中的趋化因子。Thromb Haemost2007年,97(5):730 - 737。
- 7.
Marasini B, Cossutta R, Selmi C, Pozzi MR, Gardinali M, Massarotti M, Erario M, Battaglioli L, Biondi ML:fractalkine受体CX3CR1多态性与系统性硬化相关性肺动脉高压Clin Dev免疫酚2005年,12.(4):275-279。
- 8.
Dorfmuller P, Zarka V, Durand-Gasselin I, Monti G, Balabanian K, Garcia G, Capron F, Coulomb-Lhermine A, Marfaing-Koka A, Simonneau G,等.:趋化因子RANTES在重度肺动脉高压中的作用。am j respir crit care med2002年,165(4):534-539。
- 9.
Itoh T, Nagaya N, Ishibashi-Ueda H, kytani S, Oya H, Sakamaki F, Kimura H, Nakanishi N:特发性肺动脉高压血浆单核细胞趋化蛋白-1水平升高。呼吸道学2006年,11.(2):158 - 163。
- 10。
Sanchez O, Marcos E, Perros F, Fadel E, Tu L, Humbert M, Dartevelle P, Simonneau G, Adnot S, Eddahibi S:内皮衍生CC趋化因子配体2在特发性肺动脉高压中的作用。am j respir crit care med2007.
- 11.
Eddahibi S Chaouat A, Tu L, Chouaid C, Weitzenblum E, Housset B, Maitre B, Adnot S:白细胞介素-6基因多态性与慢性阻塞性肺疾病的肺动脉高压易感性Proc Am Thorac Soc2006年,3.(6):475-476。
- 12.
岸本老师:白介素-6:多效细胞因子的发现。关节炎res2006年,8(2):S2。
- 13.
tegui A, malat Z:细胞因子在动脉粥样硬化中的作用:致病和调节途径。杂志牧师2006年,86(2):515 - 581。
- 14.
Lesprit P, Godeau B, Authier FJ, Soubrier M, Zuber M, Larroche C, Viard JP, Wechsler B, Gherardi R:诗歌综合征中的肺动脉高压:由细胞因子介导的新功能。am j respir crit care med1998,157(3分1):907-911。
- 15.
Scala E, Pallotta S, Frezzolini A, Abeni D, Barbieri C, Sampogna F, De Pita O, Puddu P, Paganelli R, Russo G:系统性硬化中细胞因子和趋化因子水平:与皮肤和内脏器官受累的关系。中国Exp Immunol2004年,138(3):540 - 546。
- 16.
Yoshio T, Masuyama JI, Kohda N, Hirata D, Sato H, Iwamoto M, Mimori A, Takeda A, Minota S, Kano S:内皮细胞白细胞介素6释放与SLE肺动脉高压的关系。J Rheumatol1997年,24(3):489 - 495。
- 17.
MM, Welte T:全身炎症,COPD和肺动脉高压。胸部2007年,131(2):634 - 635。
- 18.
王广生,钱广生,毛宝林,蔡文强,陈文智,陈宇:[低氧性肺动脉高压大鼠白细胞介素-6和Janus激酶的变化]中华街、河、湖、西杂之2003年,26(11):664 - 667。
- 19.
Yan SF, Ogawa S, Stern DM, Pinsky DJ:低氧诱导内皮细胞性质的调节:屏障功能的调节和白细胞介素-6的表达。肾INT.1997年,51(2):419 - 425。
- 20.
严顺丰,Tritto I, Pinsky D,廖华,Huang J, Fuller G, Brett J, May L, Stern D:缺氧诱导血管细胞白细胞介素6 (IL-6)的研究。核因子- il -6结合位点的核心作用。J Biol Chem.1995年,270(19):11463 - 11471。
- 21.
Golembeski SM, West J, Tada Y, Fagan KA:在小鼠中,白细胞介素-6可引起轻度肺动脉高压并加重缺氧诱导的肺动脉高压。胸部2005年,128.(6):572年代- 573年代。
- 22.
Miyata M, Sakuma F, yoshiura A, Ishikawa H, Nishimaki T, Kasukawa R:大鼠肺动脉高压。2.白细胞介素-6的作用。int arch verlergy免疫素1995年,108.(3):287 - 291。
- 23。
Miyata M, Ito M, Sasajima T, Ohira H, Kasukawa R:5 -羟色胺受体拮抗剂对白细胞介素6所致大鼠肺动脉高压的影响。胸部2001年,119.(2):554-561。
- 24。
Steiner MKSO, Kolliputi N, Mark EJ, Hales CA, Waxman AB:白介素6过表达诱导肺动脉高压。中国保监会Res2008年出版社。
- 25.
KOPF M,Baumann H,Freer G,Freudenberg M,Lamers M,Kishimoto T,Zinkernagel R,Bluethmann H,Kohler G:白细胞介素6缺陷小鼠的免疫受损和急性期反应自然1994年,368.(6469):339 - 342。
- 26.
Adnot S,Raffestin B,Eddahibi S,Braquet P,Chabrier Pe:慢性缺氧大鼠肺循环中内皮依赖性舒张剂活性的丧失。中国投资1991年,87(1):155-162。
- 27.
Eddahibi S,Humbert M,Fadel E,Raffestin B,Darmon M,Capron F,Simonneau G,Dartevelle P,Hamon M,Adnot S:5 -羟色胺转运体过表达与原发性肺动脉高压肺动脉平滑肌增生有关。中国投资2001年,108.(8):1141 - 1150。
- 28.
austin JM, Gordon S:F4 / 80,一种专门针对小鼠巨噬细胞的单克隆抗体。欧元J Immunol1981年,11.(10):805 - 815。
- 29.
Hernanz R,Briones Am,Alonso MJ,Vila E,Salaices M:高血压改变了iNOS、COX-2和氧化应激在LPS诱导大鼠脑动脉缓激肽舒张损伤中的作用。Am J Physiol Heart Circ Physiol2004年,287(1):H225-234。
- 30.
Romano M, Sironi M, Toniatti C, Polentarutti N, Fruscella P, Ghezzi P, Faggioni R, Luini W, van Hinsbergh V, Sozzani S,等.:IL-6及其可溶性受体在诱导趋化因子和白细胞募集中的作用。免疫力1997年,6(3):315 - 325。
- 31。
Ulich Tr,Yin S,Guo K,Yi Es,Remick D,Del Castillo J:气管内注射内毒素和细胞因子。2白介素6和转化生长因子抑制急性炎症。是中草药1991年,138(5):1097 - 1101。
- 32.
Aderka D, Le JM, Vilcek JIL-6在培养的人单核细胞、U937细胞和小鼠中抑制脂多糖诱导的肿瘤坏死因子的产生。J Immunol1989年,143(11):3517 - 3523。
- 33.
scheffer B, Selle T, Hilfiker A, Hilfiker- kleiner D, Grote K, Tietge UJ, Trautwein C, Luchtefeld M, Schmittkamp C, Heeneman S,等.:白细胞介素-6对实验性动脉粥样硬化斑块形成和形态的影响。循环2004年,110.(22):3493 - 3500。
- 34.
Minamino T, Christou H, Hsieh CM, Liu Y, Dhawan V, Abraham NG, Perrella MA, Mitsialis SA, Kourembanas S:血红素氧合酶-1的靶向表达可防止肺部炎症和血管对缺氧的反应。Proc Natl Acad Sci USA2001年,98(15):8798 - 8803。
- 35。
Wang Z, Newman WH:白介素6刺激的平滑肌细胞迁移与细胞骨架重组有关。J Surg Res.2003年,111.(2):261 - 266。
- 36。
Maggiorini M, Brunner-La Rocca HP, Peth S, Fischler M, Bohm T, Bernheim A, Kiencke S, Bloch KE, Dehnert C, Naeije R等.:他达拉非和地塞米松均可降低高原肺水肿的发生率:一项随机试验。安实习生地中海2006年,145(7):497 - 506。
- 37.
Ali MH, Schlidt SA, Chandel NS, Hynes KL, Schumacker PT, Gewertz BL:缺氧时内皮通透性和IL-6的产生:ROS在信号转导中的作用。是杂志1999年,277(5 Pt 1):l1057 - 1065。
确认
我们感谢莫根斯·汤姆森博士提供IL-6-/-老鼠。这项研究得到了INSERM (Ministère de la Recherche)和罕见疾病研究所的资助。根据第6个框架计划(合同编号:LSHM-CT-2005-018725, PULMOTENSION),欧盟委员会也提供了财政支持。本出版物仅反映作者的观点,在任何情况下,欧洲共同体对其所包含的信息的任何使用都不承担责任。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
LS进行了实验工作,进行了数据分析,并起草了手稿。LT, DR, MI参与了实验工作。BM参与了本研究的设计。SA和SE构思假设,建议实验工作,并协助起草手稿。
权利和权限
本文由BioMed Central Ltd授权发表。这是一篇基于知识共享署188滚球软件名许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
Savale,L.,Tu,L.,Rideau,D。et al。白细胞介素-6对小鼠缺氧性肺动脉高压和肺炎症的影响。respir res.10,6(2009)。https://doi.org/10.1186/1465-9921-10-6
收到了:
接受:
发表:
关键字
- 慢性阻塞性肺疾病
- 肺动脉高压
- 慢性缺氧
- 右心室收缩压
- 肺动脉平滑肌细胞