抽象的
介绍
急性呼吸窘迫综合征(ARDS)中肺部修复和纤维化的机制尚不清楚。由于Wnt /β-catenin信号传导的作用似乎是肺愈合和纤维化的核心,我们假设该途径在败血症后肺部急需早期激活。
方法
我们使用一个三步实验设计来检验我们的假设:(1)在体外内毒素照射人支气管上皮BEAS-2B和肺成纤维细胞(MRC-5) 18小时的肺细胞损伤模型;(2)盲肠结扎穿孔致脓毒症急性呼吸窘迫综合征动物模型;(3)脓毒症急性呼吸窘迫综合征24小时内死亡患者肺活检。我们通过Western blot和免疫组化检测了参与Wnt通路的靶基因WNT5A、非磷酸化(Ser33/37/Thr41) β-catenin、基质金属蛋白酶-7 (MMP7)、细胞周期蛋白D1和血管内皮生长因子(VEGF)的蛋白水平变化。最后,我们在实验动物和人肺中验证了该途径的主要基因靶点。
结果
在BEA-2B和MRC-5细胞的内毒素刺激后,WNT5a,非磷酸(Ser33 / 37 / Thr41)β-catenin,总β-catenin,MMP7,Cyclin D1和VEGF的蛋白质水平增加。从脓肠柄动物和脓毒症中肺部肺部证明了急性肺炎,胶原沉积,并显着增加了WNT5a和MMP7蛋白质水平。
结论
我们的研究结果表明,WNT /β-Catenin信号传导途径在败血症诱导的ARDS中非常早期激活,并且可以在肺部修复和纤维化中发挥重要作用。该途径的调节可能代表脓毒症和ARDS患者治疗的潜在靶标。
介绍
急性呼吸窘迫综合征(Acute respiratory distress syndrome, ARDS)是肺肺泡-毛细血管屏障受到肺部或全身损害而引起的一种严重的炎症过程[1] - [3.].Sepsis是最常见的诱导因素,其特征在于响应于循环微生物或微生物毒素如脂多糖(LPS),也称为内毒素,克革兰阴性细菌的细胞壁的组分。败血症和败血症诱导的ARD是与高发病率和死亡率相关的常见综合症[1]、[2]、[4.].肺泡上皮的有效修复需要II型牙槽上皮细胞的增殖和迁移,以及它们分化为I型肺泡细胞[1]、[5.].此外,肺成纤维细胞迁移和增殖发生在肺损伤后的早期,是肺持续愈合所必需的[6.] - [8.].肺泡上皮受损可导致异常修复,最终形成强烈的成纤维细胞反应,导致不受控制的细胞外基质沉积和肺实质结构的破坏[8.]、[9.].
β-catenin介导的无翼整合(Wnt)信号的作用被证明是肺愈合和纤维化机制的中心[10]、[11].组织修复涉及重新上皮化,其中受损细胞被相同类型的细胞代替,并且正常的实质可以被导致纤维化的结缔组织所取代[11].Konigshoff等.[10显示WNT配体可诱导肺上皮细胞增殖、成纤维细胞活化和胶原合成,并在博莱霉素诱导的肺损伤模型和特发性肺纤维化患者中上调。Wnt与同源卷曲受体结合导致β-catenin的细胞质积累,β-catenin随后易位到细胞核并参与基因转录[11] - [13].Wnt /β-catenin信号传导刺激组织重塑和伤口闭合,或通过基质金属肽酶(MMP)和其他基因产物的组织重塑和破坏[14].这种激活刺激了许多参与炎症介导的肺破坏和透明膜形成的促炎细胞因子[12],诱导细胞周期蛋白D1、血管内皮生长因子(VEGF)等生长相关基因的表达[15].MMP7(又称matrilysin)是肺上皮细胞表面发现的Wnt信号通路的靶基因,是肺纤维化的关键调控因子[16].
在本研究中,我们验证了Wnt/β-catenin通路在败血症后很早就在肺中被激活的假设,并在启动肺修复过程中发挥作用。为了验证这一假设,我们使用了一个完善的lps诱导的细胞损伤模型,该模型使用的是基于脓毒症和脓毒症诱导的ARDS发展的第一步的人肺细胞[17] - [21].然后,我们在由盲肠结扎和穿孔(CLP)引起的脓毒症引起的ARDS的临床相关小鼠模型中,以及在脓毒症引起的ARDS前24小时内死亡的患者的肺活检中验证了该通路的主要基因靶点。
材料和方法
在体外学习
我们使用健康的人性支气管上皮细胞(ATCC,Manassas,VA,USA)和人肺MRC-5成纤维细胞。如前所述培养BEA-2B细胞[17在添加了10%胎牛血清、青霉素和链霉素的Dulbecco改良Eagle培养基中,在37°C、5% CO中2, 95%加湿空气培养箱。MRC-5细胞从西班牙拉斯帕尔马斯大学微生物学系(Hospital Universitario Dr Negrín, Las Palmas, Spain)获得,在含有10%胎牛血清的RPMI-1640培养基中培养,在相同的实验条件下。我们选择人BEAS-2B和MRC-5细胞作为研究急性肺损伤变化的代表细胞系,因为这些细胞系之前已经在解决脓毒症诱导的ARDS的第一步的实验模型中被验证[18] - [24].在所有实验中,用100 ng/mL的LPS刺激BEAS-2B和MRC-5细胞大肠杆菌(Sigma-Aldrich,ST路易斯,Mo,USA),在先前研究诱导炎症反应的研究中使用的浓度[18]、[21]并验证研究LPS诱导的效果[22].
抑制细胞增殖
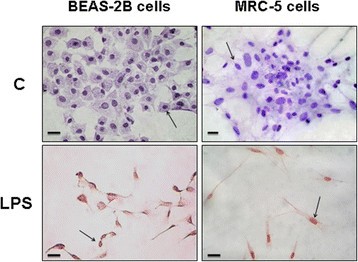
BEA-2B和MRC-5细胞悬挂在5×10中6.细胞/烧瓶接种75厘米2烧瓶。24 h后,将细胞暴露或不暴露于LPS (100 ng/mL) 18 h,然后在相位反差显微镜(Olympus CK-40 F-200, Tokyo, Japan)下检查和拍照(Olympus camera数码相机)。采用Sulforhodamine B比色法(SRB, Sigma-Aldrich)评估LPS对细胞生长的影响[25)(见附加文件1有关详细信息)。
西方墨点法
通过蛋白质印迹测量WNT5a,总β-catenin,非磷酸非磷酸(Ser33 / 37 / Thr41)β-catenin,MMP7,细胞周期蛋白D1和VEGF的蛋白质水平。对于总蛋白质提取物,如前所述,在放射免疫训练测定法(RIPA)蛋白提取物缓冲液中均化细胞均化[26)(见附加文件1有关详细信息)。通过Chion Image软件包(Scion Corp,Frederick,MD,USA)测量了化学发光(Amersham试剂,GE Healthcare,Fairfield,CN,USA)和污点检测到带状的带。
在活的有机体内实验动物模型
在试图翻译在体外观察疾病状态(脓毒症和ARDS),我们对临床相关脓毒症肺损伤实验动物模型进行了肺组织学和免疫组化检查。根据欧洲委员会关于动物实验的指令2010/63/EU,该实验方案由西班牙拉斯帕尔马斯大学尼格林博士医院的动物护理委员会批准(CEEBA#003/10)。这项研究遵循了动物研究:活体实验报告(动物研究:活体实验报告(arrival))指南,用于报告动物研究[27].
我们研究了8只健康雄性Sprague-Dawley大鼠,体重在300至350克之间。腹腔注射氧嗪和氯胺酮麻醉后,将动物随机分为对照组(3只)和败血症组(5只)。关于这个实验模型的详细描述在其他地方有[28].Sham-CLP接受了与CLP大鼠相同的手术程序:盲肠暴露(但未连接或刺破)并返回到腹腔,然后缝合腹壁。18小时后,对照动物和前三个存活的化粪池被麻醉和处死。进行了中线胸廓切开术/剖腹手术,心脏和肺被除去全体.肺部从心脏中分离出来,气管是插管,右肺通过腹腔内滴注3ml 10%福尔马林,并在10%福尔马林中漂浮一周。肺部从顶点串联切成碱并嵌入石蜡中,切割(3μm厚度部分),并用苏木精和曙红染色以进行显微镜观察。两个病理学家(FV,SGH)对样本身份蒙蔽。检查每只动物的三个随机切片,特别是通过肺水肿,炎症细胞浸润,血管充血和纤维化的存在而定义的肺泡和间质损伤。使用尼康Optiphot 2显微镜观看幻灯片,并在尼康数字视线DS-5 M相机(日本东京,日本)拍摄×200放大倍数。
我们还使用了天狼星红染色技术[29]以评估胶原蛋白含量,详情见其他资料[30.].我们将纤维化定义为胶原蛋白的存在。通过这种技术,胶原纤维染色鲜红色,核/细胞质是亮黄色。用奥林巴斯(BX50)显微镜观察幻灯片,并用×200放大率的奥林巴斯数码相机拍摄。
人体肺组织
翻译的在体外和在活的有机体内观察到人类疾病的兴趣状态(脓毒症和ARDS),我们对患者的人肺进行了组织学和免疫组化检查,在他们的严重败血症期间早期死亡。两位病理学家(FV,SGH)分析了2007年至2012年在La Laguna大学医学院,西班牙特内里费岛的病理学部门在2007年至2012年期间进行的12名患者的肺部。豁免道德规范是由医院大学(西班牙,西班牙)的临床研究森林研究伦理委员会授予,因为在患者亲属中获得了知情同意,以便在临床尸检和潜在使用组织样本中的教学和研究目的.具有尸检患者的临床相关信息的匿名摘要存储在病理部的特定数据库中,以便在必要时进行进一步审查。在没有任何肺部受累的疾病死亡的患者中选择了对照肺的六个尸检。脓毒症选自尸检,六个患者在符合严重败血症的标准标准进行标准标准[4.]和ARDS [1] - [3.],谁没有接受机械通风,并在发育严重败血症的前24小时内死亡。要求病理学家在严格的按时间顺序遵循严格的按时间顺序选择尸体,从2012年表演,并在每年向后继续,没有任何偏好或选择偏见。在验证患者的审查后,他们与制度数据库检查过临床诊断。
尸检时收集的肺组织石蜡块从病理档案中检索。在常规尸检中,可获得3至4块肺实质碎片。在正常肺中,从每个肺叶中收集一个肺组织碎片。组织在10%缓冲福尔马林中固定,常规处理和石蜡包埋。切片3 μm厚度,苏木精、伊红染色及Sirius-red染色,评估急性肺损伤情况及胶原蛋白含量。
免疫细胞化学
应用标准的亲和素-生物素复合物技术进行免疫细胞化学染色(见附加文件)1有关详细信息)。要查看幻灯片,我们使用奥林巴斯BX50显微镜和奥林巴斯·柬埔寨数码相机,×400放大率。
统计分析
统计能量分析的样本量计算在两个类别的尸检(没有肺参与的疾病,感染性ARDS),我们估计检测至少增加2倍的免疫染色强度纤维标记(WNT5A MMP7)感染性肺基底强度没有脓毒症的病人相比,我们需要每组6名患者,alpha值为0.05,幂值大于0.80。
数据以均数±SD表示,采用Graph Pad Prism软件5.0版本进行分析。数据来自不同的实验和每个组内的样本。所有实验组的比较采用单因素方差分析。我们使用Bonferroni校正进行多次比较。在western blot实验中,非磷酸化(Ser33/37/Thr41) β-catenin谱带的密度数据归一化为β-catenin和β-actin(作为负载对照),MMP7活性形式(20 kDa)的密度数据归一化为非活性形式(30 kDa),然后归一化为β-actin。数据至少来自三个独立的实验。小动物——一张长有P.-Value <0.05被认为是显着的。
结果
体外研究
LPS抑制MRC-5和BEAS-2B细胞增殖。使用100 ng/mL LPS(数据未显示)在18小时内观察到两种细胞类型对细胞活力的最大影响。
WNT5A及相关蛋白
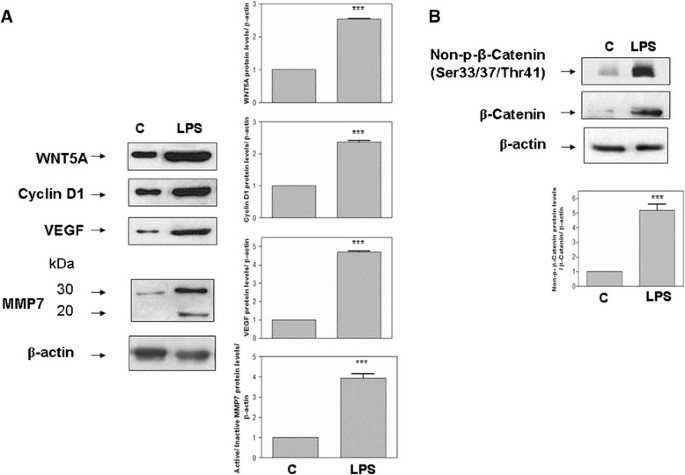
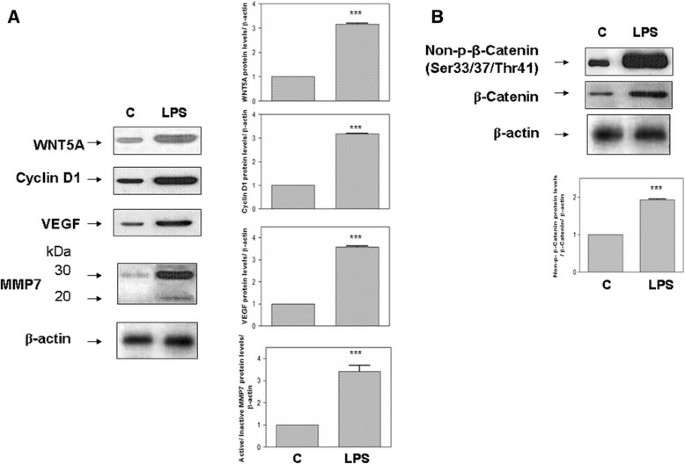
在MRC-5和BEAS-2B细胞中WNT5A蛋白水平显著升高(P.<0.001)1一个和2一个分别的)。LPS刺激导致非磷酸的显着增加(SER33 / 37 / THR41)β-连环蛋白(图1B,2B). MMP7蛋白的活性形式在LPS刺激的MRC-5和BEAS-2B细胞中均增加。LPS处理也导致cyclin D1和VEGF上调(图)1一种,2一种)。在用LPS刺激的MRC-5和BEA-2B细胞核中检测免疫细胞化学染色的非磷酸SER33 / 37 /thr41β-catenin(图3.).
人MRC-5细胞中LPS刺激的WNT5A/β-catenin通路的代表性western blot检测。(一)WNT5A总量的变化,细胞周期蛋白D1, metallopeptidase 7 (MMP)和血管内皮生长因子(VEGF)蛋白后暴露在100 ng / mL脂多糖(LPS)刺激了18 h。活性形式的微密度分析(20 kDa) MMP7是归一化的活动形式(30 kDa),然后归一化β肌动蛋白。(B)18小时后LPS刺激后非磷酸SER33 / 37 /THR41β-Catenin的变化。在每个条件下至少三种不同的墨水进行密度测定,并向各自的负载控制(β-肌动蛋白)归一化。相对于相应的对照载体表示蛋白表达式为折叠变化(C).***P.<0.001与对照组比较(C).
动物模型
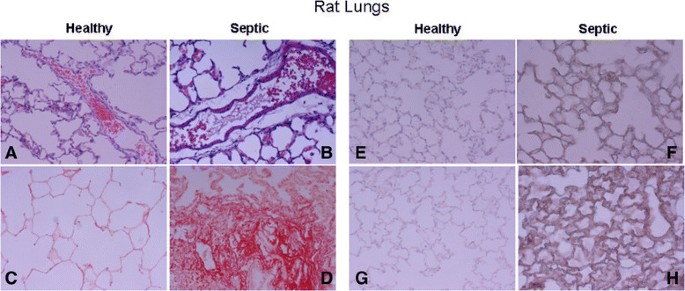
CLP引起的典型疾病症状包括嗜睡、皮毛皱褶、全身无力、大肌肉活动减少和体重减轻,相应的文献[28].5只败血性动物中有3只在CLP后18小时存活,这些动物被进一步研究。脓毒症动物的肺显示急性炎症浸润,血管周围水肿,实质胶原沉积(图)4.,面板b)。胶原蛋白的Sirius-Red染色在对照动物中是阴性的(图4.,小组d)。健康对照动物具有WNT5a和MMP7的基础强度,而脓毒性肺部显示出WNT5a和MMP7的强免疫组化强度(图4., F和H)。
人体肺部的解剖结果
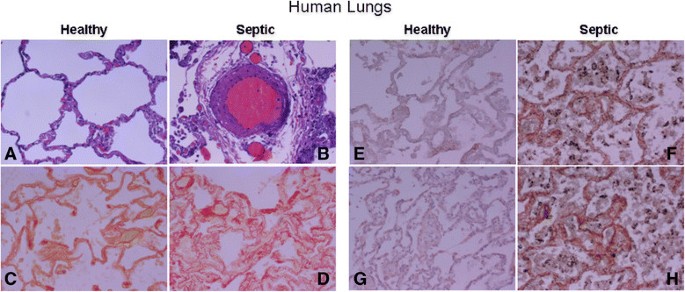
6例死于脓毒性急性呼吸窘迫综合征的患者和6例在发病24小时内死于非肺部原因的对照组的临床诊断见表1.无肺部疾病死亡患者的肺部未发现相关发现。脓毒症患者肺表现为弥漫性肺损伤,表现为急性炎症浸润和血管周围水肿(图)5.,面板b)。来自脓毒症患者的肺部在实质中表现出高强度的胶原蛋白的地区,提供了败血症肺损伤的早期阶段存在纤维化反应的证据(图5.无肺部疾病患者的肺显示WNT5A和MMP7的基础强度,而脓毒症患者的肺显示WNT5A和MMP7的强免疫组化强度(图)5., F和H栏)
讨论
我们检测了WNT/β-catenin通路在lps诱导的人肺细胞损伤模型中的翻译影响,并在脓毒症实验动物的肺和尸体解剖的人肺中验证了该通路的主要基因靶点。本研究的主要发现是:(1)WNT5A在LPS作用下很早就被人气道上皮细胞和肺成纤维细胞表达;(2) WNT5A和非磷酸化Ser33/37/Thr41 β-catenin表达上调与损伤组织促纤维化转化下游靶基因如MMP7、cyclin D1、VEGF表达上调相关;(3)脓毒症引起的急性呼吸窘迫综合征(ARDS)在实验和临床中都很早就发生肺纤维化。这些结果表明,WNT5A和β-catenin在脓毒症诱导的ARDS中很早就参与肺组织损伤的修复,并可能在重建肺结构中发挥作用。
我们选择了BEA-2B和MRC-5细胞系作为代表性的人气气道上皮细胞和肺成纤维细胞,因为这些细胞已涉及败血症诱导的ARDS的发病机制[18] - [24]及随后的纤维化[31].这些细胞模型提供了强大的转译功能在体外回顾人类急性呼吸窘迫综合征的方法。lps处理的人类BEAS-2B细胞已被接受并得到验证在体外基于败血症和败血症诱导的ARDS发育的第一步的急性肺炎抗应激细胞损伤模型[18].肺气道上皮细胞和成纤维细胞产生各种免疫效应器,例如细胞因子,趋化因子和几种肽,响应炎症刺激[23]、[32],控制肺炎,肺损伤和肺部修复[9.]、[12]、[31]、[33].我们选择了大肠杆菌因为它已被用于大多数内毒素诱导的肺损伤模型[21]、[34], LPS是脓毒症的关键病原体识别分子[33]、[34].因为之前在体外使用lps刺激的气道上皮细胞和成纤维细胞的研究聚焦于促炎介质的激活和细胞因子释放的增加[20.]、[35]、[36,我们检测了WNT5A、β-catenin、MMP7、cyclin D1和VEGF分子对肺修复和纤维化的调节[12]、[16]、[37].
我们扩展我们的在体外通过证实在临床相关脓毒症致肺损伤模型和死于严重脓毒症和ARDS患者的肺中,胶原合成和该通路的主要靶基因产物(WNT5A, MMP7)增加。我们使用CLP作为临床相关且特征明确的动物模型来探索脓毒症前24小时肺纤维化转变。根据以往的研究,CLP诱发了可重复且一致的脓毒症和败血症诱发的ARDS [17]、[28].clp诱导的动物急性呼吸窘迫综合征的组织病理学特征包括肺不张、肺水肿和急性炎症浸润。90%死于败血症的患者观察到肺组织损伤[38].此外,肺细胞可以激活启动组织修复的机制,这一过程涉及再上皮化;受损细胞被同种细胞所取代,但在某些情况下,正常实质被结缔组织所取代,导致纤维化[11].有证据表明急性呼吸窘迫综合征早期出现纤维化[26]、[39]、[40].β-catenin信号通过MMPs刺激组织重塑、细胞迁移和伤口愈合,但如果这一过程不受控制,它可以通过MMPs和其他介质驱动组织破坏[11].Wnt配体诱导肺上皮细胞增殖,成纤维细胞活化和胶原合成[16].胶原等基质细胞外分子是细胞外基质的主要成分,MMP7是肺纤维化的关键中介[16].
几个wnt.基因在显影和成人肺中表达。这些,Wnt5a和Wnt7b在气道上皮中高水平表达[14].我们选择检测WNT5A的调节,因为它与几种肺部疾病有关[11尚未在脓毒症和脂多糖诱导的ARDS背景下进行研究。在我们的研究中,WNT5A在CLP大鼠和死于早期感染性ARDS的人的肺中以中等强度检测到肺泡壁和肺间隔。布卢门撒尔等.[41报道称Wnt5a所需的Toll样受体信号传导和NF-κB活化的表达。在我们组的先前报告中,并使用与本研究中的相同的上皮细胞损伤模型,我们表明LPS通过Toll样受体信号传导调节NF-κB激活[22].β-catenin在我们的上皮/成纤维细胞损伤模型中迅速上调,这一事实表明,在ARDS期间,WNT/β-catenin通路可能被持续刺激,这可能是肺损伤持续或启动肺修复的一种机制。因此,脓毒症诱导的ARDS后Wnt信号的激活可能代表了受损上皮的再生信号[42].使用表达微阵列,Vuga等.[43表明肺纤维化患者肺组织中分离出的成纤维细胞WNT5A较正常肺组织中分离出的成纤维细胞明显升高。他们还报道,当正常肺成纤维细胞被WNT5A处理时,细胞增殖增加。
我们的研究结果平行于辣椒等.[44发现特发性肺纤维化患者的肺中有异常的WNT/β-catenin通路激活,提示该通路可能负责功能失调的肺修复过程,导致严重和不可逆的肺重构。这是一个相关的转译发现,因为肺纤维化的发展已被发现与ARDS患者肺损伤的严重程度和死亡率直接相关[45].细胞周期调控分子cyclin D1基因是Wnt/β-catenin信号通路的靶基因之一,VEGF是维持成人肺泡结构所必需的。任何组织修复都涉及协调的细胞浸润、细胞外基质沉积和再上皮化。细胞外基质的蛋白降解需要由Wnt信号调控的MMPs。目前还不清楚为什么在一些患者中,ARDS的缓解涉及到纤维化,而在另一些患者中不涉及。western blot分析Wnt靶基因产物cyclin D1和MMP7, Königshoff等.[16与没有肺纤维化的患者相比,证明了肺纤维化中的功能性Wnt /β-catenin信号传导。作等.[46]利用微阵列技术分析了肺纤维化患者的样本,发现MMP7.是最具上调的基因,一种通过免疫组织化学证实的发现。在我们的研究中,Cyclin D1,VEGF和MMP7的表达增加支持WNT信号传导在肺炎期间WNT信号传导的重要性,并在败血症诱导的ARDS期间提供了对Pro-Fibrotic反应的早期发展的见解。对WNT表达调节剂的更大了解和WNT蛋白在类似模型中的影响对于阐明该途径在肺炎和修复中的作用至关为至关重要的。
我们的研究确实有一些局限性。首先,虽然本研究使用的动物模型是CLP,但我们检查了不同类型感染性ARDS患者的尸检。然而,没有数据表明在严重脓毒症期间不同的肺纤维化反应中,肺损伤与非肺损伤之间有任何具体的区别。在酸吸入性肺损伤模型中,我们发现了与脓毒性模型相似的纤维化转化[26].最近的一项研究[40]的研究表明,肺纤维化是ARDS患者的一种早期病理反应,与病因的肺或肺外性质无关。第二,我们没有探索Wnt通路的抑制剂的影响辩驳证明Wnt通路的激活肺脓毒性侮辱负责upregulation的下游靶基因(如MMP7、细胞周期蛋白D1, VEGF)参与pro-fibrotic转换受伤的组织。然而,其他研究人员对Wnt/β-catenin信号通路选择性抑制的研究[44]、[47]、[48]表明Wnt /β-catenin途径是抗炎症和抗纤维化作用的靶标。
结论
总之,我们的研究结果表明,Wnt /β-catenin途径可能有助于肺炎,并导致ARDS早期阶段的促纤维化反应。我们观察到Wnt5a,Cyclin D1,VEGF和MMP7的表达增加,所有这些都是如此wnt.靶基因产品在肺纤维化中起重要作用。需要进一步的研究来充分解决关于WNT信号传导途径的未解决问题,用于在败血症诱导的ARDS设置中衰减肺部炎症并提高肺部分辨率并作为预防或治疗方法的修复。
关键信息
Wnt信号的作用被证明是肺愈合和纤维化机制的中心
Wnt/β-catenin通路在败血症后很早就在肺中被激活,并在启动肺修复过程中发挥作用
Wnt/β-catenin通路的调控可能是脓毒症和ards诱导的肺纤维化患者治疗的一个潜在靶点
附加文件
缩写
- ARDS:
-
急性呼吸窘迫综合征
- CLP:
-
盲肠结扎和穿刺
- FBS:
-
胎牛血清
- 有限合伙人:
-
脂多糖
- MMP:
-
金属肽酶
- MMP7:
-
金属肽酶(或金属蛋白酶)7(也称为基质酶)
- VEGF:
-
血管内皮生长因子
- WNT5A:
-
无翼型集成站点家族,成员5A
参考
- 1.
急性呼吸窘迫综合征。中华医学杂志,2000,31(4):334- 349。10.1056 / NEJM200005043421806。
- 2.
Villar J:什么是急性呼吸窘迫综合征?呼吸科。2011,56:1539-1545。10.4187 / respcare.01395。
- 3.
Villar J, Blanco J, Añón JM, Santos-Bouza A, Blanch L, Ambrós A, Gandía F, Carriedo D, Mosteiro F, Basaldúa S, Fernández RL, Kacmarek RM: ALIEN研究:肺保护性通气时代急性呼吸窘迫综合征的发生率和结局。重症监护医学。2011,37:1932-1941。10.1007 / s00134 - 011 - 2380 - 4。
- 4.
Angus DC,Linde-Zwirble WT,Lidicker J,Clermont G,Carcillo J,Pinsky Mr:美国严重败血症的流行病学:发病率,结果和相关费用分析。灌区护理med。2001,29:1303-1310。10.1097 / 00003246-200107000-00002。
- 5.
Shimabukuro DW,Sawa T,Gropper Ma:肺和航空公司的伤害和修复。灌区护理med。2003,31:S524-S531。10.1097 / 01.CCM.0000081437.06466.B3。
- 6.
急性肺损伤中ⅲ型前胶原肽的早期检测:病理和预后意义。急性呼吸危重症急救医学杂志,1997,15:840-845。10.1164 / ajrccm.156.3.9701124。
- 7.
Horowitz JC,Cui Z,Moore Ta,Meier TR,Reddy Rc,Toews GB,Standiford TJ,Thannickal VJ:非溶解急性呼吸窘迫综合征患者患者分离的肺泡间充质细胞中抗衰性信号的组成型激活。AM j Physiol肺细胞Mol pymiol。2006,290:L415-L425。10.1152 / ajplung.00276.2005。
- 8.
Marshall RP, Bellingan G, Webb S, Puddicombe A, Goldsack N, McAnulty RJ, Laurent GJ:纤维增生发生在急性呼吸窘迫综合征早期及其对预后的影响。重症呼吸危重症护理杂志。2000,162:1783-1788。10.1164 / ajrccm.162.5.2001061。
- 9.
特发性肺纤维化:上皮/成纤维细胞交叉对话障碍。呼吸学报2002,3:31-10.1186/rr175。
- 10.
KONIGSHOFF M,KRAMER M,Balsara N,WILHELM J,AMARIE OV,JAHN A,Rose F,Fink L,Seeger W,Schaefer L,Günthera,eickelberg O:Wnt1-Invucible信号蛋白-1介导小鼠肺纤维化具有特发性肺纤维化的人类上调。J Clin Invest。2009,119:772-787。
- 11.
Wnt信号在肺发育和疾病中的作用。中国海洋大学学报(自然科学版),2006,7:15-10.1186/1465-9921-7-15。
- 12.
Crosby LM, Waters CM:肺上皮修复机制。国家自然科学基金青年科学基金。10.1152 / ajplung.00361.2009。
- 13.
STAAL FJ,NOORT MM,令人担保的GJ,CHEVERS HC:WNT信号通过N末端去磷酸化的β-连环蛋白传输。Embo Rep。2002,3:63-68。10.1093 / EMBO-REPORTS / KVF002。
- 14.
Morrisey EE: Wnt信号与肺纤维化。中华病理杂志。2003,16:1393-1397。10.1016 / s0002 - 9440 (10) 64271 - x。
- 15.
Nelson WJ,Nusse R:WNT,Beta-catenin和Cadherin途径的收敛性。科学。2004,303:1483-1487。10.1126 / Science1094291。
- 16.
KONIGSHOFF M,Balsara N,PFAFF EM,KRamer M,Chrobak I,Seeger W,Eickelberg O:功能性Wnt信号在特发性肺纤维化中增加。Plos一个。2008,3:e2142-10.1371 / journal.pone.0002142。
- 17.
Villar J, Cabrera N, Casula M, Flores C, Valladares F, Muros M, Blanch L, Slutsky AS, Kacmarek RM:机械通气在脓毒症诱导的肺损伤模型中调节toll样受体信号通路。重症监护医学。2010,36:1049-1057。10.1007 / s00134 - 010 - 1799 - 3。
- 18.
Koyama S, Sato E, Nomura H, Kubo K, Miura M, Yamashita T, Nagai S, Izumi T:各种脂多糖释放IL-8和G-CSF的潜力。国家自然科学基金青年科学基金青年科学基金。
- 19.
Pugin J,Dunn-Siegrist I,Dufour J,TissièresP,Charles Pe,Comte R:循环拉伸人肺细胞诱导酸化并促进细菌生长。am J respir细胞摩尔Biol。2008,38:362-370。10.1165 / rcmb.2007-0114oc。
- 20.
Boots AW, Gerloff K, Bartholomé R, van Berlo D, Ledermann K, Haenen GR, Bast A, van schoten FJ, Albrecht C, Schins RP:中性粒细胞增强人肺上皮细胞中lps介导的促炎信号。Acta botanica sinica(云南植物研究与开发),2012,30(5):531 - 534。
- 21.
Fortis S, Spieth PM, Lu WY, Parotto M, Haitsma JJ, Slutsky AS, Zhong N, Mazer CD, Zhang H:麻醉对急性肺损伤大鼠炎症反应的影响。重症监护医学。2012,38:1548-1555。10.1007 / s00134 - 012 - 2610 - 4。
- 22.
Cabrera-benitez Ne,Pérez-roth e,Casula M,Ramos-Nuez A,Ríos-luci C,Rodríguez-Gallego C,Sologuren I,Jakubkiene V,Slutsky As,PadrónJM,Villar J:一种小说的抗炎活动内毒素诱导的气道上皮细胞损伤模型中的芳基脲的家族化合物。Plos一个。2012,7:e48468-10.1371 / journal.pone.0048468。
- 23.
何志强,高艳,邓艳,李伟,陈勇,邢胜,赵旭,丁建军,王学军:脂多糖通过toll样受体4信号通路和磷酸肌苷3-激酶- akt通路诱导肺成纤维细胞增殖。公共科学图书馆。2012,7:e35926-10.1371/journal. pon. 0035926。
- 24.
Cohen M,Marchand-Adam S,LeCon-Malas v,Marchal-Somme J,Boutton A,Durand G,Crestani B,Dehhoux M:人肺成纤维细胞的HGF合成由OncostatinM.AM J Physiol肺细胞Mol Physiol调节。2006,290:L1097-L1103。10.1152 / ajplung.00166.2005。
- 25.
Skehan P,Storeng R,Scudiero D,僧侣A,McMahon J,Vistica D,Warren JT,Bokesch H,Kenney S,Boyd Mr:抗癌药物筛选的新比色细胞毒性测定。J Natl Cancer Inst。1990,82:1107-1112。10.1093 / JNCI / 82.13.1107。
- 26.
Cabrera-Benitez Ne,Parotoy M,Post M,Han B,Spieth PM,Cheng We,Valladares F,Villadares F,Villar J,Liu M,Sato M,Zhang H,Slutsky AS:机械应力通过上皮 - 间充质转换引起肺纤维化。灌区护理med。2012,40:510-517。10.1097 / CCM.0B013E31822F09D7。
- 27.
Kilkenny C, Browne WJ, Cuthill IC, Emerson M, Altman DG:改进生物科学研究报告:动物研究报告的ARRIVE指南。PLoS biology . 2010, 8: e1000412-10.1371/journal.pbio.1000412。
- 28.
Rittirsch D,Huber-Lang Ms,Flierl Ma,Ward PA:通过盲肠结扎和穿刺实验性败血症免疫诊断。NAT PROTOC。2009,4:31-36。10.1038 / nprot.2008.214。
- 29.
Malkusch W,Rehn B,Bruch J:Sirius红染色的优点是肺部定量形态胶原蛋白测量。Exp Lung Res。1995年,21:67-77。10.3109 / 01902149509031745
- 30.
Martínez-GalánL,德利多尼沃·吕,迪拉斯 - 吉尔JJ,佩扎尔斯·曼加多,Peces-Barba G:肝生长因子改善大鼠中镉施用的肺纤维化。拱形龙罐。2010,46:20-26。10.1016 / J.ARBRES.2009.10.006。
- 31.
AOKI Y,Maeno T,Aoyagi K,Ueno M,Aoki F,Aoki N,Nakagawa J,Sando Y,Shimizu Y,Suga T,Arai M,Kurabayashi M:Pioglitazone,过氧化物酶促增殖物激活的受体γ配体,抑制博莱霉素 -诱导急性肺损伤和纤维化。呼吸。2009,77:311-319。10.1159 / 000168676。
- 32.
细胞因子在肺部先天性宿主防御中的作用。中国临床医学杂志。2002,19(4):513 - 513。10.1172 / JCI0215277。
- 33.
关键词:气道上皮,NF-kappa B,炎症,损伤,气道炎症中国生物医学工程学报。10.4049 / jimmunol.178.10.6504。
- 34.
林文杰,叶卫文:toll样受体和肿瘤坏死因子信号在感染性休克中的意义。冲击。2005,24:206-209。shk.0000180074.69143.77 10.1097/01.。
- 35.
Koyama S, Sato E, Nomura H, Kubo K, Miura M, Yamashita T, Nagai S, Izumi T:各种脂多糖释放肺上皮细胞和成纤维细胞单核细胞趋化活性的潜力。王志强,王志强。10.1034 / j.1399-3003.1999.14c11.x。
- 36.
Macredmond R,Singhera GK,Dorscheid Dr:促红细胞生成素抑制急性肺损伤模型中的呼吸上皮细胞凋亡。EUR RESPIR J. 2009,33:1403-1414。10.1183 / 09031936.00084608。
- 37.
Stockmann C, Kerdiles Y, Nomaksteinsky M, Weidemann A, Takeda N, Doedens A, Torres-Collado AX, Iruela-Arispe L, Nizet V, Johnson RS:骨髓细胞来源的血管内皮生长因子的缺失加速纤维化。中国科学(d辑:地球科学),2010,32(6):734 - 741。10.1073 / pnas.0912766107。
- 38.
Torgersen C, Moser P, Luckner G, Mayr V, Jochberger S, Hasibeder WR, Dünser MW: 235例败血症外科重症监护患者的肉眼尸检结果。王志强。2009,108:1841-1847。10.1213 / ane.0b013e318195e11d。
- 39.
Cabrera-Benitez NE, Laffey JG, Parotto M, Spieth PM, Villar J, Zhang H, Slutsky AS:机械通气相关肺纤维化在急性呼吸窘迫综合征中的作用。麻醉学杂志。2014。10.1097 / ALN.0000000000000264。
- 40.
Ichikado K, Muranaka H, Gushima Y, Kotani T, Nader HM, Fujimoto K, Johkoh T, Iwamoto N, Kawamura K, Nagano J, Fukuda K, Hirata N, Yoshinaga T, Ichiyasu H, Tsumura S, Kohrogi H, Kawaguchi A, Yoshioka M, Sakuma T, Suga M:急性呼吸窘迫综合征高分辨率CT上纤维增生性改变预测死亡率和呼吸机依赖:一项前瞻性观察队列研究bmjopen . 2012, 2: e000545-10.1136/bmjopen-2011-000545。
- 41.
Blumenthal A,Ehlers S,Lauber J,Buer J,Lange C,Goldmann T,Heine H,Brandt E,Reing N:The Wingless Homolog Wnt5a及其受体Frize-5调节通过微生物刺激诱导的人单核细胞的炎症反应。血。2006,108:965-973。10.1182 /血液-2005-12-5046。
- 42.
Königshoff M, Eickelberg O: WNT信号在肺部疾病中的作用:失败还是再生信号?中华医学会细胞生物学分会。10.1165 / rcmb.2008 - 0485 tr。
- 43.
Vuga LJ, Ben-Yehudah A, Kovkarova-Naumovski E, Oriss T, Gibson KF, Feghali-Bostwick C, Kaminski N: WNT5A是成纤维细胞增殖和抗凋亡的调节因子。中国生物医学工程杂志。2009,41:583-589。10.1165 / rcmb.2008 - 0201摄氏度。
- 44.
Chilosi M, Poletti V, Zamò A, Lestani M, Montagna L, Piccoli P, Pedron S, Bertaso M, Scarpa A, Murer B, Cancellieri A, Maestro R, Semenzato G, Doglioni C:特发性肺纤维化中Wnt/ β -catenin通路的异常激活。中华病理杂志,2003,16(4):491 - 498。10.1016 / s0002 - 9440(10) 64282 - 4。
- 45.
急性呼吸窘迫综合征的肺实质重建。王志强。2009,19(4):514 - 514。
- 46.
Zuo F, Kaminski N, Eugui E, Allard J, Yakhini Z, Ben-Dor A, Lollini L, Morris D, Kim Y, delstro B, Sheppard D, Pardo A, Selman M, Heller RA:基因表达分析显示母系蛋白是小鼠和人类肺纤维化的关键调控因子。美国国家科学院学报。2002年,99:6292 - 6297。10.1073 / pnas.092134099。
- 47.
Jenei V,Sherwood V,Howlin J,Linnskog R,SäfholmA,Axelsson L,Andersson T:一种叔丁基氧基羰基改性的WNT5A衍生的己肽作为WNT5A依赖性黑素瘤细胞侵袭的有效拮抗剂。美国国家科学院学报。2009,106:19473-19478。10.1073 / pnas.0909409106
- 48.
亨德森WR,Chi Ey,Ye X,Nguyen C,Tien YT,周B,Borok Z,Khight Da,Kahn M:Wnt / Beta-catenin / Creb结合蛋白(CBP)信号传导的抑制反转肺纤维化。Proc Natl Acad Sci U S A. 2010,107:14309-14314。10.1073 / pnas.1001520107。
确认
来自西班牙马德里的Instituto de Salud Carlos III的赠款(PI10 / 0393,CB06 / 06/1088)部分支持。作者要感谢微生物学系(医院Universitario Negrin博士,Las Palmas de Gran Canaria,Spain),用于提供MRC-5细胞。
作者信息
从属关系
相应的作者
额外的信息
利益争夺
两位作者宣称他们没有相互竞争的利益。
作者的贡献
JV构思和设计研究,获得资金,进行动物实验,协调数据收集和数据质量,进行统计分析,参与手稿的起草。NECB进行了分子研究,参与了研究的设计,进行了统计分析并帮助起草了手稿。ARN进行分子研究,进行动物实验,对数据的获取和分析做出了重大贡献,并帮助起草了手稿。CF参与了研究设计和统计分析,对分子数据的解释做出了重要贡献,并帮助起草了手稿。SGH进行了组织学和免疫组化研究,对研究设计做出了重大贡献,对数据的获取、分析和解释做出了贡献,并帮助起草了手稿。FV进行了组织学和免疫组化研究,对研究设计做出了重大贡献,对数据的获取、分析和解释做出了贡献,并帮助起草了手稿。JLA参与了研究的设计,帮助对数据的解释做出了实质性的贡献,并帮助起草了手稿。LB参与了这项研究的设计,帮助对数据的解释做出了实质性贡献,并帮助起草了手稿。ASS参与了研究的设计,对数据的解释做出了实质性的贡献,并参与了手稿的起草。所有作者阅读并批准了最终的手稿。
电子辅料
13054 _2014_568_moesm1_esm.doc
附加文件1:关于以下方法的补充信息:(i)形态学分析和细胞增殖抑制,(ii) western blot分析和(iii)免疫组化。(医生63 KB)
作者为图像提交的原始文件
权利和权限
关于这篇文章
引用这篇文章
维拉尔,J., Cabrera-Benítez, n.e.,拉莫斯-纽兹,A.。等等。脓毒症诱导急性肺损伤中促纤维化WNT5a的早期激活。灌区护理18日,568(2014)。https://doi.org/10.1186/s13054-014-0568-z
收到了:
公认:
发表:
关键词
- 血管内皮生长因子
- 特发性肺纤维化
- 肺纤维化
- 急性呼吸窘迫综合征
- 急性呼吸窘迫综合征患者