文摘
我们探索潜在的巨噬细胞表型在COPD发病机制失调通过综合研究人类小气道组织,支气管肺泡灌洗(BAL)和慢性阻塞性肺病的实验小鼠模型。我们评估人类气道组织和BAL从健康对照组,肺功能正常的吸烟者(独立)和慢性阻塞性肺病。小型航空公司和BAL细胞免疫组织化学沾anti-CD68为平方米,总巨噬细胞和anti-CD163 anti-iNOS M1巨噬细胞。多路复用ELISA测定BAL细胞因子。与香烟烟雾诱发慢性阻塞性肺病实验小鼠模型评估了相关的mRNA的概要文件。我们发现增加促炎m1 nlf和慢性阻塞性肺病的小型航空公司相比,控制与互惠M2巨噬细胞减少,病理组织中保持不变。然而,腔的巨噬细胞显示出主导M2表型nlf和慢性阻塞性肺病。细胞因子平衡偏向与增加CCL22 M2概要文件,il - 4, IL-13, il - 10在独立和慢性阻塞性肺病。增加慢性阻塞性肺病显示出类似的mRNA的小鼠模型M2标记。我们的发现表明巨噬细胞异常切换在粘膜和慢性阻塞性肺病患者的细胞腔的地区,这与细胞因子平衡密切相关。 There may be potential for beneficial therapeutic cytokine manipulation of macrophage phenotypes in COPD.
介绍
气流限制是慢性阻塞性肺病的定义特征和主要原因是小气道壁纤维化增厚,细胞腔的狭窄和进步的消亡。这些事件发生在疾病早期症状出现之前或肺功能变化1。此外,肺气肿可能发生在一些慢性阻塞性肺病的人,这也增加了气流限制2。气道炎症已经成为公认的关键底层驱动慢性阻塞性肺病的病理生理表现,但有限的核心证据,至少对气道壁而非腔3。我们和其他人表明炎症在慢性阻塞性肺病的角色需要重新评估,尤其是在疾病的早期阶段,相当矛盾的是hypo-cellularity4,5,6和一个整体炎性细胞数量的下降7最近被描述在大型和小型COPD患者的气道壁。
总数的增加巨噬细胞在气道腔已经成立于吸烟者和慢性阻塞性肺病患者8,9,10。我们最近对小气道壁组织CD68 +巨噬细胞,尽管,我们发现更多的巨噬细胞在小气道壁在正常对照组相比,大气道,没有数字的变化在吸烟者或慢性阻塞性肺病3,5。
巨噬细胞可以表现出两极分化表型,M1和M2亚种群的范式Th1、Th2淋巴细胞11。M1描述了巨噬细胞细胞毒性和促炎和特点是细胞因子的分泌干扰素(IFN) -γ和il - 12,和通过促进Th1-type免疫力11,12,13。相比之下,M2巨噬细胞被认为是抗炎,与组织修复和纤维化细胞因子分泌pro-Th2包括CCL22、il - 4, IL-13和il - 1014。
巨噬细胞有一个基本的精氨酸代谢能力,一氧化氮(NO)或鸟氨酸,使用相互substrate-competitive酶诱导一氧化氮合酶(间接宾语)或arginase-I (Arg-1),分别12。巨噬细胞表型M1展览伊诺表达增加,而M2巨噬细胞由增加Arg-1典型,促进胶原蛋白合成,使氨基酸脯氨酸可以成纤维细胞15,16。伊诺和Arg-1精氨酸可以驱动之间的竞争对比病理功能通过反对巨噬细胞表型17。
在当前的研究中,我们有特征的表型和代谢调节二分法气道壁巨噬细胞的数量和他们的人类肺组织微环境和支气管肺泡灌洗(BAL),以及相关的表型是切换到吸烟,慢性阻塞性肺病、肺功能。我们进一步证实了这些发现在一个为期六周的香烟烟雾诱发小鼠模型的实验性慢性阻塞性肺病。
结果
M1 / M2表型在小型航空公司
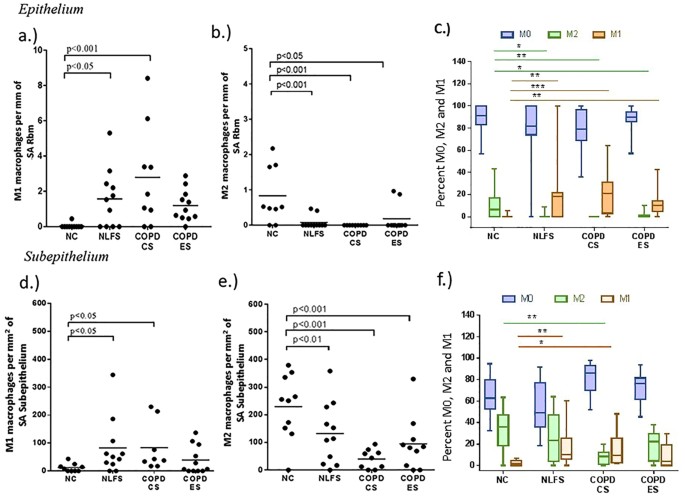
在小气道上皮细胞,占据主导地位的巨噬细胞类型在数字和百分比是non-differentiated M0,特别是在正常控制(NC)科目(无花果。1 a, c),基本上很少有M1(中位数percenatge 0%;范围0 - 5.2)巨噬细胞。有显著增加M1人口比例在正常肺功能吸烟者(独立)[percenatge18%中位数;范围0 - 100;(p < 0.05),慢性阻塞性肺病当前吸烟者(COPD-CS)(中位数百分比21.2%范围0.0 - -64.1;(p < 0.01),恢复部分对正常的慢性阻塞性肺病的人(COPD-ES)(中位数百分比10%范围0.0 -42;(p < 0.05)](图。1 c)。小数字和百分比的M2巨噬细胞出现在数控(中位数比例6.4%;范围0.0 - -43.3),但几乎没有国家(中位数percenatge 0%;范围0.0 - -9.0 (p < 0.05), COPD-CS(中位数比例0%;范围0.0 - -0.01 (p < 0.01)]和COPD-ES[平均比例0%;范围0.0 - -10.1 (p < 0.05)](图。1 b和c)。
在数控subepithelium, M0人口占主导地位的是低于上皮,与相对较少的m1(中位数比例1.6%;范围0.0 - -6.3)和M2巨噬细胞(中位数36%;范围0.0(图-63)。1 f)。观察M1人口显著上升的国家(中位数percenatge 10.1%;范围0.0 - -60.2 (p < 0.01)]和COPD-CS[中等percenatge 9.6%范围-48 - 1.6 (p < 0.05)。相比有下降正常M2人口吸烟者(中位数百分比23%区间0.0 - -64.1)和慢性阻塞性肺病,又特别重要在COPD-CS(中位数百分比8.4%;范围0.0 - -19.9 (p < 0.01)](图。1 f)。没有统计显著差异观察nlf和COPD-CS之间。
一个描述性的说明比较巨噬细胞子总体中表型在数控和COPD-CS表示在无花果。2。
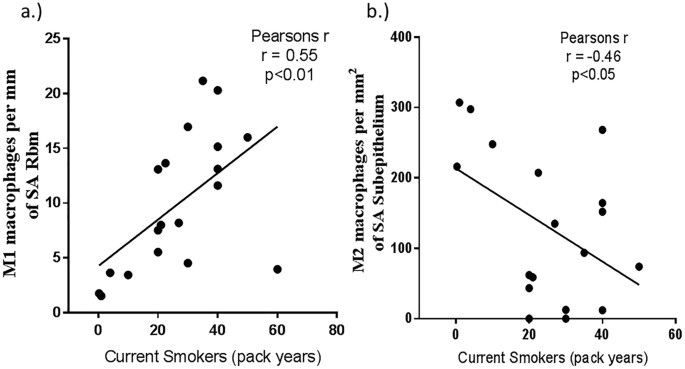
此外,吸烟久的人们之间有正相关关系,增加在M1巨噬细胞上皮(皮尔森r = 0.55, p = 0.006)(图3)。而负相关是观察sub-epithelial M2巨噬细胞(皮尔森r =−0.46, p = 0.02)(图3 b)。
Arginase-1 SA墙(Arg-1)表达式
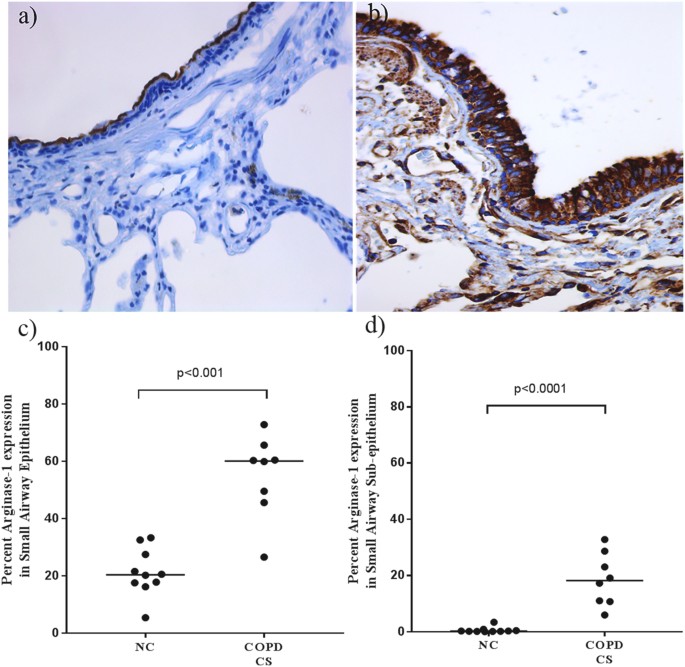
慢性阻塞性肺病的小气道壁组织patient-CSs显示标志整体非特异性Arg-1组织表达的增加,上皮(p < 0.01)和subepithelium (p < 0.001),与正常对照组相比(图4)。在这个阶段我们没有量化这种non-COPD吸烟者,但叙述地染色存在但不丰富。
是表型在支气管肺泡灌洗(BAL)
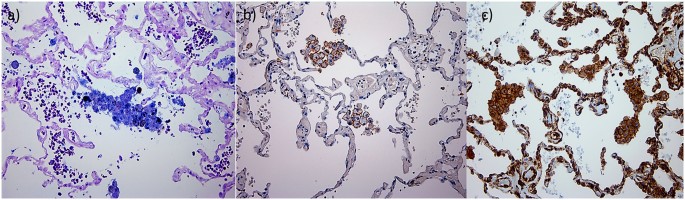
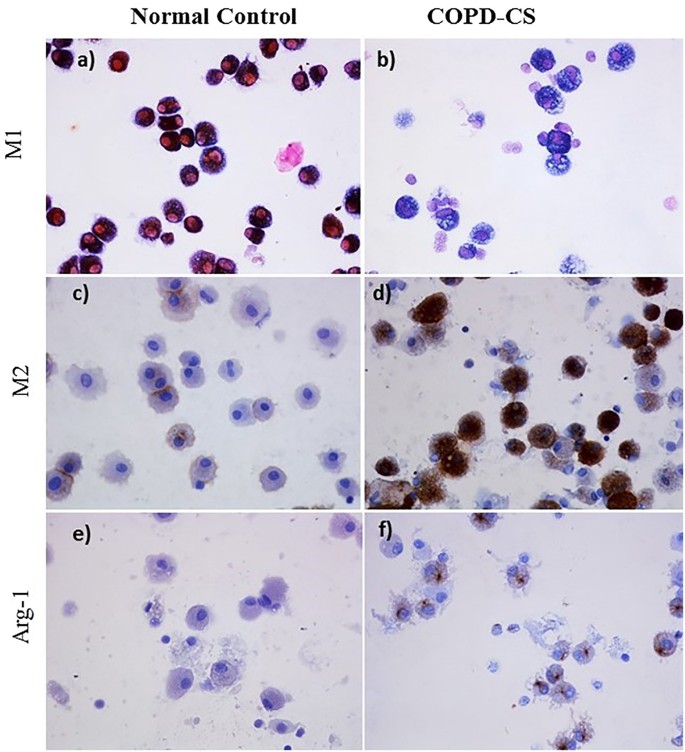
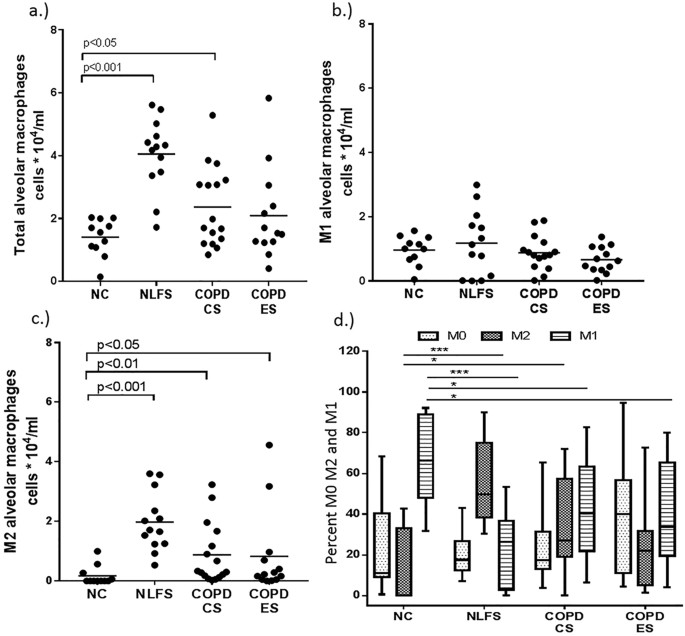
当比较肺泡空间内的肺泡巨噬细胞(图5 a - c)切除肺组织(也包含小航空公司)慢性阻塞性肺病的患者中,我们观察到相似的形态和M1 / M2表达模式与腔的巨噬细胞来源于BAL腔(无花果。6 b, d和f)。然而,我们只有这里提供量化结果frrom巨噬细胞从球样品。两到三倍增加总BAL CD68 + AMs发现nlf (p < 0.01)和COPD-CS (p < 0.05),而在COPD-ES他们类似于正常水平(图。7一个)。巨噬细胞与组织数据,有更少的未分化的百分比M0 AMs组(图。7 d)。
球AMs数控主要是M1(中位数比例66.3%;范围31.5 - -91.2)本质上更少的m2(中位数百分比0%区间0.0 - -42.7)(图7 d)。有一个显著的变化在临床表型的概要文件组,减少的百分比M1(中位数比例26.3%;在独立区间0.1 - -53.1),COPD-CS(中位数比例40.4%;范围6.2 - -82.5)和ES(中位数比例33.6%;范围4.0 - -80)和增加M2巨噬细胞(中位数比例49.5%;在独立区间31.5 - -91.2),COPD-CS(中位数比例27.15%;范围0.2 - -71.9)和COPD-ES(中位数比例21.9%;范围1.3 - -72.7)(无花果。5 d)。
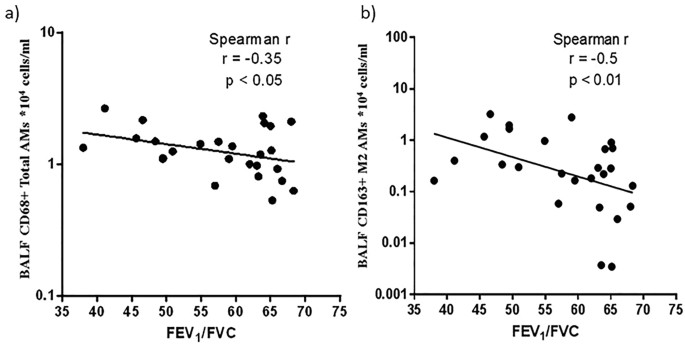
两个总CD68 + AMs(枪兵的ρ(rs) =−0.35, p = < 0.05)和M2 AMs(枪兵的ρ(rs) =−0.5, p < 0.01)(图8 a和b)与FEV1 / FVC的负相关。
BAL M2-associated细胞因子在慢性阻塞性肺病增加
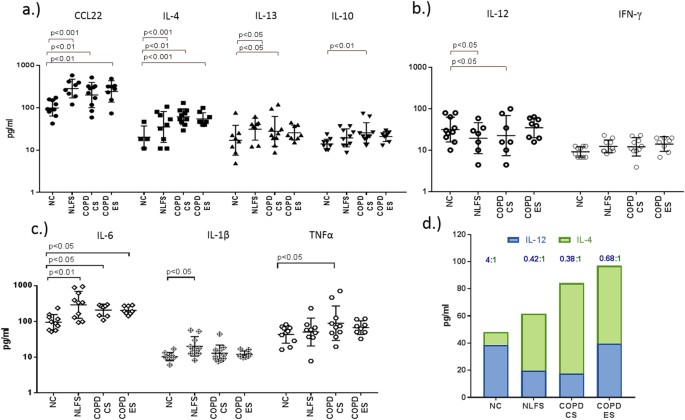
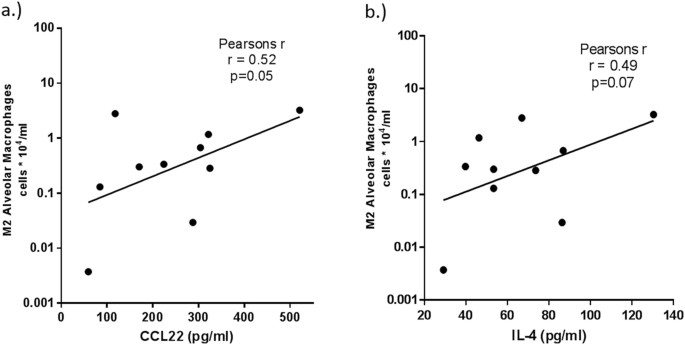
显著增加M2-related MDC / CCL22, il - 4, IL-13,观察il - 10在球浮在表面的独立和COPD受试者(无花果。9细胞因子),减少M1-related IL-12p40但不是IFN-γ(无花果。9 b)。我们还发现显著增加的多效性的细胞因子il - 6在吸烟者和COPD组(无花果。9 c)。进一步,一个规模虽小但显著增加促炎IL-1β在吸烟者但不是在慢性阻塞性肺病而TNFα只增加与正常对照组相比,COPD-CS(无花果。9 c)。增加的比率IL-12p40 il - 4 (M1 / M2因子)证实了切换到M2在BAL COPD-CS(无花果。9 d)。有正相关COPD-CS CCL22和il - 4和M2巨噬细胞数量之间(图10 a和b)。
整个鼠标COPD肺mRNA的表达
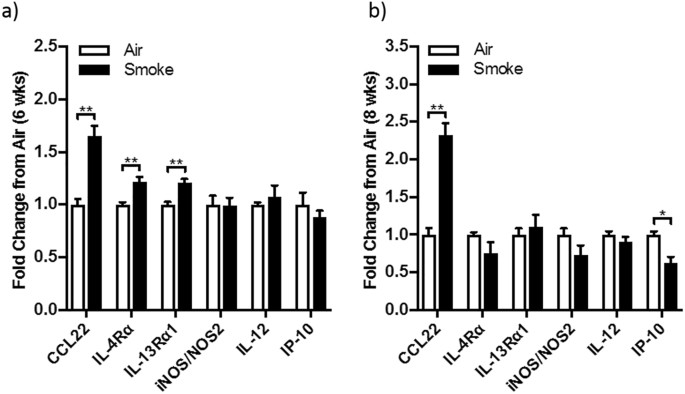
我们确认一个类似模式的M2细胞因子mRNA优势的小鼠模型的慢性香烟烟雾暴露接触本来每天抽一包烟的代表13,18,19,20.,21,22,23,24。我们发现与upregulation CCL22(褶皱变化(FC) = 1.718;p = 0.012), IL-4Rα(FC = 1.270;p = 0.018), IL-13Rα1 (FC = 1.673;p = 0.018),而没有改变M1-related伊诺/ NOS2, il - 12或IP-10 mrna(无花果。11)。
讨论
这项研究是第一个表型分化小气道壁和气道腔根据M1和M2巨噬细胞亚群的表型正常,吸烟者和慢性阻塞性肺病患者。我们的观察表明动态微分开关在小航空公司和矿山AMs,但定性这些非常不同。在小航空公司,有一个开关向主要M1表型nlf和COPD-CS相比,数控(无花果。2)表明吸烟的影响,同时,在矿山AMs对M2主导地位(图有一个开关。6)。此外,BALF中细胞因子从吸烟者和COPD-CS偏向M2概要文件。从慢性香烟烟雾诱发小鼠模型获得的数据还表明,一个平方米环境在目前在整个肺组织。
M1和M2巨噬细胞被认为是功能分化,与M1 pro-fibrotic促炎症和M2越来越多。M1的表现型,我们选择伊诺+作为一个标记25和CD68 co-staining区分他们从其他伊诺生产细胞树突和自然杀伤(NK)细胞。对于M2我们使用CD163,清道夫受体调节更TH2微环境10,26。不同的表型是否扭曲区划的影响或分化细胞的运动引起的壁腔需要进一步调查。我们相信,这是最有可能前没有梯度从sub-epithelium腔上皮,也没有互惠的壁细胞数量的下降导致腔的巨噬细胞的显著增加。
的正常优势iNOS-expressing M1巨噬细胞发生对抗病原体通过腔的一氧化氮(NO)的生产,一个先天免疫效应。然而,这样的非特异性反应,当不受控制的会造成相当大的损害宿主组织和细胞。我们的观察M1百分比减少巨噬细胞在COPD气道壁电流和烟与肺功能正常的吸烟者相比,因此,建议降低抗感染的能力27。这也反映了自我平衡的适应,以避免过度的组织损伤。最近的证据表明,高浓度的本质上没有抑制M1表型28。
鉴于伊诺的变化,我们也希望调查功能Arg-1倒数。有趣的是,我们发现了一个更高的非特异性的表达Arg-1整个气道壁粘膜上皮、sub-epithelium和不吸烟的人相比,COPD-CS肺泡septae正常控制。这种过度的Arg-1可以增加细胞分解代谢的活动的结果,与氧化应激增加吸烟者,催化精氨酸通过尿素循环尿素和L-ornithine。L-ornithine L-proline已知的前兆,胶原蛋白的生物合成的关键氨基酸,和伤口愈合15。然而,胶原蛋白的过度沉积导致气道壁的刚度小航空公司,一个重要的病理生理特征在慢性阻塞性肺病29日。此外,呼出没有减少吸烟者也是众所周知的,但原因不清楚30.,31日。
我们发现M2优势的气道腔的巨噬细胞在吸烟者慢性阻塞性肺病有和没有是共振两个先前的研究,尽管他们发现增加的百分比M2 AMs COPD-ex吸烟者10,32。一项研究32落下帷幕,缺乏正常的控制也评估了M1表型的人口。我们的研究结果符合Shaykhiev的研究等。33,细胞因子和趋化因子的基因表达分析显示更多M2-polarised AMs吸烟者和控制慢性阻塞性肺病而非吸烟区。进一步,我们增加总AMs和特别是M2巨噬细胞亚型相关气流阻塞,表明生物合理性。
我们平衡细胞因子的数据反映了细胞表型转换,我们观察到在隔间。il - 4和IL-13共享一个共同的受体,IL-4Rα/ IL-13Rα1,通过JAK-1 / STAT6信号通路,诱导differentially-activated M2巨噬细胞34。研究Rutschman等。35表明,诱导il - 4和IL-13 STAT6通路的抑制伊诺表达,所以没有生产,通过转录后修改。IL-13,其他研究也表明,il - 4和il - 10在巨噬细胞也上调Arg-1协同表达36。我们当前研究间接证实这些发现,但现在在人类临床疾病。
我们还观察到增加CCL22在独立和慢性阻塞性肺病落下帷幕。CCL22是监管趋化因子M2巨噬细胞分泌的TH2反应两极分化细胞因子il - 4、IL-5,和IL-13, IFNγth1细胞因子的表达下调37,38。重要的是,考虑到常见的co-association COPD和肺癌,CCL22参与肿瘤发生。平方米的活跃分泌肿瘤相关巨噬细胞(tam)是促进恶性肿瘤通过抑制抑制T细胞招聘。相似的肿瘤发生的影响归因于il - 6,我们还发现高架在吸烟者和慢性阻塞性肺病。此外,在体外在巨噬细胞的研究也表明,il - 6促进M2表型和增加M2-associated Arg-1等标记39。
巨噬细胞亚型的极化差异小的航空公司和腔明显。这表明不同的细胞因子在每个解剖环境微环境,促进转向M1表型在气道壁,但对M2气道腔。这可能有重要意义的不同病理观察到每个站点在慢性阻塞性肺病疾病,如感染和先天免疫激活ROS-induced腔,但肝纤维化、气道壁增厚。然而,目前的研究有局限性,与组织来自两个不同的患者团体从COPD-CS落下帷幕,COPD-ex-smokers、独立和NC和小气道重建相似生理群但癌症患者。因此,它是可能的,巨噬细胞表型和细胞因子可能是受到癌症的存在但是我们有量化气道壁组织巨噬细胞远离癌症领域。
我们进一步调查是否可以证实在人类发现一只老鼠吸烟模型和评估整个肺组织的mRNA水平与香烟烟雾诱发小鼠实验性慢性阻塞性肺病。有趣的是,六个星期后烟雾暴露,代表的早期阶段疾病发病机理,老鼠肺部数据证实了人类的发现,与特定的M2表型CCL-22 mRNA, IL-4Rα,IL-13α,没有为M1标记伊诺mRNA的变化,IL-12p40 IP-10。目前我们的研究仅限于mRNA的整个肺组织,因此,与人类的数据不同,并不区分。然而,我们相信添加鼠标数据在当前的研究中加强人类发现和我们的未来将是一个动力机械和介入老鼠研究巨噬细胞的功能。
结论
小说的主要发现在这项研究是M1平方米,增加巨噬细胞的减少气道壁的SAs在吸烟者和慢性阻塞性肺病。M1是先天的最强信号在气道炎症上调我们看到墙。落下帷幕的M2开关的发现吸烟者与慢性阻塞性肺病和没有与此形成鲜明对比的是,巨噬细胞表型的小气道壁。BALF细胞因子M2表型的分析显示促销。开关被证实的肺组织慢性吸烟小鼠模型。整体组织表达的Arg-1 SA墙显示异化的活动增加,细胞衰老的迹象,但也可能暗示在肺纤维化和气道阻力。这些新发现有可能理解病理生理学的重要呼吸道对吸烟和病因的慢性阻塞性肺病的反应;他们需要考虑当考虑主要原因不明的细胞功能现象与慢性阻塞性肺病,肺癌和慢性阻塞性肺病患者的具体漏洞。
方法
伦理批准
塔斯马尼亚人类健康与医学研究伦理委员会批准了这项研究(EC00337 -小气道切除组织和H6532 BAL流体样品)。知情同意是直接来自所有参与的主题。纽卡斯尔大学的动物伦理委员会,澳大利亚批准协议相关的所有鼠标。所有实验包括在本研究根据机构的指导方针和有关规定。
主题分类
SA切除组织
四十个病人同意列入本研究表1。对象都有原发性非小细胞肺癌,大约平均分配的鳞状上皮和腺癌,并同意手术组织用于研究在霍巴特皇家医院。二十个病人已经证明轻中度,阻塞性肺疾病的全球倡议(黄金)阶段I和II COPD的9 COPD-CS和11 COPD-ES戒烟(> 1年)。11个人独立。十禁烟组织从詹姆斯·霍格肺获得注册,英属哥伦比亚大学的普罗维登斯医疗研究伦理委员会的批准h00 - 50110,并被作为比较的对照组(NC)。史的学科与其他呼吸道疾病,最近的急性加重的慢性阻塞性肺病和系统性或吸入糖皮质激素被排除在研究之外。手术切除材料被远离原发肿瘤和包含非癌症影响小的航空公司。
BAL流体(BALF)
54个人类受试者自愿参加这项研究。BALF来自13个国家,16 COPD-CS, 14 COPD-ES比较与11 nc。主题与最近呼吸道疾病、感染或慢性阻塞性肺病急性加重和系统性或吸入糖皮质激素被排除在研究之外。如前所述BALF获得和处理(14、15)。一旦提取BALF被送往实验室4°C进行处理和分析。总活菌数测定提取过滤BALF使用血细胞计数器,并进一步200µL BALF cytocentrifuged在100 g 5分钟产生两个cytospots载玻片。BAL cytospins被浸泡在福尔马林溶液染色前10分钟。BALF上层清液是由过滤BALF通过200 -微米网和离心法在4°C 250克15分钟去除细胞碎片。整除的BALF上层清液储存在−80°C到使用。
免疫组织化学
切除组织是福尔马林固定、石蜡包埋组织部分在3.5微米厚度减少,并在乙醇脱蜡、水化。此外,BAL cytospins和切除组织进行了检索和内源性过氧化物酶活动阻止热3%过氧化氢10分钟。
M1巨噬细胞,切除组织和BALF cytospins双重染色有老鼠anti-CD68单克隆抗体(KP1, Dako M0814 1/400稀释)和一只兔子anti-iNOS多克隆抗体(热费希尔澳大利亚,pa1 - 21054, 1/100稀释)。绑定伊诺抗体阐述了使用peroxidase-labelled兔子想象+和可视化为布朗使用3 - 3′-Diaminobenzidine (DAB) (K3468;Dako丹麦A / S),而CD68抗体开发使用Dako实际检测系统(K5005;Dako)和可视化为蓝色BCIP /电视台(5-bromo-4-chloro-3′-indolyphosphate和nitro-blue四唑)(K0598;Dako)在一个现成的基质系统。抑制了内源性碱性磷酸酶活性增加左旋咪唑(X3021;Dako)。进一步说,幻灯片复染色红色可视化粉色原子核与核快。单一的彩色CD68 +细胞为阴性伊诺被视为M0细胞群。
描述M2巨噬细胞,cd163 Arginase-1染色进行了使用鼠标anti-CD163 (EDHu-1, AbD Serotec MCA1853 1/100稀释)anti-Arg1 (BD生物科学,610708,1/100稀释)抗体,90分钟。绑定CD163并阐述了使用__arg1抗体peroxidase-labelled鼠标想象+ (Dako丹麦),开发与民建联和与苏木精复染色。
图像分析
计算机辅助图像分析进行DM 2500年徕卡显微镜,徕卡DFC495相机和图像专业+ 7.0软件。五个随机领域选择的小型航空公司不到两毫米厚(至少两个航空公司/主题)为综合分析选择特别的区域选择,虽然肌肉束和腺体被排除在区域调查。小航空公司sub-epithelium 100微米深度估计的数量。彩色M0、M1和M2 sub-epithelium和上皮细胞分别计算,提出了在这里每毫米2区域调查和每毫米的网状基底膜分别组织遏制长度。Arg-1表达式,单独分析了总sub-epithelium(不包括肌肉区域)和上皮细胞,进一步,这里的数据表示为百分数的组织Arg-1表达式。
落下帷幕的细胞数量使用brightfield显微镜(奥林巴斯BX53)协助下Visiopharm newCAST™软件。自动电动系统提供了一个公正的统一的随机抽样每cytospot 12场,和染色细胞被手动为每个选定的字段数。计数是这里提出规范化BAL稀释因子和细胞每毫升的原始样本落下帷幕。
细胞因子分析
BALF游离浮在表面的融化在冰和集中10倍,使用3 kDa截止Amicon®Ultra-4离心过滤单元(UFC800308默克密理博)和离心(2000 g, 30分钟,4°C)。人类细胞因子M1 /促炎细胞因子(il - 12、IFNγIL-1β和TNFα)和M2 (il - 4、IL-13 CCL22, il - 10、il - 6)巨噬细胞被量化使用多路复用(MPHCYTOMAG60;微孔复合包),分析使用Luminex™MagPix多路复用技术平台根据制造商的指示。趋化因子/细胞因子定量是来自这里的标准曲线和代表每毫升的皮克原始样本落下帷幕。
mRNA分析小鼠肺
老鼠暴露通过nose-only 12研究年级香烟的烟,一个小时,每天两次,每周5天,六个星期20.,21,28。这等同于人类一天抽一包烟。当早期慢性阻塞性肺病的特点开发六周后,肺信使rna提取,微阵列使用Affymetrix执行GeneChips。GeneSpring分析是用来评估的mRNA转录水平M1 (IP10 IFN-γ,il - 12)和M2标记(CCL22, IL-4RαIL-13Rα)。
统计分析
检查后正态分布,分析这是表示为中值和范围,非参数(克鲁斯卡尔-沃利斯)方差分析和多重比较使用邓恩的测试。线性回归和皮尔森斯皮尔曼r”是用于关联分析。鼠标数据分析使用未配对t假设高斯分布与棱镜V6.0d软件(美国GraphPad拉霍亚,CA),并提出了意味着4 - 8±SEM老鼠/组,p < 0.05被认为是具有统计学意义。
引用
豪格,j . c .气流限制在慢性阻塞性肺疾病的病理生理学。《柳叶刀》364年,709 - 721,https://doi.org/10.1016/s0140 - 6736(04)16900 - 6。
豪格,j . C。,Paré, P. D. & Hackett, T.-L. The Contribution of Small Airway Obstruction to the Pathogenesis of Chronic Obstructive Pulmonary Disease.生理上的评论97年,529 - 552,https://doi.org/10.1152/physrev.00025.2015(2017)。
Sohal, S。病房里,C。,Danial, W., Wood-Baker, R. & Walters, E. H. Recent advances in understanding inflammation and remodeling in the airways in chronic obstructive pulmonary disease.呼吸医学的专家审查7,275 - 288,https://doi.org/10.1586/ers.13.26(2013)。
Sohal, S。等。变化在吸烟者和COPD气道组蛋白Deacetylase2吸入糖皮质激素:随机对照试验。《公共科学图书馆•综合》8e64833,https://doi.org/10.1371/journal.pone.0064833(2013)。
Eapen, m . S。迈尔斯,S。,Walters, E. H. & Sohal, S. S. Airway inflammation in chronic obstructive pulmonary disease (COPD): a true paradox.呼吸医学的专家审查1-13,https://doi.org/10.1080/17476348.2017.1360769(2017)。
Sohal, S。,Eapen, m . S。病房里,C。&Walters, E. H. Airway inflammation and inhaled corticosteroids in COPD.欧洲呼吸杂志49,https://doi.org/10.1183/13993003.00289 - 2017(2017)。
Eapen, m . S。等。分析细胞和炎性轻度至中度COPD气道壁的变化。Respirology(卡尔顿,维克。)22,1125 - 1132,https://doi.org/10.1111/resp.13021(2017)。
Kuschner, W。,D’Alessandro, A., Wong, H. & Blanc, P. Dose-dependent cigarette smoking-related inflammatory responses in healthy adults.欧洲呼吸杂志9,1989 - 1994 (1996)。
夏皮罗,s d巨噬细胞在慢性阻塞性肺疾病。美国呼吸和重症监护医学杂志》上160年S29-S32,https://doi.org/10.1164/ajrccm.160.supplement_1.9(1999)。
Kaku Y。等。CD163的过度表达,CD204和CD206肺泡巨噬细胞的严重慢性阻塞性肺疾病患者的肺。《公共科学图书馆•综合》9e87400,https://doi.org/10.1371/journal.pone.0087400(2014)。
米尔斯,c, D。,Kincaid, K., Alt, J. M., Heilman, M. J. & Hill, A. M. M-1/M-2 Macrophages and the Th1/Th2 Paradigm.《免疫学164年,6166 - 6173,https://doi.org/10.4049/jimmunol.164.12.6166(2000)。
米尔斯,c, d .解剖学的发现:M1和M2巨噬细胞。免疫学前沿6,https://doi.org/10.3389/fimmu.2015.00212(2015)。
贝克特,e . L。等。一个新的短期慢性阻塞性肺疾病的小鼠模型确定发病机理中肥大细胞类胰蛋白酶的作用。《变态反应与临床免疫学杂志》上131年,752 - 762,https://doi.org/10.1016/j.jaci.2012.11.053(2013)。
马丁内斯,f . o . &戈登,美国M1和M2巨噬细胞激活的模式:时间重新评估。F1000prime报告613岁的https://doi.org/10.12703/p6-13(2014)。
本森,r . C。,Hardy, K. A. & Morris, C. R. Arginase and Arginine Dysregulation in Asthma.《过敏2011年12https://doi.org/10.1155/2011/736319(2011)。
莫拉,a . L。等。活化的肺泡巨噬细胞通过Herpesvirus-Induced肺纤维化的替代途径。美国呼吸系统细胞和分子生物学》杂志上35,466 - 473,https://doi.org/10.1165/rcmb.2006 - 0121摄氏度(2006)。
El-Gayar, S。,Thuring-Nahler, H., Pfeilschifter, J., Rollinghoff, M. & Bogdan, C. Translational control of inducible nitric oxide synthase by IL-13 and arginine availability in inflammatory macrophages.免疫学杂志》(1950年马里兰州巴尔的摩。)171年,4561 - 4568 (2003)。
弗里克,M。,Deane, A. & Hansbro, P. M. Animal models of chronic obstructive pulmonary disease.专家意见在药物发现9,629 - 645,https://doi.org/10.1517/17460441.2014.909805(2014)。
琼斯,B。等。COPD动物模型:它告诉我们什么?Respirology(卡尔顿,维克。)2221-32,https://doi.org/10.1111/resp.12908(2017)。
许,a . C。等。针对PI3K-p110alpha抑制流感病毒感染在慢性阻塞性肺疾病。美国呼吸和重症监护医学杂志》上191年,1012 - 1023,https://doi.org/10.1164/rccm.201501 - 0188摄氏度(2015)。
Hansbro, p . M。等。柱状细胞的重要性Prss31 /跨膜类胰蛋白酶/ tryptase-gamma肺功能和实验性慢性阻塞性肺疾病和结肠炎。《生物化学》杂志上289年,18214 - 18227,https://doi.org/10.1074/jbc.M114.548594(2014)。
刘,G。等。Fibulin-1调节组织重塑呼吸道疾病的发病机制。江森自控的洞察力1e86380,https://doi.org/10.1172/jci.insight.86380(2016)。
赖特,j·L。,Cosio, M. & Churg, A. Animal models of chronic obstructive pulmonary disease.美国生理学杂志》上——肺细胞和分子生理学295年L1-L15,https://doi.org/10.1152/ajplung.90200.2008(2008)。
富兰克林,b。等。适配器ASC细胞外和“prionoid”活动,传播炎症。自然免疫学15,727 - 737,https://doi.org/10.1038/ni.2913(2014)。
米尔斯,C。M1和M2巨噬细胞:健康和疾病的神谕。32,463 - 488,https://doi.org/10.1615/CritRevImmunol.v32.i6.10(2012)。
Roszer, t .了解神秘的M2通过激活巨噬细胞标记和效应机制。炎症介质2015年,816460,https://doi.org/10.1155/2015/816460(2015)。
Budden, k . F。等。新兴致病性微生物群和gut-lung轴之间的联系。Nat牧师微1555 - 63,https://doi.org/10.1038/nrmicro.2016.142(2017)。
陆,G。等。骨髓细胞衍生诱导一氧化氮合酶抑制M1巨噬细胞极化。自然通讯6,6676,https://doi.org/10.1038/ncomms7676(2015)。
豪格,j . C。等。Small-Airway阻塞在慢性阻塞性肺疾病的本质。新英格兰医学杂志》上350年,2645 - 2653,https://doi.org/10.1056/NEJMoa032158(2004)。
•海因斯G。,Brightling, C. & Bafadhel, M. Fractional exhaled nitric oxide in chronic obstructive pulmonary disease.欧洲呼吸杂志46,https://doi.org/10.1183/13993003.congress - 2015. pa3993(2015)。
Maziak, W。等。呼出一氧化氮在慢性阻塞性肺疾病。美国呼吸和重症监护医学杂志》上157年,998 - 1002,https://doi.org/10.1164/ajrccm.157.3.97 - 05009(1998)。
昆兹,l . i . Z。等。吸烟状况和抗炎巨噬细胞在支气管肺泡灌洗和诱导痰在慢性阻塞性肺病。呼吸系统的研究1234,https://doi.org/10.1186/1465 - 9921 - 12 - 34(2011)。
Shaykhiev, R。等。Smoking-dependent肺泡巨噬细胞极化的重组:暗示对慢性阻塞性肺疾病的发病机理。免疫学杂志》(1950年马里兰州巴尔的摩。)183年,2867 - 2883,https://doi.org/10.4049/jimmunol.0900473(2009)。
戈登,美国&马丁内斯,f . o .替代激活巨噬细胞的机制和功能。免疫力32,593 - 604,https://doi.org/10.1016/j.immuni.2010.05.007。
Rutschman, R。等。前沿:Stat6-Dependent衬底损耗调节一氧化氮的生成。《免疫学166年,2173 - 2177,https://doi.org/10.4049/jimmunol.166.4.2173(2001)。
Munder, M。,Eichmann, K. & Modolell, M. Alternative Metabolic States in Murine Macrophages Reflected by the Nitric Oxide Synthase/Arginase Balance: Competitive Regulation by CD4+ T Cells Correlates with Th1/Th2 Phenotype.《免疫学160年,5347 - 5354 (1998)。
山下式,与黑田,大肠的监管macrophage-derived趋化因子(MDC CCL22)生产。关键评论免疫学22,105 - 114 (2002)。
安德鲁·d·P。等。STCP-1 (MDC) CC趋化因子徒特别是慢性激活Th2产生淋巴细胞和单核细胞在与Th2细胞因子il - 4和IL-13刺激。免疫学杂志》(1950年马里兰州巴尔的摩。)161年,5027 - 5038 (1998)。
费尔南多,m R。雷耶斯,j·L。努志,J。,Leung, G. & McKay, D. M. The Pro-Inflammatory Cytokine, Interleukin-6, Enhances the Polarization of Alternatively Activated Macrophages.《公共科学图书馆•综合》9e94188,https://doi.org/10.1371/journal.pone.0094188(2014)。
确认
我们感谢詹姆斯·霍格肺在英属哥伦比亚大学的注册中心,温哥华,加拿大,提供正常的小气道组织。我们感谢史蒂文·韦斯顿先生组织学染色的技术帮助。晚退休教授汉康拉德•穆勒博士对他很好的指导在气道组织病理学和有价值的建议。我们承认以下组织的资金支持:克利福德•克雷格基金会,朗塞斯顿建立起来和国家卫生和医学研究委员会(NHMRC)。
作者信息
从属关系
贡献
M.S.E.进行组织学分析并进行了数据分析,起草了手稿。P.M.H.和R.Y.K.设计并开发了慢性阻塞性肺病的小鼠模型和基因表达分析。K.M.进行组织学分析,帮助起草报告。漫画提供的知识输入组织学分析和研究设计。T.L.H.促进组织采购和回顾了报告。S.S.S. E.H.W.构思和设计实验,做出知识贡献的组织数据和数据分析和准备的手稿。所有作者回顾了手稿。
相应的作者
道德声明
相互竞争的利益
作者宣称没有利益冲突。
额外的信息
出版商的注意:施普林格自然保持中立在发表关于司法主权地图和所属机构。
权利和权限
188滚球软件本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到Creative Commons许可,并指出如果变化。本文中的图片或其他第三方材料都包含在本文的创作共用许可,除非另有说明在一个信用额度的材料。如果材料不包括在本文的创作共用许可证和用途是不允许按法定规定或超过允许的使用,您将需要获得直接从版权所有者的许可。查看本许可证的副本,访问http://creativecommons.org/licenses/by/4.0/。
关于这篇文章
引用这篇文章
Eapen,硕士,Hansbro, P.M., McAlinden, K.et al。异常M1 / M2巨噬细胞表型资料在小气道壁和内腔在吸烟者和慢性阻塞性肺疾病(COPD)。Sci代表7,13392 (2017)。https://doi.org/10.1038/s41598 - 017 - 13888 - x
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598 - 017 - 13888 - x
进一步的阅读
大麻油提取物对免疫应答的影响基因表达在人类小气道上皮细胞(HSAEpC):对慢性阻塞性肺疾病(COPD)
大麻研究期刊》的研究(2020)
变更后immunophenotype人类巨噬细胞和单核细胞暴露于香烟烟雾中
科学报告(2020)
CSE对M1 / M2极化的影响在肺泡和腹膜巨噬细胞在不同浓度和暴露在体外
体外细胞与发育生物学,动物(2020)
经典的敏感性差异,或者激活巨噬细胞TAK1 inhibitor-induced necroptosis
癌症免疫学、免疫疗法(2020)
系统性Immuno-metabolic变化在慢性阻塞性肺疾病(COPD)
呼吸系统的研究(2019)

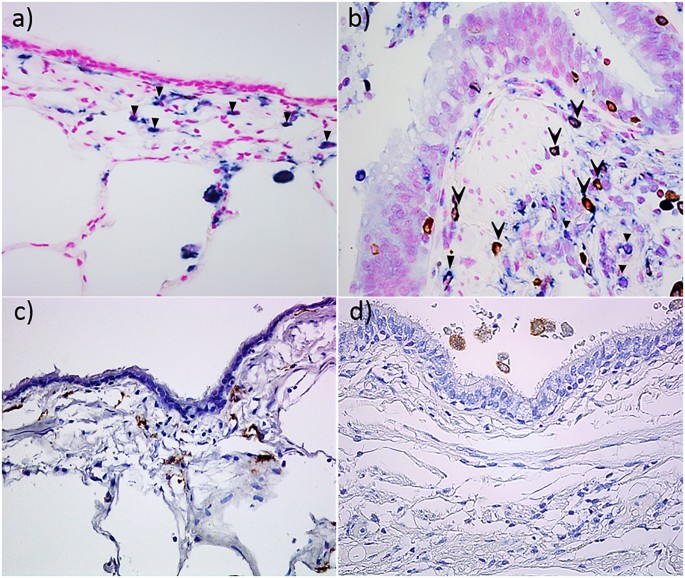
 )双重染色CD68 +间接宾语+细胞(
)双重染色CD68 +间接宾语+细胞( )只有CD68 +细胞。CD163染色M2巨噬细胞(c)数控(d)COPD-CS。
)只有CD68 +细胞。CD163染色M2巨噬细胞(c)数控(d)COPD-CS。