摘要gydF4y2Ba
免疫的一个中心范式是干扰素(IFN)介导的抗病毒反应先于促炎反应,优化宿主保护和最小化附带损害gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba.在此,我们报告,对于2019冠状病毒病(COVID-19),这一范式不适用。通过研究32例因肺炎住院的中重度COVID-19患者的时间IFN和炎症细胞因子模式,并对呼吸衰竭和死亡的发展进行纵向随访,我们发现,IFN-λ和I型IFN的产生都减少和延迟,只有一小部分患者在病情危重时才诱导产生。相反,在所有患者中,促炎细胞因子如肿瘤坏死因子(TNF)、白细胞介素(IL)-6和IL-8在ifn之前产生,并持续较长时间。这种情况反映在血液转录组中,其中突出的IFN签名仅在炎症增强的危重患者中可见。相比之下,在16名因肺炎而住院且临床病理特征与COVID-19相似的流感(流感)患者和24名症状较轻的非住院流感患者中,IFN-λ和I型IFN在较早、较高水平且独立于疾病严重程度的情况下被强烈诱导,而促炎细胞因子仅急性产生。值得注意的是,COVID-19患者中较高的IFN-λ浓度与支气管吸出物中较低的病毒载量和更快的病毒清除相关,且较高的IFN-λ与I型IFN比值与危重患者的预后改善相关。此外,与流感相比,COVID-19患者中细胞因子模式的改变与更长住院时间、更高的危重疾病发生率和死亡率相关。这些数据表明,COVID-19的抗病毒反应未调整,导致病毒持续存在、高炎症和呼吸衰竭。gydF4y2Ba
主要gydF4y2Ba
由β冠状病毒SARS-CoV-2引发的COVID-19已成为我们这个时代最严重的流行病之一,造成肺炎、急性呼吸窘迫综合征(ARDS)和死亡的高发gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba.SARS-CoV-2感染最显著的特征之一是,它在很长一段时间内不被注意到,持续数周的轻微或不复杂的疾病,直到一亚组患者出现突然和严重的症状,需要住院、氧气支持和/或入住重症监护室(ICU)。gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba.这种情况与病毒潜伏期异常长(从2天到14天)和病毒在呼吸道存在时间异常长(通常在初次感染后一个多月由传统分子诊断测试检测到)相一致gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.相比之下,迄今为止导致肺炎住院的主要呼吸道病毒流感病毒感染的潜伏期为1 - 4 d,病毒呈阳性的窗口期很短,只有几天,在1 - 3 d内突然出现症状,导致肺炎gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba.其他常见呼吸道病毒,如呼吸道合胞病毒、鼻病毒、副流感病毒、异肺炎病毒和普通感冒冠状病毒的潜伏期也较短(从1-5天不等),症状表现更为迅速和急性gydF4y2Ba9gydF4y2Ba这使得SARS-CoV-2在这方面非常独特。这种差异的基础尚不清楚,但很可能是COVID-19独特的病程和临床表现背后的病理生理学的关键驱动因素。gydF4y2Ba
COVID-19的特征是出现高炎症反应,也称为“细胞因子风暴”,损害气体交换功能,导致ARDS、多器官衰竭和死亡gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba.我们和其他人之前已经证明,由IFN-λ (III型IFN)和I型IFN精心调节的抗病毒反应对于平衡免疫以获得最佳保护和最小损害至关重要gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba.偏离这种平衡会引发有害的“细胞因子风暴”,对人体健康造成毁灭性后果。最近的一项研究表明,在COVID-19患者中,I型IFN和IFN-λ没有产生,因为它们无法在一小部分临床特征不明的COVID-19队列的血清中检测到gydF4y2Ba16gydF4y2Ba.相比之下,另一项研究报告称,I型IFN在COVID-19患者中被诱导,并表明其浓度在危重患者中可能降低gydF4y2Ba17gydF4y2Ba.这种差异可能是由于每一项研究都专注于一个明显的异质疾病过程的单一和可能的明显快照。因此,研究动力学分析与描述免疫反应的过程有关,特别是考虑到细胞因子是瞬时产生的。这一标准尤其适用于ifn,它们在感染早期表达,随后迅速下调。gydF4y2Ba
在这里,我们对32例COVID-19患者和16例因社区获得性肺炎住院的流感患者的I型和III型ifn和主要炎症细胞因子模式进行了全面的时间分析,并根据当前世界卫生组织指南进行了纵向随访gydF4y2Ba18gydF4y2Ba.两组患者入院时表现出相似的临床病理特征和相似的疾病严重程度(补充表)gydF4y2Ba1gydF4y2Ba).我们还分析了24例病情较轻的流感患者,他们在放射学上没有发现肺炎,也不需要住院(称为轻度流感;补充表gydF4y2Ba1gydF4y2Ba),以及10个健康的个体。使用高灵敏度的Luminex和ELISA检测,我们量化了住院后在规定时间间隔内收集的患者血清中与抗病毒免疫和高炎症相关的18种细胞因子和趋化因子(图。gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba1gydF4y2Ba).该分析基于相同的疾病症状和严重程度的临床标准,主要是是否患有肺炎和是否需要氧气支持,对患者进行校准。gydF4y2Ba
一个gydF4y2Ba,图示入院后按特定时间间隔采样的实验设计示意图,纵向随访32例COVID-19患者和16例流感合并肺炎患者。虚线分别表示首次和最后一次出现危重疾病的时间。gydF4y2BabgydF4y2Ba入院后各时间间隔血清IFN-λ1、IFN-α、IFN-γ、TNF、IL-6、IL-7、IL-8、IL-10、CCL3水平。数据以散点图的形式表示,其中点表示单个患者的测量值,列表示中值,误差条表示范围。COVID-19,gydF4y2BangydF4y2Ba= 16, 17, 21, 15, 11和8对于每个连续的时间间隔。对于流感,gydF4y2BangydF4y2Ba分别= 16,14和11。对于健康,gydF4y2BangydF4y2Ba= 10。灰色阴影标志着该方法的定量限度。gydF4y2BaPgydF4y2Ba值由双尾曼-惠特尼模型确定gydF4y2BaUgydF4y2Ba-test非参数比较。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01和***gydF4y2BaPgydF4y2Ba< 0.001显著高于健康对照组。gydF4y2Ba#gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2Ba# #gydF4y2BaPgydF4y2Ba< 0.01,gydF4y2Ba# # #gydF4y2BaPgydF4y2Ba< 0.001组与流感组有显著性差异。gydF4y2Ba
我们发现,COVID-19患者对IFN-λ和I型IFN的诱导严重受损。在大多数COVID-19患者中未检测到IFN-λ和I型IFN(在测定定量极限的中位数水平),尽管一些患者产生IFN-λ,少数患者也产生IFN-α(图1)。gydF4y2Ba1 bgydF4y2Ba).这一观察结果与流感患者进行了对比,后者在入院的第一个(1-3天)时间间隔内几乎一致表达两种ifn,且浓度显著高于流感患者。在所有病例中,IFN的表达都是短暂的,I型IFN的水平在住院后3 d后迅速下降,而IFN-λ则持续较长时间。值得注意的是,尽管其制造IFN的能力有限,COVID-19患者仍强烈表达促炎细胞因子,如TNF、IL-6、IL-7、IL-8、IL-10、IFN-γ和CCL3,并在较长时间内保持高浓度(图。gydF4y2Ba1 bgydF4y2Ba).与健康个体相比,其他细胞因子如IL-1β, IL-12, IL-23和CCL4也在特定时间间隔显著上调,反映了疾病病程的异质性(扩展数据图)。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
当根据疾病症状发作进行比较时,出现了类似的模式(扩展数据图)。gydF4y2Ba1 bgydF4y2Ba).COVID-19患者的IFN-λ和I型IFN水平明显延迟和降低,仅在一小部分患者中检测到,且在症状出现的7-10天之后(扩展数据图)。gydF4y2Ba3 a, bgydF4y2Ba).相比之下,所有流感患者在前6天内都表现出高水平的这些细胞因子(扩展数据图)。gydF4y2Ba3 a, bgydF4y2Ba).尽管COVID-19患者在症状出现的前6天几乎不产生IFN,但他们会产生与流感病毒浓度类似的促炎细胞因子和趋化因子,如TNF、IL-6、IL-8、IL-10和CCL3。gydF4y2Ba3 b, cgydF4y2Ba).此外,他们表现出促炎介质的延长表达,TNF、IL-6、IL-7、IL-8、IL-10和CCL4的高浓度在发病后的3周内仍可检测到,而在流感患者中,其中一些介质的表达在此时下调。gydF4y2Ba
值得注意的是,COVID-19患者入院时的全身炎症标志物,如c反应蛋白(CRP)浓度、白细胞(WBC)、中性粒细胞计数和中性粒细胞/淋巴细胞(N/L)比与流感患者相似(补充表)gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba4 fgydF4y2Ba).他们甚至有较低的发烧和较低的CURB-65得分,这是一种常用的肺炎严重程度的衡量标准gydF4y2Ba19gydF4y2Ba(扩展数据图。gydF4y2Ba4 g hgydF4y2Ba).然而,在随访过程中,COVID-19患者发生需要ICU支持的急性呼吸窘迫综合征的发生率要高得多。在我们的队列中,32名患者中有16人(50%)发展为危重疾病,其中3人死亡,相比之下,16名流感患者中只有3人(18.7%)死亡,没有人死亡(扩展数据图)。gydF4y2Ba5gydF4y2Ba).COVID-19患者在更大的时间窗口内变得危重(第一名患者在入院后第1天发病,最后一名患者在入院后第9天发病;无花果。gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba5gydF4y2Ba)比入院后第一天就出现危重症状的流感患者要少。这一发现与COVID-19所描述的严重呼吸衰竭的高发和长时间病程一致(参考文献)。gydF4y2Ba4gydF4y2Ba,gydF4y2Ba12gydF4y2Ba).有趣的是,在COVID-19患者中,危重患者入院时CRP浓度、WBC和中性粒细胞计数以及N/L比更高(扩展数据图)。gydF4y2Ba4 fgydF4y2Ba),但没有抑制-65或发烧(扩展数据图。gydF4y2Ba4 g hgydF4y2Ba及补充表gydF4y2Ba2gydF4y2Ba).流感危重患者也有较高的白细胞计数、中性粒细胞计数、N/L比和抑制因子-65的趋势,而非住院的流感患者没有表现出任何这些增加(扩展数据图)。gydF4y2Ba4 a -gydF4y2Ba).gydF4y2Ba
因此,我们检查了不同患者组之间的时间细胞因子模式是否不同。值得注意的是,我们观察到,尽管没有成为危重患者的COVID-19患者产生的I型或III型IFN很少,但与健康和非危重患者相比,危重患者的IFN-λ水平在1-3天的时间间隔内显著升高(图1-3)。gydF4y2Ba2gydF4y2Ba).部分危重患者也产生IFN-α(图5)。gydF4y2Ba2gydF4y2Ba),尽管与非住院的轻度流感患者相比,其剂量明显较低(图2)。gydF4y2Ba2gydF4y2Ba)或流感住院患者总数(包括危重和非危重患者;gydF4y2BaPgydF4y2Ba< 0.05)。相反,所有COVID-19患者均产生促炎细胞因子如TNF、IL-6、IL-8、IL-10和IFN-γ,危重患者在特定时间间隔内也表现出明显高于非危重患者的IL-6和IL-7浓度,IFN-γ有升高的趋势,与他们所处的高炎症状态一致(图1)。gydF4y2Ba2gydF4y2Ba和扩展数据图。gydF4y2Ba6gydF4y2Ba).个体患者数据进一步证实了这些趋势(扩展数据图)。gydF4y2Ba7gydF4y2Ba).在非危重患者中,CCL3显著高于健康对照组,而在危重患者中则不显著(图2)。gydF4y2Ba2gydF4y2Ba).相比之下,危重症和非危重症流感患者在制造I型和III型ifn的能力以及促炎细胞因子如TNF、IL-6或IL-7的能力上没有差异(图1)。gydF4y2Ba2gydF4y2Ba和扩展数据图。gydF4y2Ba6gydF4y2Ba).同样,患有轻微流感的非住院患者表现出强烈的I型和III型干扰素的产生,这表明在流感疾病严重程度的范围内,抗病毒反应仍然强劲。他们也表现出类似的促炎细胞因子,如TNF、IL-6、IL-7、IL-8和IFN-γ,但与非危重或危重流感住院患者相比,CCL3水平更高。在雷达图上可视化这些模式可以发现,COVID-19患者在诱导抗病毒和促炎症反应方面存在重大失衡,而在流感中没有出现这种失衡(图1)。gydF4y2Ba2 bgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba短句来源分别对入院或就诊后第1 ~ 3天、7 ~ 10天、非住院轻度流感患者及健康人血清IFN-λ1、IFN-α、IFN-γ、TNF、IL-6、IL-7、IL-8、IL-10和CCL3水平进行比较。点表示个体测量值,线表示住院患者和健康个体的中值。方格表示未住院的流感患者。灰色阴影标志着该方法的定量限度。gydF4y2BabgydF4y2Ba入院后1-3天时间间隔内,COVID-19和流感住院患者中位细胞因子水平和范围的雷达图,病情危重与非危重疾病、非住院流感患者和健康人。雷达图中的每个圆表示浓度从4 - 256pg ml的对数增长gydF4y2Ba−1gydF4y2Ba如健康对照组所示。1-3天,gydF4y2BangydF4y2Ba分别为9、7、24、13和3。7-10天,gydF4y2BangydF4y2Ba分别= 8、13、15、12和2。对于健康的人来说gydF4y2BangydF4y2Ba= 10。gydF4y2BaPgydF4y2Ba值由双尾曼-惠特尼模型确定gydF4y2BaU -gydF4y2Ba检验非参数比较。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01和***gydF4y2BaPgydF4y2Ba< 0.001显著高于健康对照组。gydF4y2Ba#gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2Ba# #gydF4y2BaPgydF4y2Ba< 0.01,gydF4y2Ba# # #gydF4y2BaPgydF4y2BaCOVID-19亚组与流感亚组间< 0.001显著性。gydF4y2Ba
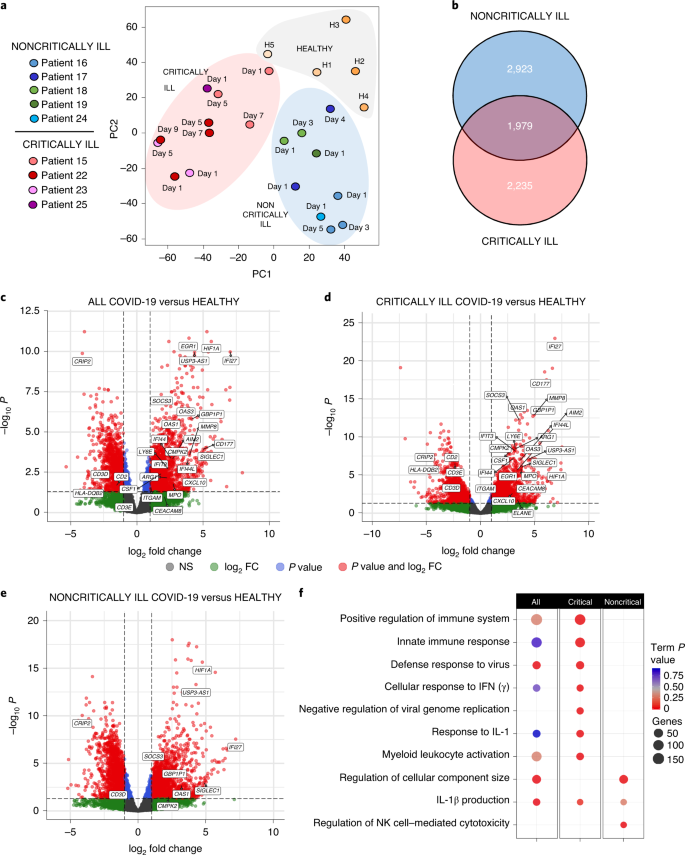
接下来,我们试图确定COVID-19患者的细胞因子模式失衡是否与系统免疫效应和与疾病严重程度相关的参数有关。为此,我们从5名健康个体和9名COVID-19患者(5名非危重患者和4名危重患者)中获取了临时性WBC转录组,从进入病房或ICU的第一天开始,并在之后的不同时间点开始。总共分析了24个RNA-seq基因表达综合数据集。聚类分析显示,样本根据临床表型的严重程度进行分组,表明这是变异的主要来源,并提供了一种预测哪些患者将进展为危重或非危重疾病的方法(图5)。gydF4y2Ba3gydF4y2Ba和扩展数据图。gydF4y2Ba8gydF4y2Ba).将第1天作为最相关的时间点,我们发现与健康个体相比,COVID-19患者中有4,225个基因表达差异(补充表)gydF4y2Ba3.gydF4y2Ba).当危重症和非危重症患者分别与健康对照组比较时,分别观察到4214和4902个差异表达基因(DEGs),其中1979个是常见的,其余的是在一个或另一个患者组中唯一发现的(图。gydF4y2Ba3 bgydF4y2Ba及补充表格gydF4y2Ba3.gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba).在这些DEGs中,2674个基因在危重患者和非危重患者之间也存在显著差异(补充表)gydF4y2Ba5gydF4y2Ba).火山图显示,两组之间最受调控的基因存在显著差异,危重患者表现出更强的免疫和抗病毒反应基因模式(图1)。gydF4y2Ba3汉英gydF4y2Ba).DEGs的通路分析确实揭示了危重患者中最显著的过度表达通路与免疫系统的正向调节、先天免疫反应的激活、对病毒的防御反应和对IFN的细胞反应相关(图1)。gydF4y2Ba3 fgydF4y2Ba及补充表gydF4y2Ba6gydF4y2Ba).IL-1β产生途径的诱导和对IL-1的反应也很明显。相比之下,在非危重症患者中,除了IL-1β产生通路外,这些通路没有明显上调(图1)。gydF4y2Ba3 fgydF4y2Ba).其他过度表达的途径包括调节细胞成分的大小和自然杀伤(NK)细胞毒性(图1)。gydF4y2Ba3 fgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,危重症患者外周血WBC转录组的主成分分析(gydF4y2BangydF4y2Ba= 4)和非危重症(gydF4y2BangydF4y2Ba= 5)患者或健康(H1-H5)对照者(gydF4y2BangydF4y2Ba= 5)。gydF4y2BabgydF4y2Ba,显示危重症患者外周血WBC转录组独特和常见DEGs的Venn图(gydF4y2BangydF4y2Ba= 4)和非危重症(gydF4y2BangydF4y2Ba= 5)患者与健康(gydF4y2BangydF4y2Ba= 5)个人。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba火山绘图显示,在所有COVID-19患者中,DEGs的上调最为显著(gydF4y2BacgydF4y2Ba)和他们的批判性(gydF4y2BadgydF4y2Ba)和非危重症(gydF4y2BaegydF4y2Ba)亚组与健康个体的比较。DEG分析采用DESeq2 v.1.22.2。FC,折变;NS,不显著。gydF4y2BafgydF4y2Ba、所有COVID-19危重症和非危重症患者在住院或进入ICU第1天的DEGs基因本体论(GO)通路富集分析。ClueGO被雇用和期限gydF4y2BaPgydF4y2Ba使用Bonferroni校正进行多次比较。可视化是使用ggplot2 R包执行的。点的大小表示每个通路差异表达的基因数量,红色表示有统计学意义。gydF4y2Ba
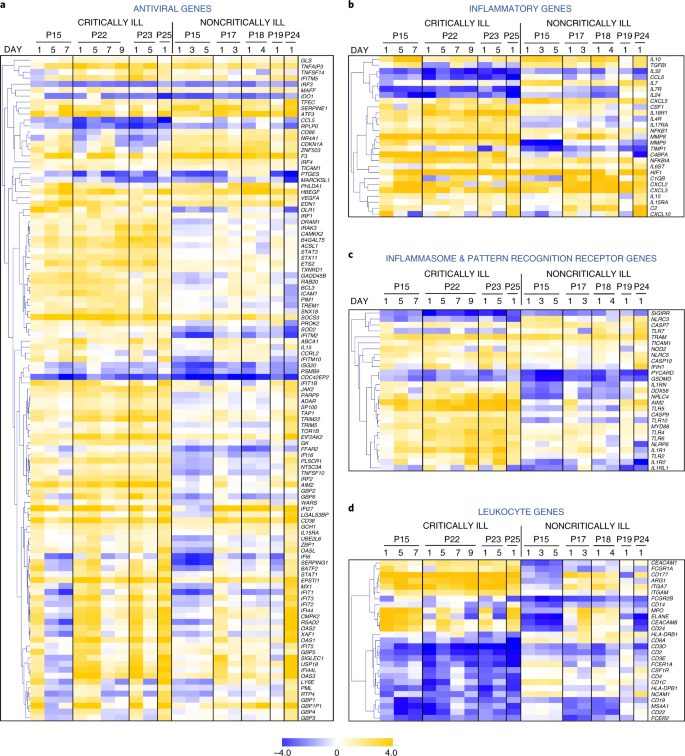
因此,带有时间信息的热图揭示了一长组抗病毒基因在危重患者中的强烈诱导,而在非危重患者组中只有一小部分抗病毒基因上调(图1)。gydF4y2Ba4gydF4y2Ba及补充表gydF4y2Ba3.gydF4y2Ba).该集合包括经典的抗病毒反应基因,可由I型和III型IFN诱导,如gydF4y2BaStat1gydF4y2Ba,gydF4y2BaStat3gydF4y2Ba,gydF4y2BaIrf1gydF4y2Ba,gydF4y2BaIrf2gydF4y2Ba,gydF4y2BaSocs3gydF4y2Ba,gydF4y2BaIsg20gydF4y2Ba,gydF4y2BaOaslgydF4y2Ba,gydF4y2BaIfi5gydF4y2Ba,gydF4y2BaIfit1bgydF4y2Ba,gydF4y2BaIfit5gydF4y2Ba,gydF4y2BaIfitm10gydF4y2Ba,gydF4y2Ba1英镑gydF4y2Ba,gydF4y2Ba2英镑gydF4y2Ba,gydF4y2Ba4英镑gydF4y2Ba,gydF4y2Ba5英镑gydF4y2Ba而且gydF4y2Ba6英镑gydF4y2Ba与非危重症患者或健康个体相比,均显著上调gydF4y2BaIrf3gydF4y2Ba,gydF4y2BaSocs3gydF4y2Ba,gydF4y2Bamx₁gydF4y2Ba,gydF4y2BaOas1gydF4y2Ba,gydF4y2BaIfi27gydF4y2Ba,gydF4y2BaIfi44gydF4y2Ba而且gydF4y2BaIfitm5gydF4y2Ba非危重症患者也上调,但上调幅度低于危重症患者(补充表)gydF4y2Ba5gydF4y2Ba).第1天表达的抗病毒基因集比较如图所示。gydF4y2Ba4gydF4y2Ba证实危重症患者与非危重症患者之间有统计学显著差异(gydF4y2BaPgydF4y2Ba= 1.25 × 10gydF4y2Ba−20gydF4y2Ba),这与这些患者中IFN λ和I型IFN产生的不同模式一致。危重患者中I/III型IFN反应较强不太可能是由于IFN受体组分的高表达,因为两者之间未观察到显著差异gydF4y2BaIfnlr1gydF4y2Ba,gydF4y2BaIl10rbgydF4y2Ba而且gydF4y2BaIfnar1gydF4y2Ba除危重症患者Ifnar2水平增加两倍外,其他患者组和健康人mRNA水平均升高(补充表gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
进一步的热图分析表明,危重患者有更强的全身固有免疫反应,其标志是关键促炎介质的表达增加,包括补体成分(gydF4y2BaC2gydF4y2Ba,gydF4y2BaC4bpagydF4y2Ba)、细胞因子(gydF4y2BaCsf1gydF4y2Ba,gydF4y2BaCxcl10gydF4y2Ba)和基质金属蛋白酶(gydF4y2BaMmp8gydF4y2Ba,gydF4y2BaMmp9gydF4y2Ba)优于健康个体(图5)。gydF4y2Ba4 bgydF4y2Ba).相反,非危重症患者表达增强gydF4y2BaIl10gydF4y2Ba这是一种主要的抗炎蛋白抑制细胞因子风暴gydF4y2BaIl7gydF4y2Ba这与维持周围T细胞的内稳态有关。值得注意的是,炎性小体基因如gydF4y2BaNlrp6gydF4y2Ba,gydF4y2BaNrlc4gydF4y2Ba,gydF4y2BaNod2gydF4y2Ba,gydF4y2BaAim2gydF4y2Ba,gydF4y2BaCasp9gydF4y2Ba,gydF4y2BaCasp10gydF4y2Ba,gydF4y2BaIl1rngydF4y2Ba而且gydF4y2BaIl1r1gydF4y2Ba这些都与IL-1β的产生或反应有关gydF4y2Ba20.gydF4y2Ba,在COVID-19危重患者中也上调,而gydF4y2BaPycardgydF4y2Ba(gydF4y2BaAscgydF4y2Ba),炎症小体组装的一个关键成分,在非危重症患者中比健康个体中下调,表明IL-1β通路在更严重的疾病中发挥突出作用(图。gydF4y2Ba4摄氏度gydF4y2Ba).模式识别受体(PRRs)参与微生物的识别,如gydF4y2BaDdx58gydF4y2Ba(gydF4y2Ba瑞吉gydF4y2Ba),gydF4y2BaAim2gydF4y2Ba,gydF4y2BaIfih1gydF4y2Ba(gydF4y2BaMda5gydF4y2Ba),gydF4y2BaIfi16gydF4y2Ba,gydF4y2BaTlr2和Tlr4gydF4y2Ba,也上调了。总的来说,当作为一个集合比较时,炎症小体和PRR基因如图所示。gydF4y2Ba4摄氏度gydF4y2Ba两组间差异显著(gydF4y2BaPgydF4y2Ba= 9.72 × 10gydF4y2Ba−7gydF4y2Ba).在细胞类型水平,基因表达分析显示显性激活的中性粒细胞/髓样细胞特征(gydF4y2BaMpogydF4y2Ba,gydF4y2BaElanegydF4y2Ba,gydF4y2BaCd177gydF4y2Ba,gydF4y2BaItgamgydF4y2Ba,gydF4y2Ba__arg1gydF4y2Ba,gydF4y2BaCeacam8gydF4y2Ba而且gydF4y2BaFcgr1agydF4y2Ba),在危重患者中较轻,在非危重患者中不显著(图5。gydF4y2Ba4 dgydF4y2Ba).相反,T、B、NK淋巴细胞谱系及相关基因(gydF4y2BaCd3dgydF4y2Ba,gydF4y2BaCd3egydF4y2Ba,gydF4y2BaCd4gydF4y2Ba,gydF4y2BaCd8agydF4y2Ba,gydF4y2BaCd19gydF4y2Ba,gydF4y2BaCd22gydF4y2Ba而且gydF4y2BaNcam1gydF4y2Ba)在危重患者中明显下调。这些数据与淋巴减少、高中性粒细胞计数和高N/L比在这些患者中也存在一致(扩展数据图)。gydF4y2Ba4gydF4y2Ba),此前也有报道称与COVID-19患者更严重的疾病和更糟糕的预后有关(参考文献。gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba).TNF、IL-6和IL-8等细胞因子可能直接导致这些影响,因为众所周知,它们可触发中性粒细胞的动员和激活、淋巴细胞减少的发展以及先天免疫反应和全身炎症的诱导gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba.因此,COVID-19患者在住院早期的WBC转录组可以提供有关疾病严重程度的重要信息,并指导以更个性化的方式给药IL-1抑制剂等治疗。gydF4y2Ba
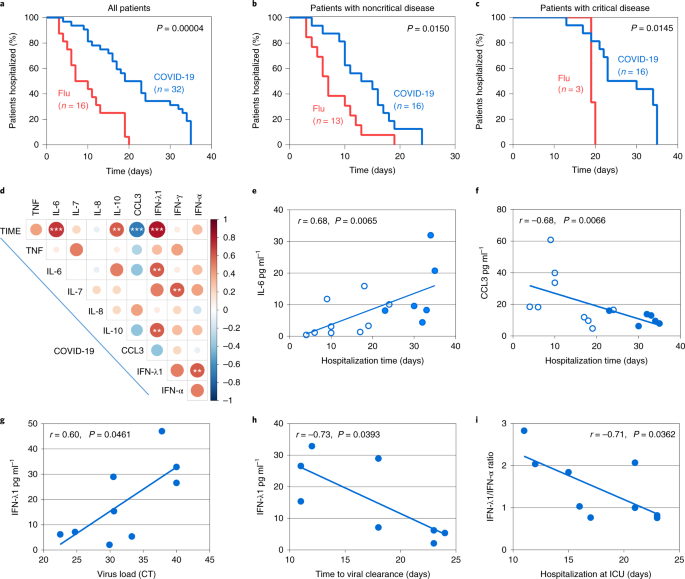
有趣的是,与流感相比,COVID-19合并肺炎患者的细胞因子模式失衡与更糟糕的疾病结局相关。首先,COVID-19组表现出较高的危重疾病发生率和死亡率(扩展数据图)。gydF4y2Ba5gydF4y2Ba).第二,COVID-19患者,以及被分为危重和非危重患者的患者,比流感患者需要更长时间的住院时间(图1)。gydF4y2Ba5 a - cgydF4y2Ba).对于非危重型和危重型COVID-19患者,中位时间分别为14和23 d,而流感患者为7和19 d(图。gydF4y2Ba5 b, cgydF4y2Ba).延长住院时间可能归因于未调整的抗病毒反应,导致COVID-19的临床病程较流感更长,即使是非危重患者也需要更长的恢复时间。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba, COVID-19患者与流感患者住院时间比较。所有病人(gydF4y2Ba一个gydF4y2Ba)、非危重症患者(gydF4y2BabgydF4y2Ba)和危重病人(gydF4y2BacgydF4y2Ba)。gydF4y2BadgydF4y2Ba, COVID-19患者入院后第1-3天间隔血清细胞因子浓度相关矩阵,细胞因子与住院总时间(time)或其他细胞因子的相关性。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba, IL-6相关性(gydF4y2BaegydF4y2Ba)及CCL3 (gydF4y2BafgydF4y2Ba)血清水平与所有COVID-19患者总住院时间的关系。gydF4y2BaggydF4y2Ba, IFN-λ1水平与病毒载量的相关性以ct值表示,在与用于IFN-λ1量化的血清相同时间间隔收集支气管抽吸物。gydF4y2BahgydF4y2Ba, IFN-λ1水平与首次SARS-CoV-2检测阴性病毒清除所需时间的相关性。gydF4y2Ba我gydF4y2BaIFN-λ1:IFN-α比值与ICU住院时间的相关性。点表示COVID-19患者的个体测量值。开点和阴影点分别对应COVID-19非危重患者和危重患者(gydF4y2BaegydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba).为gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba,gydF4y2BaPgydF4y2Ba采用log-rank检验确定患者组间住院曲线的比较值。为gydF4y2BadgydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba,gydF4y2BaPgydF4y2Ba使用非参数数据的斯皮尔曼秩序相关系数确定两个变量之间关联的强度和方向的值,如每个面板中所示。**gydF4y2BaPgydF4y2Ba< 0.01和***gydF4y2BaPgydF4y2Ba< 0.001。gydF4y2Ba
识别能够预测住院时间的细胞因子和细胞因子组合,从而独立于已知的实验室和临床严重程度参数(如OgydF4y2Ba2gydF4y2Ba饱和度、呼吸频率或N/L比),我们生成了入院时(1-3天间隔)细胞因子水平与住院时间的相关性矩阵(图1-3)。gydF4y2Ba4 dgydF4y2Ba).我们发现,较高的IL-6和IL-10,较低的CCL3浓度,与住院时间成正比(图。gydF4y2Ba5 d-fgydF4y2Ba).IL-6和IL-10作为监测COVID-19严重程度的生物标志物的价值已被报道gydF4y2Ba4gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba但对CCL3来说,这是新的。值得注意的是,IFN λ浓度也与较高的IL-6和IL-10以及较长的住院时间相关,这与它们在危重患者中几乎完全诱导而非非危重患者一致(图1)。gydF4y2Ba5 dgydF4y2Ba).gydF4y2Ba
一个问题是危重患者体内诱导的IFN水平是否有益,因为在动物模型中已经显示I型或III型IFN产生延迟会引起免疫病理gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba25gydF4y2Ba或干扰上皮修复gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,分别。我们发现,进入ICU期间较高的IFN-λ浓度与呼吸道内较低的SARS-CoV-2病毒载量和更快的病毒清除有关(图。gydF4y2Ba5克,gydF4y2Ba).此外,当时较高的IFN-λ与I型IFN的比值与在ICU住院时间较短有关(图。gydF4y2Ba5我gydF4y2Ba),两名IFN-α水平最高的患者住院时间也最长(均为23 d,中位数为17 d)。这些数据表明,在COVID-19危重患者中,延迟的IFN-λ诱导可能仍然具有保护作用,而IFN-α可能弊大于利,至少在一部分患者中是这样。gydF4y2Ba
综上所述,我们的研究结果表明,SARS-CoV-2感染不遵循传统的抗病毒免疫范式。它不是首先激活抗病毒反应然后是促炎过程作为第二道保护线,它的作用相反;它会在ifn介导的抗病毒防御被诱导之前很久触发促炎反应。这种情况是一个主要的悖论,有助于解释COVID-19的许多独特或不寻常的特征。病毒在呼吸道的长潜伏期和持续时间,使SARS-CoV-2检测呈阳性数周,可归因于I型和III型ifn的产生延迟和/或减少。患者在异常长时间内无症状或症状非常轻微,可归因于I型干扰素的缺乏或受损和延迟表达,I型干扰素是人类流感样疾病和流鼻涕、咳嗽、疲劳、呼吸困难和发热等症状的主要介质gydF4y2Ba28gydF4y2Ba.最后,促炎细胞因子的早期和持续表达最终发展为长时间的高炎症,可促进呼吸衰竭的突然发展,需要住院和频繁的ICU住院。值得注意的是,在流感中,I型和III型IFN反应的迅速诱导,在疾病严重程度的范围内,与快速恢复和显著降低危重疾病发生率或死亡率相关gydF4y2Ba13gydF4y2Ba,gydF4y2Ba25gydF4y2Ba.最近一项446例COVID-19患者的回顾性队列研究表明,早期给予IFN-α (IFN-a2b)与降低住院死亡率有关,而晚期IFN-α治疗导致死亡率增加和恢复延迟,这无疑表明,IFN产生的时机对COVID-19患者也至关重要(参考文献)。gydF4y2Ba29gydF4y2Ba).可以想象的是,I型或III型IFN的后期产生可能不会产生病毒耐药性,但反而会促进免疫病理。gydF4y2Ba
COVID-19这种独特的临床过程是否与之前提出的针对SARS-CoV的SARS-CoV-2衍生IFN抑制剂的存在有关gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba和MERS-CoVgydF4y2Ba32gydF4y2Ba尚不清楚,但有可能。与其他病毒一样,一旦达到较高的病毒载量,例如在病毒孵化并最终在易感人群中传播之后,抑制作用可能会被克服。在我们的研究中,我们没有发现检测ifn时非危重患者和危重患者之间的病毒水平有显著差异(扩展数据图)。gydF4y2Ba9gydF4y2Ba).然而,在一项研究中,严重疾病的病毒载量高于轻度疾病,但未在另一项研究中得到证实gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba.此外,较高的病毒载量可以克服SARS-CoV-2对培养的呼吸上皮细胞中IFN产生的剂量依赖性抑制gydF4y2Ba16gydF4y2Ba.gydF4y2Ba
我们的研究并非没有需要注意的地方。首先,它描述了循环中的细胞因子模式,尽管这些通常被用于分析感染反应中的“细胞因子风暴”,但它们与呼吸道中的免疫反应之间的关联程度很难知道。其次,我们的研究规模相对较小,我们的发现还有待其他队列的验证。尽管如此,我们的研究具有独特的信息量,因为它以从住院到进入ICU的时间方式解决了IFN的产生和“细胞因子风暴”在COVID-19中的激活,因此应该对IFN疗法的临床试验设计特别有用。它还描述了IL-6和CCL3等生物标志物和基因表达签名,这些标志物对评估新入院的COVID-19患者的危重疾病发展风险和住院时间特别有用。最后,它提供了COVID-19与流感的并排比较,研究了具有相似遗传、人口统计学和临床病理特征的患者群体,从而揭示了这两种疾病之间抗病毒免疫反应的重要差异,这些差异以前没有被怀疑过。gydF4y2Ba
方法gydF4y2Ba
研究参与者gydF4y2Ba
在这项非介入性研究中,纳入了32例根据世界卫生组织指南诊断为COVID-19肺炎、呼吸道样本(鼻咽拭子或支气管吸入)SARS-CoV-2 PCR反转录(RT-PCR)检测阳性的患者gydF4y2Ba18gydF4y2Ba.患者于2020年3月至4月从1gydF4y2Ba圣gydF4y2Ba希腊雅典“Sotiria”胸部疾病综合医院的呼吸和危重护理临床病房和ICU。纳入时SARS-CoV-2 RT-PCR阳性的健康无症状个体作为对照组。gydF4y2Ba
根据《新型冠状病毒感染的肺炎诊疗指南(试行修订版)》的改编,对病例的严重程度进行分级gydF4y2Ba35gydF4y2Ba.所有患者均为中度至重度疾病,表现为呼吸道症状和肺炎的影像学表现。他们符合以下任何一个标准:gydF4y2Ba
- 1.gydF4y2Ba
呼吸窘迫(≥30次/分钟)gydF4y2Ba−1gydF4y2Ba);gydF4y2Ba
- 2.gydF4y2Ba
静息时氧饱和度≤93%;gydF4y2Ba
- 3.gydF4y2Ba
动脉氧分压(PaOgydF4y2Ba2gydF4y2Ba)/吸入氧的分数(FiOgydF4y2Ba2gydF4y2Ba)≤300mmhg,无其他器官衰竭。gydF4y2Ba
16例患者发生呼吸窘迫综合征(ARDS)和呼吸衰竭(PaO)引起的危重症gydF4y2Ba2gydF4y2Ba/ FiOgydF4y2Ba2gydF4y2Ba≤200mm Hg),需要机械通气,伴有休克和/或其他器官衰竭,需要ICU护理。住院期间和出院时在不同时间间隔抽血;白细胞和血清收集并储存,待将来使用。gydF4y2Ba
为了更好地了解COVID-19感染的免疫反应,我们还研究了一组确诊甲型H1N1/H3N2流感病毒感染的患者。2018年12月至2019年5月期间,共招募了40名患者gydF4y2BandgydF4y2Ba希腊雅典“Sotiria”胸部疾病综合医院呼吸科和希腊雅典雅典大学医学院“Attikon”大学医院。使用BioFire FilmArray呼吸板试验(bioMerieux)从鼻咽拭子中获得确认。与COVID-19患者类似,根据疾病的严重程度,流感患者被分为无肺炎放射学发现、不需要氧气支持和住院的轻症患者和有肺炎放射学发现(x光或计算机断层扫描)、需要氧气和需要住院的症状的中重度患者gydF4y2Ba36gydF4y2Ba.住院的流感患者被细分为未发展成(PaO)的患者gydF4y2Ba2gydF4y2Ba/ FiOgydF4y2Ba2gydF4y2Ba> 200 mmhg)或发生危重症(PaO)gydF4y2Ba2gydF4y2Ba/ FiOgydF4y2Ba2gydF4y2Ba≤200 mm Hg)。流感患者入院时与COVID-19患者有相似的临床病理特征(补充表)gydF4y2Ba1gydF4y2Ba).所有纳入研究的患者在整个住院期间(从入院到出院)进行了临床评估和纵向随访。所有血液标本立即处理以收集血清,等份保存在−80°C。此外,我们还收集了10名中位年龄为54.5岁(41-70岁)的健康个体的血清,其中3名男性和7名女性。gydF4y2Ba
该研究符合《赫尔辛基宣言》中概述的原则,并获得了希腊雅典“Sotiria”胸部疾病综合医院(批准号为16707/10-7-18和8385/31-3-20)和希腊雅典大学医学院“Attikon”大学医院(批准号为1821A/22-9-16)伦理委员会的批准。所有参与者都提供了书面知情同意。gydF4y2Ba
SARS-CoV-2检测gydF4y2Ba
根据制造商说明,使用Nuclisens easyMAG仪器(bioMerieux)从鼻咽拭子和支气管吸入物中提取RNA。使用鼻咽拭子进行初步诊断,而在ICU使用支气管抽吸器评估病毒载量。对提取的SARS-CoV-2 E基因核酸进行实时RT-PCRgydF4y2Ba37gydF4y2Ba.gydF4y2Ba
细胞因子分析gydF4y2Ba
在−20℃冷冻和储存的血清样本中,不进行其他解冻,分析IFN-γ、TNF、IL-1β、IL-2、IL-4、IL-6、IL-7、IL-8、IL-10、IL-12 (p70)、IL-13、IL-17A、IL-23、CCL3、CCL4和CX3CL1的存在,使用MILLIPLEX MAP人类高灵敏度T细胞检测试剂盒(Merck Millipore)。解冻的血清等份在下午13000转离心。测试前立即在4℃下放置10分钟。每次检测都根据制造商的血清样品方案进行,使用推荐的样品稀释度和标准曲线浓度(默克Millipore)。根据制造商的说明(默克Millipore),在Luminex 200系统上使用Luminex xPonent v.3.1软件对样品进行分析。对于每一种细胞因子,每一种检测方法的最低检出限为pg mlgydF4y2Ba−1gydF4y2BaIFN-γ为0.50,TNF为0.42,IL-1β为0.2,IL-2为0.24,IL-4为0.60,IL-6为0.16,IL-7为0.33,IL-8为0.30,IL-10为0.50,IL-12为0.24 (p70), IL-13为0.20,IL-17A为0.50,IL-23为8.00,CCL3为2.00,CCL4为0.80,CX3CL1为10.00采用高灵敏度夹心ELISA试剂盒检测人IFN-α (Abcam)和IFN-λ1 (BioLegend)。其敏感性在pg mlgydF4y2Ba−1gydF4y2BaIFN-α为1.00,IFN-λ1为2.00。使用Biotek Gen5 v.1.05软件获取数据并进行分析。gydF4y2Ba
RNA-seq分析gydF4y2Ba
RNA-seq分析使用RNeasy Micro kit (QIAGEN)从全血白细胞中纯化总RNA。RNA样本用DNase I (QIAGEN)处理,并在NanoDrop上定量(Thermo Fisher Scientific)。用TruSeq RNA文库准备试剂盒v.2制备下一代测序文库(Illumina)按照制造商的说明。在安捷伦2100生物分析仪上使用安捷伦DNA 1000试剂盒对文库的质量进行验证。此分析返回日志gydF4y2Ba2gydF4y2Ba与健康个体相比,治疗在每个时间点发生了成倍的变化。所有COVID-19危重症和非危重症患者的DEG转录本是根据调整后的gydF4y2BaPgydF4y2Ba临界值为0.05(错误发现率(FDR)为5%)。对危重症和非危重症的COVID-19 DEGs进行了进一步的统计比较。使用Cytoscape的ClueGO和CluePedia插件对健康个体的deg进行通路富集分析。采用TM4 MeV v.4.8进行热图绘制,采用欧氏距离进行分层聚类。在R中分别使用hclust函数和ggdendro包进行聚类和树状图。gydF4y2Ba
转录组分析gydF4y2Ba
用NextSeq 500 (Illumina)测序的样品使用标准协议进行分析。简单地说,原始读取使用FastQC v.0.11.2和cutadapt v.1.6进行预处理,然后使用TopHat 2.0.13版本、Bowtie v.1.1.1版本和Samtools v.1.1版本将其映射到人类基因组(GRCh38)。使用HTSeq v.0.6生成读计数表。在至少一个数据集中以阈值10过滤原始读取计数,结果共得到21880个基因。DESeq2分析gydF4y2Ba38gydF4y2Ba在危重症和非危重症患者及健康人、危重症和非危重症患者中进行。此分析返回日志gydF4y2Ba2gydF4y2Ba与健康个体相比,治疗在每个时间点发生了成倍的变化。DEG转录本的选择基于一个调整gydF4y2BaPgydF4y2Ba临界值为0.05 (FDR为5%)。通路富集分析使用Cytoscape的ClueGO和CluePedia插件进行。采用TM4 MeV v.4.8进行热图绘制,采用欧氏距离进行分层聚类。在R中分别使用hclust函数和ggdendro包进行聚类和树状图。gydF4y2Ba
统计分析gydF4y2Ba
数据分析采用GraphPad Prism软件。用Mann-Whitney量表评估细胞因子水平差异的统计学意义gydF4y2BaUgydF4y2Ba-test非参数数据。细胞因子水平与住院时间(以天为单位)之间的相关性采用Spearman秩序相关系数进行检验,并用corrplot R软件包进行可视化分析。使用双尾Student 's评估基因组间差异的统计学意义gydF4y2BatgydF4y2Ba-test参数数据。使用ggplot2 R包中的极坐标图来可视化细胞因子反应模式的差异。gydF4y2Ba
报告总结gydF4y2Ba
关于研究设计的进一步信息可在gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到本文。gydF4y2Ba
数据可用性gydF4y2Ba
支持本研究结果的数据可根据要求从通讯作者处获得。RNA-seq原始数据已存入基因表达综合(gydF4y2Bahttp://www.ncbi.nlm.nih.gov/geo/gydF4y2Ba)在生物计划登入编号下gydF4y2BaPRJNA638753gydF4y2Ba并且是公开的。gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
病毒和干扰素。gydF4y2Ba为基础。启Microbiol。gydF4y2Ba55gydF4y2Ba, 255-281(2001)。gydF4y2Ba
- 2.gydF4y2Ba
McNab, F., Mayer-Barber, K., Sher, A., Wack, A. & O 'Garra, A.传染病中的I型干扰素。gydF4y2Ba免疫1;gydF4y2Ba15gydF4y2Ba, 87-103(2015)。gydF4y2Ba
- 3.gydF4y2Ba
关文杰等。2019冠状病毒病的临床特征gydF4y2Ba心血管病。j .地中海。gydF4y2Ba382gydF4y2Ba, 1708-1720(2020)。gydF4y2Ba
- 4.gydF4y2Ba
黄,C.等。武汉市新型冠状病毒感染患者的临床特征gydF4y2Ba《柳叶刀》gydF4y2Ba395gydF4y2Ba, 497-506(2020)。gydF4y2Ba
- 5.gydF4y2Ba
Wolfel, R.等人。COVID-2019住院患者的病毒学评估。gydF4y2Ba自然gydF4y2Ba581gydF4y2Ba, 465-469(2020)。gydF4y2Ba
- 6.gydF4y2Ba
郑s,等。2020年1月至3月中国浙江省SARS-CoV-2感染患者的病毒载量动态和疾病严重程度:回顾性队列研究gydF4y2Ba英国人。地中海。J。gydF4y2Ba369gydF4y2Ba, m1443(2020)。gydF4y2Ba
- 7.gydF4y2Ba
Taubenberger, J. K. & Morens, D. M.流感病毒感染的病理学。gydF4y2Ba为基础。启分册。gydF4y2Ba3.gydF4y2Ba, 499-522(2008)。gydF4y2Ba
- 8.gydF4y2Ba
保罗斯,C.和苏巴拉奥,K.流行性感冒。gydF4y2Ba《柳叶刀》gydF4y2Ba390gydF4y2Ba, 697-708(2017)。gydF4y2Ba
- 9.gydF4y2Ba
莱斯勒,J.等。急性呼吸道病毒感染的潜伏期:系统综述。gydF4y2Ba柳叶刀感染。说。gydF4y2Ba9gydF4y2Ba, 291-300(2009)。gydF4y2Ba
- 10.gydF4y2Ba
梅塔,P.等人。COVID-19:考虑细胞因子风暴综合征和免疫抑制。gydF4y2Ba《柳叶刀》gydF4y2Ba395gydF4y2Ba, 1033-1034(2020)。gydF4y2Ba
- 11.gydF4y2Ba
吴,C.等。与中国武汉2019冠状病毒病肺炎患者急性呼吸窘迫综合征和死亡相关的危险因素gydF4y2BaJAMA实习生。地中海。gydF4y2Ba180gydF4y2Ba, 934-943(2020)。gydF4y2Ba
- 12.gydF4y2Ba
杨,X.等。中国武汉SARS-CoV-2肺炎危重患者的临床病程和转归:一项单中心、回顾性、观察性研究gydF4y2Ba和出版的《柳叶刀》杂志上。地中海gydF4y2Ba.gydF4y2Ba8gydF4y2Ba, 475-481(2020)。gydF4y2Ba
- 13.gydF4y2Ba
加拉尼,i.e.等人。干扰素λ介导对流感病毒感染的非冗余的一线抗病毒保护,而不影响宿主的适合度。gydF4y2Ba免疫力gydF4y2Ba46gydF4y2Ba, 875 - 890。e6(2017)。gydF4y2Ba
- 14.gydF4y2Ba
张晓燕,张晓燕,张晓燕。干扰素αβ在急性流感感染中的潜在致病性。gydF4y2BaCommun Nat。gydF4y2Ba5gydF4y2Ba, 3864(2014)。gydF4y2Ba
- 15.gydF4y2Ba
Andreakos, E, Zanoni, I. & Galani, I. λ干扰素来光:双重功能细胞因子介导抗病毒免疫和损伤控制。gydF4y2Ba咕咕叫。当今。Immunol。gydF4y2Ba56gydF4y2Ba, 67-75(2019)。gydF4y2Ba
- 16.gydF4y2Ba
布朗-甜瓜,D.等。宿主对SARS-CoV-2的不平衡反应推动了COVID-19的发展。gydF4y2Ba细胞gydF4y2Ba181gydF4y2Ba, 1036-1045(2020)。gydF4y2Ba
- 17.gydF4y2Ba
Hadjadj, J.等。重型COVID-19患者I型干扰素活性受损和炎症反应。gydF4y2Ba科学gydF4y2Ba369gydF4y2Ba, 718-724(2020)。gydF4y2Ba
- 18.gydF4y2Ba
世界卫生组织。COVID-19的临床管理:临时指南,2020年5月27日。gydF4y2Bahttps://apps.who.int/iris/handle/10665/332196gydF4y2Ba(2020)。gydF4y2Ba
- 19.gydF4y2Ba
Lim, W. S.等。定义住院时社区获得性肺炎的严重程度:一项国际推导和验证研究gydF4y2Ba胸腔gydF4y2Ba58gydF4y2Ba, 377-382(2003)。gydF4y2Ba
- 20.gydF4y2Ba
炎症小体复合体:新出现的机制和效应功能。gydF4y2Ba细胞gydF4y2Ba165gydF4y2Ba, 792-800(2016)。gydF4y2Ba
- 21.gydF4y2Ba
病毒感染中的中性粒细胞:目前的概念和注意事项。gydF4y2Baj . Leukoc。医学杂志。gydF4y2Ba98gydF4y2Ba, 557-564(2015)。gydF4y2Ba
- 22.gydF4y2Ba
曼加尔穆尔蒂和亨特,C. A.细胞因子风暴:了解COVID-19。gydF4y2Ba免疫力gydF4y2Ba53gydF4y2Ba, 19-25(2020)。gydF4y2Ba
- 23.gydF4y2Ba
陈,G.等。2019年重、中度冠状病毒病的临床和免疫学特征。gydF4y2Baj .中国。投资。gydF4y2Ba130gydF4y2Ba, 2620-2629(2020)。gydF4y2Ba
- 24.gydF4y2Ba
刘涛等。白细胞介素-6在监测2019年冠状病毒重症病例中的作用。gydF4y2BaEMBO摩尔医学。gydF4y2Ba12gydF4y2Ba, e12421(2020)。gydF4y2Ba
- 25.gydF4y2Ba
Channappanavar, R.等。I型干扰素失调和炎性单核细胞-巨噬细胞反应导致sars - cov感染小鼠的致死性肺炎。gydF4y2Ba细胞宿主微生物gydF4y2Ba19gydF4y2Ba, 181-193(2016)。gydF4y2Ba
- 26.gydF4y2Ba
Broggi, A.等。III型干扰素在病毒识别时破坏肺上皮屏障。gydF4y2Ba科学gydF4y2Ba369gydF4y2Ba, 706-712(2020)。gydF4y2Ba
- 27.gydF4y2Ba
少校,j等人。I型和III型干扰素在病毒感染恢复过程中破坏肺上皮修复。gydF4y2Ba科学gydF4y2Ba369gydF4y2Ba712-717(2020)。gydF4y2Ba
- 28.gydF4y2Ba
王伯祥、费恩宁、病毒与干扰素的阴阳关系。gydF4y2BaImmunol趋势。gydF4y2Ba33gydF4y2Ba, 190-197(2012)。gydF4y2Ba
- 29.gydF4y2Ba
王宁,等。回顾性多中心队列研究显示早期干扰素治疗与COVID-19患者良好的临床反应相关。gydF4y2Ba细胞宿主微生物gydF4y2Ba28gydF4y2Ba, 455-464(2020)。gydF4y2Ba
- 30.gydF4y2Ba
韦莱特,M. G, Orr, M., Frieman, M. B. & Baric, R. S.严重急性呼吸综合征冠状病毒逃避抗病毒信号:nsp1的作用和减毒株的合理设计。gydF4y2Baj .性研究。gydF4y2Ba81gydF4y2Ba, 11620-11633(2007)。gydF4y2Ba
- 31.gydF4y2Ba
Kopecky-Bromberg, s.a, Martínez-Sobrido, L., Frieman, M., Baric, R. A. & Palese, P.严重急性呼吸综合征冠状病毒开放阅读框(ORF) 3b、ORF 6和核衣壳蛋白具有干扰素拮抗剂的功能。gydF4y2Baj .性研究。gydF4y2Ba81gydF4y2Ba, 548-557(2007)。gydF4y2Ba
- 32.gydF4y2Ba
Comar, C. E.等。在MERS冠状病毒感染过程中NS4a和NS4b辅助蛋白拮抗dsrna诱导的先天免疫通路gydF4y2BaMbiogydF4y2Ba10gydF4y2Ba, e00319(2019)。gydF4y2Ba
- 33.gydF4y2Ba
刘勇,刘玉华等。COVID-19轻、重病例的病毒动态。gydF4y2Ba柳叶刀感染。说。gydF4y2Ba20.gydF4y2Ba, 656-657(2020)。gydF4y2Ba
- 34.gydF4y2Ba
他,x等人。COVID-19病毒释放和传播的时间动态。gydF4y2BaNat,地中海。gydF4y2Ba26gydF4y2Ba, 672-675(2020)。gydF4y2Ba
- 35.gydF4y2Ba
国家卫生健康委员会、国家中医药管理局。新型冠状病毒肺炎诊疗方案(试行第七版)。gydF4y2Ba下巴。医学J.(英)gydF4y2Ba133gydF4y2Ba, 1087-1095(2020)。gydF4y2Ba
- 36.gydF4y2Ba
Uyeki, t.m.等。美国传染病学会的临床实践指南:2018年季节性流感诊断、治疗、化学预防和机构暴发管理的最新情况。gydF4y2Ba中国。感染。说。gydF4y2Ba68gydF4y2Ba, 895-902(2019)。gydF4y2Ba
- 37.gydF4y2Ba
Corman, v.m.等人。实时RT-PCR检测新型冠状病毒(2019- ncov)gydF4y2Ba欧元。Surveill。gydF4y2Ba25gydF4y2Ba, 2000045(2020)。gydF4y2Ba
- 38.gydF4y2Ba
Love, M. I., Huber, W. & Anders, S.用DESeq2调节RNA-seq数据的折叠变化和色散估计。gydF4y2Ba基因组医学杂志。gydF4y2Ba15gydF4y2Ba, 550(2014)。gydF4y2Ba
确认gydF4y2Ba
作者感谢A. Gavriil和G. Vatsellas提供的技术援助,感谢P. Katsikis(荷兰Erasmus医学中心)和V. Soumelis(法国巴黎圣路易研究所,Université)对手稿的批判性阅读。E.A.得到了欧洲委员会(IMMUNAID, no。779295和CURE,不。希腊研究和创新基金会(INTERFLU, no. 767015);1574)和詹森制药公司。i.e.m.由希腊研究与创新基金会(relief, no。506)。这项工作得到了希腊胸科学会的资助和Jorge Andres Sanchez Papaspiliou家人和朋友的捐赠。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
N.R, S.T, A.K.和E.A.设计了这项研究;i.e.g., N.R, V.L, V.T, E.K, P.C.F, V.P, V.R, O.K.和e.a进行患者数据和样本收集;V.L.和E.A.对样品进行加工和制备,用于下游分析;e.k.、P.C.F、v.p.、v.r.、O.K.和N.K.进行了医疗评估;对i.e.g.、N.R、V.L、v.t和e.a进行细胞因子测定;i.e.g., M.M.和E.A.进行RNA-seq分析;A.M.测量病毒载量;i.e.g., N.R, V.L, V.T, M.M, E.P, E.K, A.K.和e.a对数据进行分析和解释;e。a起草了手稿并监督了研究。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
同行评审信息gydF4y2Ba同行评审报告可用。gydF4y2Ba自然免疫学gydF4y2Ba感谢匿名审稿人对这项工作的同行评审所做的贡献。L. A. Dempsey是这篇文章的主要编辑,并与编辑团队的其他成员合作管理其编辑过程和同行评审。gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构附属的管辖权要求保持中立。gydF4y2Ba
扩展数据gydF4y2Ba
图1研究中分析的COVID-19和流感患者样本分布。gydF4y2Ba
一个gydF4y2Ba,订购与入院有关的样本。gydF4y2BabgydF4y2Ba,按疾病发作顺序订购的样品。黑方块代表32名COVID-19患者的个体样本,红点代表16名因肺炎住院的流感患者。gydF4y2Ba
图2 COVID-19和流感患者与住院有关的时间细胞因子模式。gydF4y2Ba
纵向随访32例新冠肺炎和16例流感肺炎患者入院后各时间间隔IL-1β、IL-2、IL-4、IL-12、IL-13、IL-17、IL-23、CCL4、CX3CL1水平及10例健康人。数据以散点图的形式表示,其中点表示个别患者的测量值、列的中值和误差柱的范围。对于COVID-19, n = 16、17、21、15、11和8,每个连续6个时间间隔。对于流感,n分别为16、14和11。健康情况下,n = 10。灰色阴影标志着该试验的量化极限。gydF4y2BaPgydF4y2Ba值由非参数比较的双尾Mann-Whitney U检验确定。*gydF4y2BaPgydF4y2Ba< 0.05和**gydF4y2BaPgydF4y2Ba< 0.01显著高于健康对照组。gydF4y2Ba#gydF4y2BaPgydF4y2BaCOVID-19组与流感组之间< 0.05有显著性差异。gydF4y2Ba
图3 COVID-19和流感患者与疾病症状发作相关的时间细胞因子模式。gydF4y2Ba
一个gydF4y2Ba32例新冠肺炎和16例流感肺炎患者及10例健康人发病后按特定时间间隔采样的实验设计示意图。gydF4y2BabgydF4y2Ba发病后各时间间隔IFN-λ1、IFN-α、IFN-γ、TNF、IL-6、IL-7、IL-8、IL-10、CCL3浓度水平。gydF4y2BacgydF4y2Ba发病后不同时间间隔IL-1β、IL-2、IL-4、IL-12、IL-13、IL-17、IL-23、CCL4、CX3CL1浓度水平。数据以散点图的形式表示,其中点表示个别患者的测量值、列的中值和误差柱的范围。对于COVID-19, 5个连续时间间隔的n分别为7、15、17、19和14。对于流感,n分别为16、11、3和11。健康情况下,n = 10。灰色阴影标志着该试验的量化极限。gydF4y2BaPgydF4y2Ba值由非参数比较的双尾Mann-Whitney U检验确定。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01和***gydF4y2BaPgydF4y2Ba< 0.001显著高于健康对照组。gydF4y2Ba#gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2Ba# #gydF4y2BaPgydF4y2Ba< 0.01,gydF4y2Ba# # #gydF4y2BaPgydF4y2Ba< 0.001组与流感组有显著性差异。gydF4y2Ba
图4入院时COVID-19和流感患者的临床实验室参数。gydF4y2Ba
分析了32例因肺炎住院的COVID-19和16例流感患者,以及24例无肺炎影像学表现的非住院流感患者。同时也评估了发生危重症与非危重症的住院患者亚组。gydF4y2Ba一个gydF4y2Ba,各患者组血清CRP水平。gydF4y2Ba抵扣gydF4y2Ba每升外周血白细胞(WBC) (b)、中性粒细胞(c)、淋巴细胞(d)和血小板(e)计数。gydF4y2BafgydF4y2Ba,外周血中性粒细胞与淋巴细胞(N/L)比值。gydF4y2BaggydF4y2Ba,各组患者体温测量单位为°C。gydF4y2BahgydF4y2Ba, CURB-65评分表示入院或就诊时各患者组的肺炎严重程度。数据以散点图表示,其中点表示个别患者的测量值,线表示中值。对于COVID-19, n = 32例住院患者,其中16例为非危重型,16例为危重型。流感住院患者16例,其中非危重型13例,危重型3例,轻症非住院型24例。gydF4y2BaPgydF4y2Ba值由非参数比较的双尾Mann-Whitney U检验确定。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01和***gydF4y2BaPgydF4y2Ba< 0.001显著高于健康对照组。gydF4y2Ba
图5住院COVID-19和流感患者随时间变化的危重疾病发生率。gydF4y2Ba
对因肺炎住院的32例COVID-19和16例流感患者进行纵向随访,记录危重症发展情况。总共有50%(16/32)的COVID-19患者和19%(3/16)的流感患者病情危重。gydF4y2Ba
图6发生危重症与非危重症的COVID-19和流感患者亚组间的时间细胞因子模式比较。gydF4y2Ba
危重或非危重型住院患者、轻度非住院患者入院或访视后IFN-λ1、IFN-α、IFN-γ、TNF、IL-6、IL-7、IL-8、IL-10、CCL3的时间表达及健康人的比较彩色线表示每个子组随时间变化的中值。点表示单个患者的测量值,阴影点图对应危重患者的值。对于COVID-19, n = 16、17、21、15、11和8,每个连续6个时间间隔。对于住院流感,n = 16、14和11,对于轻度非住院流感,n = 24、15和14,分别对应三个连续时间间隔。健康情况下,n = 10。灰色阴影标志着该试验的量化极限。gydF4y2BaPgydF4y2Ba值由非参数比较的双尾Mann-Whitney U检验确定。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01和***gydF4y2BaPgydF4y2Ba< 0.001在特定时间间隔和患者群体中,危重症和非危重症患者之间有显著性差异。对COVID-19患者1-3天时间间隔的IFNλ1, p = 0.0017;在COVID-19患者4-6天间隔的TNFgydF4y2BapgydF4y2Ba= 0.0046;在COVID-19患者第1-3天、第4-6天和第7-10天间隔的IL-6gydF4y2BapgydF4y2Ba= 0.0418, 0.0431, 0.000022。在COVID-19患者第7-10天和第11-14天时间间隔检测IL-7gydF4y2BapgydF4y2Ba= 0.0299和0.0044。在流感患者的第1-3天间隔的IL-8gydF4y2BapgydF4y2Ba= 0.0484。gydF4y2Ba
图7单个COVID-19患者的时间细胞因子模式。gydF4y2Ba
32例新冠肺炎患者入院后血清中IFN-λ1、IFN-α、IFN-γ、TNF、IL-6、IL-7、IL-8、IL-10和CCL3浓度的表达规律不同的颜色符号和线条代表患者随时间变化的价值。图示出现危重症与非危重症的患者。gydF4y2Ba
图8 COVID-19患者血液转录特征按病情严重程度聚类。gydF4y2Ba
基于患者与健康患者之间的log2倍变化至少为3,调整p值小于0.001的基因,健康患者、危重患者和非危重患者在住院后第1天的方差稳定转换值的热图和层次聚类。采用hclust R函数提供的无加权对组方法和算术平均(UPGMA)方法进行分层聚类,使用ggdendro R包进行树状图。gydF4y2Ba
图9 COVID-19重症患者与非重症患者病毒载量比较。gydF4y2Ba
最终发展为危重症与非危重症的COVID-19患者入院1-3天时间间隔的病毒载量数据以散点图的形式表示,其中点表示个别患者的测量值、列的中值和误差柱的范围。非危重患者N = 8,危重患者N = 9。通过非参数比较的双尾Mann-Whitney U检验确定两组间的统计学显著性。附言:不重要。gydF4y2Ba
补充信息gydF4y2Ba
权利与权限gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Galani, IE。,Rovina, N., Lampropoulou, V.et al。gydF4y2Ba通过时间型I/III型干扰素模式和流感比较发现COVID-19的抗病毒免疫未调整。gydF4y2BaNat ImmunolgydF4y2Ba22,gydF4y2Ba32-40(2021)。https://doi.org/10.1038/s41590-020-00840-xgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41590-020-00840-xgydF4y2Ba
进一步的阅读gydF4y2Ba
COVID-19免疫干预:时间问题?gydF4y2Ba
粘膜免疫gydF4y2Ba(2021)gydF4y2Ba
AHR信号是由冠状病毒感染诱导的gydF4y2Ba
自然通讯gydF4y2Ba(2021)gydF4y2Ba
急性SARS-CoV-2感染期间有明显的全身和黏膜免疫反应gydF4y2Ba
自然免疫学gydF4y2Ba(2021)gydF4y2Ba
I型和III型干扰素在SARS-CoV-2感染中的反应gydF4y2Ba
实验与分子医学gydF4y2Ba(2021)gydF4y2Ba
重症COVID-19患者血液抗原提呈细胞单细胞RNA测序揭示抗病毒免疫多过程缺陷gydF4y2Ba
细胞生物学gydF4y2Ba(2021)gydF4y2Ba