要点
呼吸道是病毒进入人体的主要门户。呼吸道感染,如果严重,引起危及生命的肺部损伤。各种策略来控制病毒复制和限制免疫介导的炎症和组织损伤呼吸道的进化。
多个先天免疫细胞类型,尤其是树突细胞(dc),在肺间质和气道上皮细胞之间的战略准备识别和样例气道微粒,如病毒。
为了应对呼吸道病毒感染,几个不同的直流子集是刺激从肺部感染的网站迁移到淋巴结。在这里,这些移民DCs有至关重要的作用在启动杀毒入侵病毒的适应性免疫反应。
后进入肺部感染,效应T细胞生成的淋巴结进行进一步的修改所形成的炎性环境。
Co-stimulatory receptor-ligand效应T细胞之间的相互作用和各种细胞类型呈现病毒抗原在受感染的肺调节宿主适应性免疫反应原位。
效应T细胞产生促炎介质也监管(消炎)细胞因子的主要生产商,提供一个微调的自控机制效应T细胞对病毒的发炎组织。
免疫机制,控制病毒复制和/或过度病毒感染肺部炎症也可以使个人恢复从病毒感染细菌重复感染。治疗策略应考虑平衡需要抑制病毒复制和过度炎症需要优化抗菌功能的先天免疫吞噬细胞,它们从肺部清除细菌的关键。
文摘
近年来几个我们理解的进步免疫力下呼吸道病毒感染,包括流感病毒感染。在这里,我们审查的细胞目标病毒和宿主免疫应答的特征,是独一无二的肺部。我们描述先天和适应性免疫细胞之间的相互作用在感应,表达式和控制抗病毒免疫,并讨论感染肺部的影响环境造型抗病毒效应T细胞的反应。最新发现的频率增加背后机制严重肺部细菌感染后呼吸道病毒感染进行了讨论。
主要
病毒是高度进化的和无处不在的病原体。虽然许多病毒感染导致轻微,自限性疾病,其他病毒可以产生严重和频繁的致命感染。呼吸道病毒是一个主要的门户网站,通过它进入启动感染。而一些病毒可以引发呼吸道感染,然后传播到其他网站在体内,其他病毒通常保持呼吸道局部,复制和诱导组织损伤(见S1补充的信息(表))。各种防御机制已经在预防和控制感染的呼吸道病毒和其他病原体。
呼吸道结构上可以分为上呼吸道(包括鼻、口腔和咽)和下呼吸道(包括气管、支气管和肺),瓦尔代尔环的淋巴组织(包括咽、腭扁桃体)代表的界定。因下呼吸道的至关重要的作用在呼吸,我们限制本文的焦点最近的进展我们了解病毒感染的宿主免疫反应在这个网站。
基质细胞(通常CD45−(CD45 non-haematopoietic细胞)和造血的细胞+骨骨髓来源的细胞)组成的蜂窝网络下呼吸道。尽管所有细胞类型可能有重要的作用在呼吸道病毒感染,I型和II型肺泡上皮细胞并进行气道上皮细胞CD45中特别重要−基质细胞,这些细胞的感染病毒和随后的宿主免疫反应可损害呼吸功能,并可能导致急性呼吸窘迫综合征(ARDS)。I型和II型肺泡上皮细胞是重要的细胞感染目标严重急性呼吸道综合征(SARS)冠状病毒1,2和某些类型的流感病毒株,特别是高致病性禽流感H5N1病毒3,4,5。病毒也可以目标的上皮细胞进行航空公司(补充信息S1(表))。
严重的肺部炎症与呼吸道感染有关的某些病毒对免疫系统构成了独特的挑战:不仅要病毒被免疫系统迅速消除,但组织炎症也必须控制以防止急性呼吸衰竭。此外,在恢复或决议阶段感染,免疫系统必须帮助协调恢复正常的肺组织修复体系结构和功能,防止呼吸功能的永久性缺陷。
物理和化学的贡献感染和壁垒的各种先天免疫机制和调节宿主的细胞对病毒感染的反应最近研究进展6,7,8,9这里不详细讨论(尽管它们了S2的补充信息(盒子))。同样,对呼吸道病毒的免疫中B细胞的功能已经回顾了其他地方10。这里,我们主要关注最近的结果对于诱导T细胞对病毒感染的反应在特定的呼吸道和作用呼吸树突状细胞(DC)的子集和巨噬细胞在控制这一过程。此外,我们描述最近发现豁免权的规定,在病毒感染肺部炎症和损伤。最后,我们简要地考虑潜在的呼吸道病毒感染和慢性呼吸道疾病之间的联系,详细讨论最近的调查结果与呼吸道病毒感染的影响易并发或随后的细菌感染(称为细菌重复感染)。
呼吸APC激活和移民
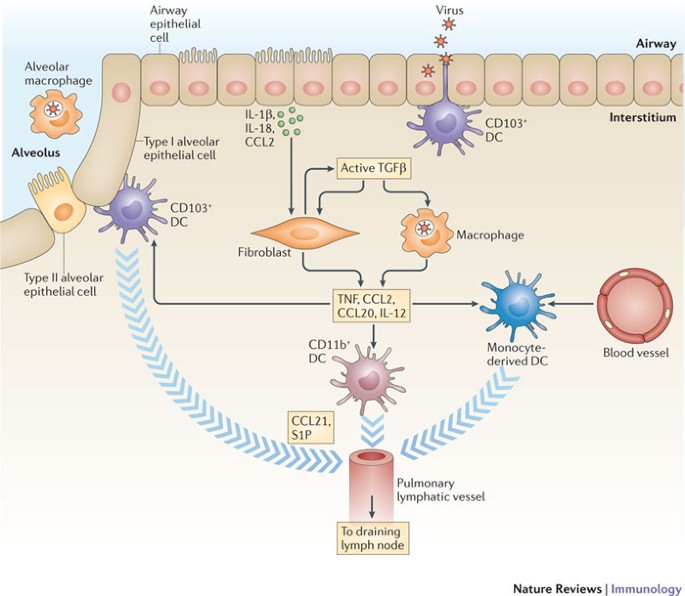
吸入肺部轰炸了大量无害的抗原和大概共生的微生物。一个独特的挑战lung-resident抗原递呈细胞(apc)是区分入侵的病原体和无害的粒子和只提供有关微生物抗原T细胞。这种歧视在肺部的机制知之甚少但最终导致呼吸系统DCs的激活及其迁移到淋巴结。
肺泡巨噬细胞。如果细胞内的先天免疫机制的主要靶细胞(如上皮细胞)未能充分控制病毒复制,复制,然后释放病毒粒子,枯死的感染细胞的内容可以被各种各样的装甲运兵车9(表1)。第一个呼吸道CD45+遇到病毒抗原免疫细胞是肺泡巨噬细胞。不仅是肺泡巨噬细胞的吞噬细胞,能够迅速从肺部消除大量的微生物,但他们也有至关重要的作用,它能抑制免疫反应在这个网站11。人们普遍认为肺泡巨噬细胞non-migratory,不会导致诱导适应性免疫反应。然而,最近的证据表明,肺泡巨噬细胞可以迁移从肺淋巴结在稳态条件下,细菌感染后可以作为抗原携带者12,尽管他们的贡献适应性免疫反应的诱导引流淋巴结目前定义。
树突细胞。DCs驻留在气道上皮细胞在肺间质,气道上皮细胞之间和他们可以扩展过程,使其战略准备样例气道微粒,如病毒。一些表型和功能上不同的子集啮齿动物的呼吸系统DCs已被广泛的研究13。这些人群包括两个主要居民成熟(MHC II级嗨CD11c嗨)呼吸系统直流子集,它作为CD103特征+和CD11b嗨CD103−呼吸系统DCs和诱导适应性免疫反应是至关重要的,至少在老鼠14,15,16,17。CD103+呼吸系统DCs在粘膜表面定位,毗邻呼吸道上皮细胞和周围邻近的血管。相比之下,丰富CD11b越多嗨呼吸发现肺间质内的直流子集。CD103+呼吸系统DCs表达mannose-binding c型凝集素langerin(也称为CLEC4K)16,18,需要特定的转录因子的表达(如BATF3)为他们的正常发展在肺癌和其它粘膜表面19,20.,21。激活CD103+呼吸系统DCs生产适度水平的促炎症介质,而CD11b嗨呼吸系统DCs是主要趋化因子生产商针对肺部炎症22。
Monocyte-derived DCs,表型不成熟(MHC II级低CD11c低),更丰富的间质内的成熟的直流子集和本地化。他们可以把颗粒在肺癌和迁移到淋巴结发炎。然而,他们是可怜的幼稚T细胞活化剂,分析在实验病毒感染14。然而,他们可能作为成熟的DCs的前兆23(图1)。从这些传统呼吸DCs是截然不同的血浆DCs(髓样)。髓是公认的主要生产商的I型干扰素(ifn)在感染期间,也可以运输抗原从受感染的肺淋巴结。然而,低级的表达co-stimulatory配体pDCs呈现弱活化剂的幼稚T细胞。
病毒感染呼吸道上皮细胞首先是胞质和/或endosomal天生的传感器探测到的感染上皮细胞(没有显示)。由这些先天免疫识别入侵病毒的受体导致促炎细胞因子的生产如interleukin-1β(IL-1β)和地震,和CC-chemokine等趋化因子配体2 (CCL2)。这些可溶性介质释放的感染细胞激活邻CD45−实质细胞,成纤维细胞和上皮细胞等,和邻近的先天免疫细胞。激活后,这些细胞将潜在转变增长factor-β(TGFβ)一个活跃的形式,导致增加分泌的趋化因子CCL2, CCL20的实质基质细胞和细胞因子白介素、肿瘤坏死因子(TNF)等炎症细胞。增强生产成熟的趋化因子和细胞因子促进tissue-resident CD103+和CD11b+树突状细胞(dc)和monocyte-derived DCs的招聘和成熟。抗原不成熟的收购和激活antigen-bearing呼吸DCs导致动员和迁徙的肺部感染在趋化因子梯度CCL21和sphingosine-1-phosphate (S1P)淋巴结受感染的肺。一旦在淋巴结,这些DCs参与启动适应性免疫反应的呼吸道病毒(没有显示)。
巨噬细胞。除了肺泡巨噬细胞,CD11b+(CD11c−)tissue-resident巨噬细胞——来自循环CC-chemokine受体2 (CCR2)+血液中单核细胞的子集——non-inflamed肺间质内被发现9,24,25。这些细胞有能力运输抗原从肺淋巴结在病毒感染14,尽管他们的贡献的诱导适应性免疫反应尚不清楚。这些巨噬细胞的数量可以在应对病毒感染显著增加,而且他们可能作为装甲运兵车的激活效应T细胞感染肺部24,25(见下文)。最近的证据表明,巨噬细胞在感染的增加可能导致来自血液单核细胞前体的涌入和当地的细胞增殖26。
呼吸系统DCs迁移。呼吸道病毒感染(和其他炎性刺激)和激活触发器抗原摄取的大多数类型的呼吸,导致他们的动员和迁移的肺部感染9,27。虽然这个过程是不完全了解,多个介质-包括CC-chemokine等趋化因子配体2 (CCL2) CCL5, CCL20及CCL21——可能协同工作来编排呼吸DC活化和动员。这些趋化因子是由呼吸道上皮细胞和血管和淋巴内皮细胞,然后进行相应的受体呼吸道DCs28,29日。额外的促炎症介质(如interleukin-1β(IL-1β)和地震)所发布的感染上皮细胞可以激活邻CD45−实质细胞,成纤维细胞等28。这可能会增加αVβ8的表达整合素fibroblastsand后续integrin-dependent激活转变增长factor-β(TGFβ),导致增加TGFβ-dependent趋化因子的分泌CCL2, CCL20 (Ref。28)。同样,toll样受体4 (TLR4)信号在应对病毒蛋白上皮细胞移植CCL2, CCL20的表情29日,这可能促进DCs的激活和动员在肺内,以及招聘的单核细胞从循环祖细胞进入肺(图1)。
的侵染诱导CD45之间的串扰−肺实质细胞和成熟的居民DCs在肺部发炎导致upregulation DCs的趋化因子受体,尤其是CCR7和sphingosine-1-phosphate受体。为transendothelial迁移激活这些受体是至关重要的呼吸DCs和引流淋巴结的出口14,15,30.,31日。不像CD103+和CD11b嗨呼吸道DCs、其他潜在的装甲运兵车,如肺泡巨噬细胞,pDCs monocyte-derived DCs -使用独立的未知的途径CCR7进入淋巴结。激活呼吸DCs还上调co-stimulatory和粘附分子的表达(如CD40、CD80、CD86和ICAM1)和受体分子,这使得迁移呼吸DCs主管作为强大的装甲运兵车天真病毒特异性T细胞的激活引流淋巴结。
T细胞的活化和分化
迁移呼吸DCs轴承病毒抗原的淋巴结是集中在地方极其罕见的病毒抗原特异性适应性免疫细胞,如天真32,33和内存抗病毒T细胞34,35,可能会遇到他们的同源抗原。虽然从移民呼吸道病毒抗原DCs的转移(巨噬细胞)淋巴node-resident CD8α+DCs已经被记载在一份呼吸道病毒感染36,一些证据表明antigen-bearing迁徙DCs天真CD4,最高效的病毒抗原+和CD8+在呼吸道病毒感染T细胞14,17,37,38,39,40,41(表1)。然而,迁徙的相对贡献呼吸DCs和淋巴node-resident CD8α+DCs幼稚T细胞的激活在呼吸道病毒感染仍有待探讨和病原体可能是相关的。
移民CD103+呼吸系统DCs达到最大数量的引流淋巴结早期(2 - 4天)以下呼吸道病毒感染和作为天真的病毒特异性CD8最强大的装甲运兵车+T细胞在反应初期积极感染14,41。此外,CD103+呼吸系统DCs可以有效地cross-present感染细胞的抗原(如产品),最初在肺部,可能通过efferocytosis42。当前可用的有限的数据不允许CD103最终确定是否感染+呼吸系统DCs为天真CD8更强大的装甲运兵车+T细胞比CD103+呼吸系统DCs cross-present收购病毒抗原14,41。最近,CD103的优越性+呼吸系统DCs在CD11b嗨呼吸系统DCs抗病毒CD8在支持+T细胞活化在流感病毒感染与他们的能力增强的过程和加载病毒抗原在MHC分子类我CD8表示+T细胞43。
CD11b嗨呼吸系统DCs的引流淋巴结数量达到峰值后时间点(5 - 7天)后流感病毒感染14,41并可能扩大之前激活效应CD8的池的大小+淋巴结T细胞通过接触co-stimulatory受体CD27 (Ref。40)。迁徙直流积累的速度和大小的淋巴结可能受virus-intrinsic因素,如复制潜力,靶细胞类型和细胞毒性的影响,以及host-intrinsic因素,如潜在的遗传易感性。
两大迁徙呼吸直流子集也有效地激活天真病毒特异性CD4细胞+T细胞14。此外,大量涌入的炎症状突进入淋巴结激活循环有重要作用的有力辅助T 1 (TH1)呼吸道病毒感染的细胞反应44。解决急性感染后,CD103+和CD11b+呼吸DCs继续渡轮和现在的残留记忆T细胞抗原34,35,因此他们影响抗病毒的走私和召回响应记忆T细胞45,46,47。
T细胞介导的抗病毒反应
后遇到的装甲运兵车引流淋巴结,天真的(内存)病毒特异性T细胞进行逐步激活的过程,成为效应T细胞增殖和分化,迁移到感染和调解的抗病毒免疫反应。
效应机制。抗病毒T细胞所使用的效应机制可以分为三组。首先,有T细胞相关裂解机制,促进感染细胞的胞外分泌的溶解穿孔素和granzyme-containing颗粒。第二,T细胞可以诱导肿瘤坏死因子受体(TNFR) family-dependent感染细胞的细胞凋亡表达CD95配体(也称为FAS配体)或TNF-related凋亡诱导配体(TRAIL)。第三,T细胞可以产生促炎介质(和监管介质(见下文))遭遇病毒感染细胞的反应。我们当前的知识这些过程和他们的角色在病毒清除来自研究宿主适应性免疫T细胞反应有限数量的呼吸道病毒感染,尤其是流感病毒。
一些研究显示CD8的溶细胞的功能的至关重要的作用+效应T细胞在感染流感病毒。这些函数触发的直接裂解感染病毒的细胞,需要处理病毒抗原的T细胞受体介导识别受感染的靶细胞48,49,50。与某些值得注意的例外51,52,53,特定的释放促炎介质由CD8(比如IFNγ)+T细胞只有一个温和的对病毒清理和恢复的影响。
还有最近的证据从流感病毒模型,呼吸道感染病毒的细胞(特别是感染肺泡上皮细胞)可能被消除在宿主反应通过激活巨噬细胞裂解的作用,能够通过TRAIL-dependent触发病毒感染细胞的凋亡机制54。因此,炎症激活单核细胞(而不是效应CD8+T细胞)表达TRAIL和招募到病毒感染肺部肺泡上皮细胞接触,而上调TRAIL受体在应对感染早期,并触发肺泡上皮细胞凋亡。这种机制的贡献控制病毒复制和肺泡损伤呼吸道感染的发展有待进一步评估。
效应CD4+具有活性细胞毒性T细胞已被证明在体外,但CD4的贡献+T细胞的细胞毒性病毒清除在活的有机体内在肺部是适度的55,56。这个细胞毒性是限制病毒antigen-bearing细胞表达MHC II级分子;这样的细胞包括CD45+炎症单核吞噬细胞和一些CD45−肺实质细胞类型,结构上(或诱导)表达MHC II级分子(如II型肺泡上皮细胞)57(表1)。结果实验感染的研究表明,抗病毒CD4的主要作用+T细胞是支持B细胞的活化和分化,导致抗体生产58,59。
调制效应T细胞反应原位。抗病毒效应T细胞生成的古典观点认为激活天真的增殖分化所必需的扩张抗病毒T细胞为效应T细胞发生为主,如果不是全部,在排水淋巴结。早些时候第一个暗示这个观点可能是不完整的呼吸道病毒感染来自研究表明活化效应T细胞可以接受在呼吸道的广泛扩散60,61年。最近的研究表明要求效应T细胞在感染肺与CD45进行交互+炎症单核吞噬细胞,产生细胞因子(如IL-15,他们反式现在)和/或表达co-stimulatory分子(如CD70)支持扩散并维持效应T细胞的可行性62年,63年,64年。
此外,最近的一项研究表明,病毒特异性CD8+效应T细胞可以产生监管细胞因子il - 10在抗原刺激但后才迁移到病毒感染肺部65年。值得注意的是一阵T细胞衍生il - 10生产当时所发生的初始流入效应T细胞进入肺部。这种破裂伴随生产高峰CD8 IFNγ等炎性介质+效应T细胞和病毒的发作间隙65年。IL-10-producing效应CD8+T细胞已被证明产生IFNγ促炎细胞因子,同时和生产这两种CD8细胞因子+T细胞间隙随病毒65年。还有待确定是否这种转变从一个效应T细胞能产生促炎细胞因子的引流淋巴结的效应T细胞可以产生促炎症细胞因子和监管进入肺部感染病毒后代表激活状态的变化或激活T细胞的分化状态。然而,考试通过CD8 il - 10的生产+效应T细胞在活的有机体内在感染的肺部66年透露,这一监管细胞因子的生产需要接触受感染的T细胞的肺源自抗病毒CD4 - 2+效应T细胞和IL-27炎症产生的单核细胞和中性粒细胞。这些和其他的观察67年支持的观点CD8的接触+效应T细胞对促炎(IL-27)和生存(2)刺激肺部感染增强T细胞的激活,从而促进Il10基因的表达。
一个早期在体外分析T细胞效应的规定活动的建议有一个表现的层次结构在T细胞效应的活动依赖于激活的强度刺激68年。根据这一分析,CD8+T细胞的细胞毒性co-stimulatory活动至少有严格的要求和细胞因子信号,其次是T细胞增殖、促炎细胞因子生产要求co-stimulatory最强的信号。最近,出现了从一个证据在活的有机体内呼吸道病毒感染的T细胞反应的分析来支持这个概念49。在这项研究中,效应CD8+T细胞激活的流感virus-derived抗原CD45提出的感染−呼吸道上皮细胞导致T细胞杀死感染上皮细胞没有促炎细胞因子的释放。相比之下,效应CD8+T细胞激活的病毒抗原被间隙CD45呈现+炎症细胞(主要是LY6C嗨CD11c+炎症性单核吞噬细胞)诱导细胞介导细胞毒性效应CD8和促炎细胞因子的生产+T细胞。机制(或机制),这种差异在T细胞反应占APC或目标细胞识别还有待充分阐明。
然而,一个重要的区别CD45的识别+装甲运兵车和CD45的−靶细胞的效应T细胞由装甲运兵车co-stimulatory配体的表达而不是通过靶细胞49,69年。的确,co-stimulatory分子CD80和CD86的封锁在体外或在活的有机体内抑制促炎细胞因子的生产效应CD8+T细胞而不影响其细胞毒性的活动在体外或病毒清除在活的有机体内49。因此,co-stimulatory效应CD8受体的参与+T细胞通过装甲运兵车将提供所需的额外的信号强度由T细胞促炎细胞因子的生产。一些报告评估具体的贡献co-stimulatory receptor-ligand交互调节宿主适应性免疫反应和呼吸道病毒感染的结果70年,71年,72年,73年。然而,在大多数情况下没有具体的贡献之间的区别是由这些co-stimulatory receptor-ligand交互感应阶段反应的引流淋巴结和肺部感染效应阶段。
上述结果可能为治疗干预具有重要意义在呼吸道感染病毒感染(如流感病毒)的生产(即生产的传染性病毒粒子)是CD45限制−呼吸道上皮细胞。更普遍的是,这些观察结果添加到新兴的照片,之后进入肺部感染,效应T细胞由炎性改变或塑造环境原位。这样的改变可能包括激活状态的变化(如增加T细胞受体的热望目标peptide-MHC复杂apc),效应器活动(如介质产生的类型和/或数量)和可行性,甚至某些效应T细胞的分化成记忆T细胞49,63年,69年,71年,74年。
急性肺部炎症的控制
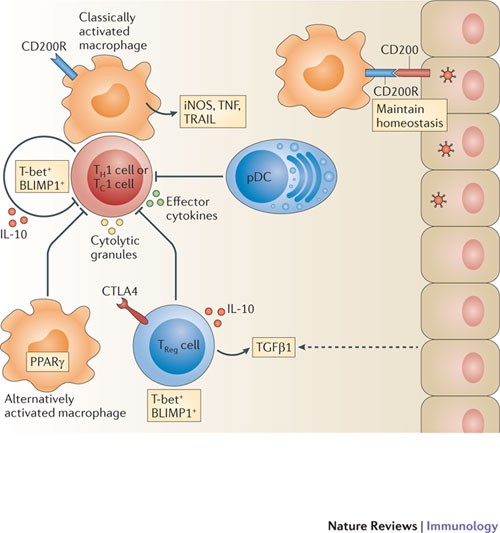
多种细胞类型表达免疫抑制分子75年维持肺内稳态。这种抑制状态是受先天和适应性免疫细胞的作用应对感染。他们的反应促进病毒的间隙还可以产生过度的肺部炎症和组织损伤(审查裁判。76年)(图2)。
分子来源于先天和适应性免疫细胞导致过度的规定在急性呼吸道病毒感染肺部炎症。CD4+辅助T 1 (TH1)、1型CD8细胞+细胞毒性T细胞(TC1细胞)表达和转录因子T-bet BLIMP1 (B lymphocyte-induced成熟蛋白1)和生产高水平的监管细胞因子白细胞介素- 10”(il - 10),除了效应细胞因子和细胞溶解的分子,在呼吸道病毒感染。调节性T (T注册)在肺部细胞也表达了“效应”转录因子T-bet BLIMP1,产生各种免疫调节细胞因子(包括il - 10和转变增长factor-β1 (TGFβ1))和表达抑制性受体细胞毒性t淋巴球抗原4 (CTLA4)。肺上皮细胞表达CD200和需要控制的经典激活巨噬细胞的活化。相比之下,或者激活巨噬细胞导致过度的控制肺部炎症。血浆树突细胞(髓)也有助于抑制过度T细胞介导的炎症通过一位身份不明的机制。伊诺,诱导一氧化氮合酶;PPARγ、过氧物酶体proliferator-activated receptor-γ;肿瘤坏死因子,肿瘤坏死因子;小道,TNF-related凋亡诱导配体。
Forkhead盒P3(具体)+调节性T (T注册)细胞有一个重要的角色在维护抑制炎症免疫内稳态的天真的主机。然而,它最近表明,激活T注册细胞可以获得独特的表型,提高自己的控制能力,夸张的炎症77年,78年。呼吸道病毒感染后,T注册细胞在肺部有表达“效应”T注册细胞标记。例如,T的表达H1细胞相关转录因子T-bet是T调节肺注册在流感病毒感染细胞65年和与增强T注册T细胞介导的抑制过度H一种炎症反应79年。同样,BLIMP1 (B lymphocyte-induced成熟蛋白1;也称为PRDM1)所需的终端效应T细胞的分化,对于增强生产的il - 10 T注册在流感病毒感染细胞65年,67年。T的损耗注册细胞会导致过度期间肺部炎症和损伤呼吸道合胞体病毒(RSV)感染80年,81年,82年。此外,T的过继转移注册老鼠细胞recombination-activating基因(布)不足(缺少B和T细胞)控制否则致命的流感病毒期间由先天免疫细胞介导的炎症感染83年。这些数据表明,T注册细胞可能是至关重要的主机控制急性炎症和肺恢复体内平衡呼吸道病毒感染后,尽管这些函数的机制知之甚少。
除了效应T注册传统效应CD4细胞,+和CD8+T细胞最近被证明能够发挥“管理”功能通过生产高水平的il - 10在流感病毒,RSV 5或猴病毒感染65年,84年,85年。阻断T细胞衍生il - 10导致肺部炎症表现为过度增加CD45的积累+炎症细胞和增强生产促炎症介质在流感病毒或RSV感染65年,85年,86年。如前所述,il - 10的生产效应T细胞主要是局限于感染的网站而不是T细胞启动的网站,表明当地环境的感染肺可以指示效应T细胞的功能65年,84年。
各种先天免疫细胞类型也可能采取行动抑制过度炎症引起的抗病毒免疫反应(表1)。髓有至关重要的作用在限制过度的T细胞介导炎症实验RSV感染通过一个未知的机制87年。此外,中性粒细胞可以促进病毒清除和抑制炎症88年,肺上皮细胞可以抑制巨噬细胞的炎症活动掩饰兴奋的表达抑制分子CD200在流感病毒感染11。此外,经典激活吞噬细胞(如炎症DCs和巨噬细胞)可以显著贡献者在流感病毒感染疾病发病机理24,25,54,而或者激活巨噬细胞在RSV感染监管功能,抑制炎症由占据先天免疫细胞89年。值得注意的是,核受体的激活过氧物酶体proliferator-activated receptor-γ(PPARγ)——一个转录因子,控制单核细胞分化的体细胞或者激活巨噬细胞90年在流感病毒感染,抑制致命的炎症25。因此,对免疫细胞的分化状态可能有至关重要的作用在解决炎症和病毒感染的结果(表1)。
免疫抑制细胞因子表达的既定TGFβ1许多肺细胞类型,最值得注意的是上皮细胞,表达所需的整合蛋白潜在TGFβ1转化为活性形式,因此可以维持正常的肺免疫内稳态75年。管理TGFβ1期间小鼠流感病毒或RSV感染病毒清除,但抑制相关的肺部炎症91年在流感病毒感染,而抑制TGFβ1导致致命的组织损伤92年。有趣的是,而从某些流感病毒神经氨酸酶蛋白的菌株可以处理潜在TGFβ1到其活性形式,从而有可能抑制肺部炎症感染期间,从高致病性H5N1流感病毒神经氨酸酶无法处理TGFβ1 (Ref。92年)。因此能(或不能)病毒的激活或抑制宿主免疫调节机制(比如TGFβ1激活)可能导致病毒的发病机理。所以,似乎有多个层免疫调节在急性呼吸道病毒感染的细胞水平(如T注册细胞和其他细胞和分子水平上(如il - 10, CD200和TGFβ1)(图2)。
细菌重复感染后病毒清除
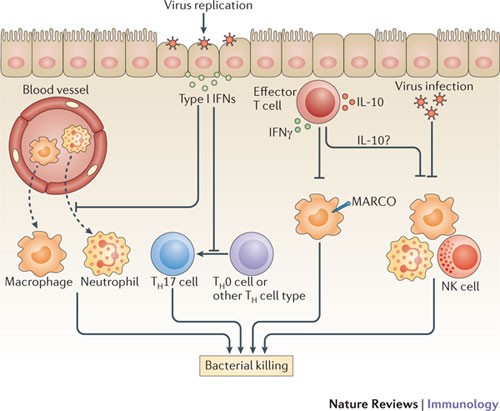
流行病学证据清楚地表明,呼吸道病毒感染,尤其是A型流感病毒感染、继发性细菌感染的发病率和严重程度增加呼吸道93年。组织学分析受感染的肺组织表明,细菌重复感染导致继发性细菌性肺炎死亡的主要原因是在1918年的A型流感病毒大流行和最近的H1N1大流行性流感94年,95年。细菌重复感染的小鼠模型,a型流感病毒感染小鼠的易感性增加各种细菌感染,包括呼吸系统的挑战链球菌引起的肺炎,金黄色葡萄球菌或流感嗜血杆菌和系统性单核细胞增多性李斯特氏菌感染96年,97年。增加对细菌重复感染通常早在第三天开始,一直持续到至少2周后A型流感病毒的感染。流行的观点来解释这种对重复感染的易感性,多年来,是A型流感病毒感染破坏上皮细胞和上皮的屏障功能降低,从而促进呼吸道的细菌殖民化93年。过去十年然而,证据表明A型流感病毒感染也改变了先天和适应性免疫细胞的功能,导致未能有效控制细菌复制(图3)。
多个不同的机制被假定为增加易受感染后细菌重复感染和细菌性肺炎等呼吸道病毒A型流感病毒。流感病毒感染诱发生产的I型干扰素(ifn),抑制中性粒细胞和巨噬细胞传播的招聘,肺后细菌的挑战。I型干扰素的分化抑制抗菌辅助T 17 (TH17)从幼稚T细胞(T细胞H0 T细胞)或其他H细胞类型(如TH1和TH2细胞)110年从而加强主机对继发性细菌感染的易感性。IFNγ生产流感病毒特异性效应T细胞减少巨噬细胞受体的表达与胶原结构(MARCO)肺泡巨噬细胞,抑制细菌,这些细胞的摄取。此外,白细胞介素- 10”(il - 10)生产的流感病毒特异性效应T细胞可以抑制能力的先天免疫细胞,特别是巨噬细胞,杀死细菌。最后,直接交互和/或感染的先天免疫细胞,如巨噬细胞、中性粒细胞和自然杀伤(NK)细胞-流感病毒抑制这些细胞的能力和杀死细菌。
各种免疫细胞类型中,lung-resident肺泡巨噬细胞对细菌的第一道防线呼吸道,因为他们有能力限制细菌产物和策划招聘和其他免疫细胞的激活限制细菌生长。A型流感病毒感染可以减少肺泡巨噬细胞的数量也通过促进细胞凋亡和抑制这些细胞通过直接的作用机制(如感染巨噬细胞)和间接机制(通过宿主因素引起的感染)98年,99年。肺泡巨噬细胞从肺感染A型流感病毒显示CD200受体表达增加(CD200R)结扎的抑制肺泡巨噬细胞活化,以应对继发性细菌挑战One hundred.。此外,从病毒感染肺部肺泡巨噬细胞表现出减少的清道夫受体表达马可(巨噬细胞与胶原受体结构)和细菌摄取能力减弱99年。他们还生产只有低水平的细胞因子和趋化因子所需的策划针对细菌感染其他细胞类型的响应,如中性粒细胞招募和激活98年。从病毒感染肺部肺泡巨噬细胞的趋化因子减少生产与降低核易位factor-κB肺泡巨噬细胞的细胞核(NF-κB)由于未知的机制98年。肺泡巨噬细胞的脱敏治疗可以持续几个月后流感病毒感染。因此,鉴于肺泡巨噬细胞的重要作用在初始控制细菌感染,这些数据表明,个人从严重的流感病毒感染对继发细菌感染可能会损害免疫扩展的时期。
除了抑制肺泡巨噬细胞,抑制流感病毒感染的招聘期间循环单核细胞和巨噬细胞对细菌的反应通过I型IFN-dependent机制的挑战101年。中性粒细胞在清理肺部细菌感染有至关重要的作用,但这些从流感病毒感染肺部表现出不良反应分离细菌的挑战102年。事实上,流感病毒感染(或结合)中性粒细胞在体外导致的直接抑制中性粒细胞趋化性和超氧化物生产103年。在活的有机体内,流感病毒可以直接感染中性粒细胞在肺和,因此,可以直接抑制中性粒细胞的功能在继发性细菌挑战104年。此外,I型干扰素诱导生产过程中主要的流感病毒感染可以直接抑制中性粒细胞浸润到肺和/或增加中性粒细胞凋亡105年。
自然杀伤(NK)细胞,通过释放抗菌因子,也可以作为重要的效应细胞在某些细菌感染106年。然而,NK细胞分离流感病毒感染肺部显示减少生产抗菌效应细胞因子TNF106年,尽管这个机制在NK细胞功能缺陷流感病毒感染仍然是难以捉摸的。NK细胞据报道容易感染流感病毒,感染和NK细胞有各种缺陷效应细胞毒性和细胞因子和趋化因子等生产活动107年。
流感病毒感染诱发高度极化TH一种免疫反应的特点是IFNγ的生产。值得注意的是,中和IFNγ在流感病毒感染恢复马可由巨噬细胞表达,增加细菌摄入和杀死巨噬细胞,增强宿主抵抗继发性细菌感染99年。高度极化CD4+TH1和1型CD8细胞+细胞毒性T细胞也是一个主要来源的抗炎细胞因子il - 10在流感病毒感染65年,108年。il - 10已经涉及对流感病毒感染后继发细菌感染。在一项研究中,il - 10的封锁增强二次感染的间隙肺炎链球菌109年。然而,il - 10在继发性细菌感染的作用仍然是有争议的,作为两个最近的报告使用IL-10-deficient老鼠发现了一个最小的角色il - 10在调节宿主对继发性细菌挑战99年,105年。TH17细胞反应也与某些细菌宿主抵抗的关键挑战,包括肺炎链球菌和金黄色葡萄球菌110年,流感病毒诱导的I型干扰素的生产已表现出抑制T的后续发展H17细胞应对细菌重复感染110年。
总之,新出现的证据表明,一个或多个监管机制(例如,CD200R的表达il - 10和/或TGFβ1)使用的先天和适应性免疫细胞中抑制过度炎症急性呼吸道病毒感染可能会促进细菌殖民化的招聘和函数递减吞噬细胞和随后的销毁细菌病原体(图3)。如果免疫机制旨在控制病毒复制和/或过度病毒感染肺部炎症使个人容易细菌重复感染,那么治疗策略来防止细菌重复感染肺部必须平衡需要防止病毒复制和病毒间隙中过度的炎症反应需要优化先天免疫吞噬细胞的抗菌功能。
下呼吸道病毒感染,如果严重,也改变肺功能在较长时间内病毒清除后,可能使至少加剧、慢性肺部炎症性疾病,如哮喘和慢性阻塞性肺疾病(箱1)。
结论
最新进展的识别和表征不同子集的DCs在呼吸道内,随着其功能的说明装甲运兵车之前和在病毒感染过程中,提供的承诺发展新的和更有效的疫苗接种策略对病毒和其他呼吸道病原体。新兴的证据表明效应的光谱抗病毒CD8所展现出来的活动+T细胞可能不同,这取决于co-stimulation水平得到提高的可能性,在呼吸道病毒的情况下,复制是局限于呼吸道上皮,过度的炎症与严重感染可以通过阻止co-stimulatory控制信号,在不改变免疫介导的病毒清除。
更普遍的是,最近的证据强烈表明,激活状态和功能效应T细胞在病毒感染的肺部受到当地居民产生的环境和浸润炎症细胞和它们产生的因素对病毒感染的反应。这些额外的造型感染的免疫反应的网站会影响病毒清除的过程和对急性炎症的规定,同样重要的影响和可能的免疫记忆。
解决呼吸道病毒感染不仅需要消除病毒,也正常的肺结构的修复和再生,最重要的是,恢复正常的肺功能。虽然目前该决议反应只是知之甚少,赞赏,细胞和分子的先天和适应性免疫系统对病毒感染的反应下呼吸道几乎肯定会做出贡献。是否和如何将这些细胞和分子调控过程,如上皮细胞向间充质细胞转换,以及成纤维细胞和的变换纤维细胞myofibroblasts,将成为一个激烈的研究领域,因为这些过程的失调在肺部炎症反应与进步的肺损伤和肺纤维化。
引用
陈,y . et al .小说假定的干细胞/祖CD34的子集+Oct-4+细胞的主要目标是SARS冠状病毒在人类的肺。j . Exp。地中海。204年,2529 - 2536 (2007)。
Mallick B。,Ghosh, Z. & Chakrabarti, J. MicroRNome analysis unravels the molecular basis of SARS infection in bronchoalveolar stem cells.《公共科学图书馆•综合》4e7837 (2009)。
山中,k . et al .禽流感:流感病毒受体在人类气道。自然440年,435 - 436 (2006)。
山田,s . et al .血凝素突变负责绑定H5N1流感病毒人类式的受体。自然444年,378 - 382 (2006)。
Khatri, M。,O'Brien, T. D., Goyal, S. M. & Sharma, J. M. Isolation and characterization of chicken lung mesenchymal stromal cells and their susceptibility to avian influenza virus.Dev, Comp。Immunol。34,474 - 479 (2010)。
麦吉尔,J。,Heusel, J. W. & Legge, K. L. Innate immune control and regulation of influenza virus infections.j . Leukoc。医学杂志。86年,803 - 812 (2009)。
庞,即k & Iwasaki a Inflammasomes作为介质对流感病毒的免疫力。Immunol趋势。3241 (2011)。
竹内,o . &彰,s先天免疫病毒感染。Immunol。牧师。227年,75 - 86 (2009)。
霍尔特,p·G。,斯特里克兰,d . H。,Wikstrom, M. E. & Jahnsen, F. L. Regulation of immunological homeostasis in the respiratory tract.启Immunol性质。8,142 - 152 (2008)。
Waffarn, e . e . & Baumgarth:保护B细胞应对流感——没有侥幸!j . Immunol。186年,3823 - 3829 (2011)。
Snelgrove, r . j . et al .关键函数CD200肺免疫内稳态和流感感染的严重程度。Immunol性质。9,1074 - 1083 (2008)。本文表明CD200R肺巨噬细胞免疫内稳态的关键在静息状态和限制炎性反应的幅度和持续时间在肺部感染流感病毒。
科比,a . C。,Coles, M. C. & Kaye, P. M. Alveolar macrophages transport pathogens to lung draining lymph nodes.j . Immunol。183年,1983 - 1989 (2009)。
Plantinga, M。,Hammad, H. & Lambrecht, B. N. Origin and functional specializations of DC subsets in the lung.欧元。j . Immunol。40,2112 - 2118 (2010)。
金,t . s . & Braciale t . j .呼吸道树突细胞有不同的子集支持诱导特异性细胞毒性CD8的能力+T细胞反应。《公共科学图书馆•综合》4e4204 (2009)。本文表明,不同子集的迁徙呼吸DCs效率呈现不同virus-derived天真CD4抗原+和CD8+T细胞在排水节点为了应对呼吸道病毒感染。
德尔里奥,m . L。,Rodriguez-Barbosa, J. I., Kremmer, E. & Forster, R. CD103−和CD103+支气管淋巴结树突细胞是专门展示和CD4 cross-presenting无害的抗原+和CD8+T细胞。j . Immunol。178年,6861 - 6866 (2007)。
唱,et al。肺CD103(αE) -β7 integrin-positive上皮树突细胞群表达Langerin和紧密连接蛋白。j . Immunol。176年,2161 - 2172 (2006)。本文提供了第一个证据,CD103+和CD11b嗨肺呼吸DCs是主要的直流人口。
GeurtsvanKessel, c . h . et al .间隙的流感病毒肺取决于迁徙langerin+CD11b−但不是血浆树突细胞。j . Exp。地中海。205年,1621 - 1634 (2008)。本文表明langerin+CD11b−迁徙呼吸DCs CD8所需有效+T细胞活化和病毒清除在活的有机体内。
Bursch l . s . et al .识别小说Langerin人口+树突细胞。j . Exp。地中海。204年,3147 - 3156 (2007)。
Helft, J。,Ginhoux, F., Bogunovic, M. & Merad, M. Origin and functional heterogeneity of non-lymphoid tissue dendritic cells in mice.Immunol。牧师。234年55 - 75 (2010)。
说道。b . t . et al . CD103外围+树突细胞形成一个统一的子集CD8α发育相关+传统的树突细胞。j . Exp。地中海。207年,823 - 836 (2010)。
Ginhoux, f . et al . CD103 nonlymphoid组织的起源和发展+DCs。j . Exp。地中海。206年,3115 - 3130 (2009)。
摇摆的,s R。,Rose, C. E. Jr & Sung, S. S. Diverse and potent chemokine production by lung CD11b高树突细胞在体内平衡和过敏性肺部炎症。j . Immunol。178年,1882 - 1895 (2007)。
Jakubzick, c . et al .血液单核细胞产生CD103不同子集+和CD103−肺部树突状细胞数量。j . Immunol。180年,3019 - 3027 (2008)。
林,k . L。,Suzuki, Y., Nakano, H., Ramsburg, E. & Gunn, M. D. CCR2+monocyte-derived树突状细胞和巨噬细胞分泌物产生influenza-induced肺免疫病理学和死亡率。j . Immunol。180年,2562 - 2572 (2008)。
奥尔德里奇,小j . r . et al . TNF / iNOS-producing树突细胞的必要之恶是致命的流感病毒感染。Proc。《科学。美国106年,5306 - 5311 (2009)。
詹金斯,s . j . et al。当地巨噬细胞增殖,而不是招聘从血液中,是一个标志性的TH2炎症。科学332年,1284 - 1288 (2011)。
Hammad, h & Lambrecht b . n .树突细胞和上皮细胞:连接先天和适应性免疫的哮喘。启Immunol性质。8,193 - 204 (2008)。
Kitamura, h . et al .老鼠和人类肺成纤维细胞调节树突细胞贩运,气道炎症和纤维化通过整合素αvβ8-mediated TGF-β激活。j .中国。投资。121年,2863 - 2875 (2011)。
Hammad, h . et al .屋尘螨过敏原诱发哮喘通过toll样受体4触发气道结构的细胞。自然医学。15,410 - 416 (2009)。
Marsolais, d . et al .当地没有系统性调制的树突细胞S1P受体肺减弱流感病毒特异性免疫反应。摩尔。杂志。74年,896 - 903 (2008)。
Jakubzick C。Tacke F。,Llodra, J., van Rooijen, N. & Randolph, G. J. Modulation of dendritic cell trafficking to and from the airways.j . Immunol。176年,3578 - 3584 (2006)。
劳伦斯,c . w . & Braciale t . j .激活分化,天真的病毒特异性CD8和迁移+T细胞在肺感染流感病毒。j . Immunol。173年,1209 - 1218 (2004)。
尹,H。,Legge, K. L., Sung, S. S. & Braciale, T. J. Sequential activation of CD8+T细胞在淋巴结反应肺病毒感染。j . Immunol。179年,391 - 399 (2007)。
Khanna k . m . et al。原位成像揭示了不同反应由天真和CD8记忆T细胞抗原表达年末淋巴结后直流流感病毒感染。欧元。j . Immunol。38,3304 - 3315 (2008)。
金,t·S。,高度,M . M。,太阳,J。,Fu, Y. X. & Braciale, T. J. Antigen persistence and the control of local T cell memory by migrant respiratory dendritic cells after acute virus infection.j . Exp。地中海。207年,1161 - 1172 (2010)。
茨,g . t . et al。不同的迁移和nonmigrating树突细胞群体参与类I-restricted MHC抗原演讲后肺部感染病毒。Proc。《科学。美国101年,8670 - 8675 (2004)。
luken, m V。,Kruijsen, D., Coenjaerts, F. E., Kimpen, J. L. & van Bleek, G. M. Respiratory syncytial virus-induced activation and migration of respiratory dendritic cells and subsequent antigen presentation in the lung-draining lymph node.j .性研究。83年,7235 - 7243 (2009)。
波:M。,Busick, R. Y. & Alexander-Miller, M. A. Functional divergence among CD103+树突状细胞亚群后肺部感染痘病毒。j .性研究。84年,10191 - 10199 (2010)。
Tournier, j . n . & Mohamadzadeh m .关键角色的树突细胞在肺部感染、改善炭疽疫苗。趋势地中海摩尔。。16,303 - 312 (2010)。
Ballesteros-Tato,。莱昂,B。,Lund, F. E. & Randall, T. D. Temporal changes in dendritic cell subsets, cross-priming and costimulation via CD70 control CD8+流感的T细胞反应。Immunol性质。11,216 - 224 (2010)。本文表明CD11b嗨迁徙呼吸DCs控制抗原表达在感染的高峰期。
Moltedo B。李,W。,Yount, J. S. & Moran, T. M. Unique type I interferon responses determine the functional fate of migratory lung dendritic cells during influenza virus infection.公共科学图书馆Pathog。7e1002345 (2011)。
盖尔,a . n . et al . CD103+肺部树突状细胞优先收购和现在的凋亡细胞相关抗原。j . Exp。地中海。208年,1789 - 1797 (2011)。
Ho a . w . et al .肺CD103+树突细胞高效运输流感病毒的淋巴结和加载病毒抗原在MHC类我表示CD8 T细胞。j . Immunol。187年,6011 - 6021 (2011)。
Nakano, h . et al .血液炎症树突细胞在淋巴结刺激急性辅助T 1型免疫反应。Immunol性质。10,394 - 402 (2009)。
Zammit d J。,Turner, D. L., Klonowski, K. D., Lefrancois, L. & Cauley, L. S. Residual antigen presentation after influenza virus infection affects CD8 T cell activation and migration.免疫力24,439 - 449 (2006)。
Takamura, s . et al .启动路线影响呼吸道病毒特异性CD8记忆的能力+剩余抗原T细胞被激活。j . Exp。地中海。207年,1153 - 1160 (2010)。
Jelley-Gibbs, d . m . et al .意想不到的长期的流感抗原促进CD4 T细胞记忆的一代。j . Exp。地中海。202年,697 - 706 (2005)。
Brincks, e . L。Katewa,。,Kucaba, T. A., Griffith, T. S. & Legge, K. L. CD8 T cells utilize TRAIL to control influenza virus infection.j . Immunol。181年,4918 - 4925 (2008)。
高度,M . M。金,t·S。,太阳,J。&Braciale, T。J。Antiviral CD8+T细胞效应的活动原位是由目标细胞类型。j . Exp。地中海。208年,167 - 180 (2011)。这项研究表明细胞毒性T淋巴细胞的表达效应活动现场的病毒感染是由目标细胞的类型。
Topham d J。,Tripp, R. A. & Doherty, P. C. CD8+T细胞穿孔素或Fas-dependent流程清晰的流感病毒。j . Immunol。159年,5197 - 5200 (1997)。
格雷厄姆,m . b . et al .应对流感感染小鼠有针对性的中断γ干扰素的基因。j . Exp。地中海。178年,1725 - 1732 (1993)。
厨师,d . n . et al。要求MIP-1α为病毒感染的炎症反应。科学269年,1583 - 1585 (1995)。
胡椒,r . l . & Van Campen h .肿瘤坏死因子作为调停者甲型流感病毒性肺炎的炎症。活细胞。Pathog。19,175 - 183 (1995)。
哈罗德、s等。在流感病毒肺炎肺上皮细胞凋亡:角色的macrophage-expressed TNF-related凋亡诱导配体。j . Exp。地中海。205年,3065 - 3077 (2008)。本文识别TRAIL-expressing上皮细胞凋亡诱导的巨噬细胞作为主要机制招募巨噬细胞,肺引起肺泡泄漏,提高与流感病毒肺炎死亡率相关。
布朗,d . M。,Dilzer, A. M., Meents, D. L. & Swain, S. L. CD4 T cell-mediated protection from lethal influenza: perforin and antibody-mediated mechanisms give a one-two punch.j . Immunol。177年,2888 - 2898 (2006)。
格雷厄姆,m . B。,Braciale, V. L. & Braciale, T. J. Influenza virus-specific CD4+辅助T 2型T淋巴细胞不促进康复实验病毒感染。j . Exp。地中海。180年,1273 - 1282 (1994)。
Debbabi h . et al。主要II型肺泡上皮细胞存在微生物抗原CD4抗原+T细胞。点。j .杂志。肺细胞。摩尔。杂志。289年L274-L279 (2005)。
Topham, d . j . &多尔蒂,p . c .清除CD4的甲型流感病毒+T细胞是低效的B细胞的缺失。j .性研究。72年,882 - 885 (1998)。
Topham d J。,Tripp, R. A., Hamilton-Easton, A. M., Sarawar, S. R. & Doherty, P. C. Quantitative analysis of the influenza virus-specific CD4+T细胞记忆B细胞的缺失和搞笑。j . Immunol。157年,2947 - 2952 (1996)。
劳伦斯c W。,Ream, R. M. & Braciale, T. J. Frequency, specificity, and sites of expansion of CD8+在主肺流感病毒感染T细胞。j . Immunol。174年,5332 - 5340 (2005)。
麦吉尔,j . & Legge k . l .前沿:贡献lung-resident T细胞增殖的总体大小抗原CD8 T细胞反应在小鼠流感病毒感染后的肺。j . Immunol。183年,4177 - 4181 (2009)。
•J。,Xiao, Y. & Borst, J. CD27 promotes survival of activated T cells and complements CD28 in generation and establishment of the effector T cell pool.j . Exp。地中海。198年,1369 - 1380 (2003)。
麦吉尔,J。,Van Rooijen, N. & Legge, K. L. IL-15 trans-presentation by pulmonary dendritic cells promotes effector CD8 T cell survival during influenza virus infection.j . Exp。地中海。207年,521 - 534 (2010)。
van Gisbergen k . p . et al . costimulatory分子CD27维护CD8无性繁殖系地多样化+T细胞反应的低抗原亲和力来防止病毒变体。免疫力35,97 - 108 (2011)。
太阳,J。,Madan, R., Karp, C. L. & Braciale, T. J. Effector T cells control lung inflammation during acute influenza virus infection by producing IL-10.自然医学。15,277 - 284 (2009)。这项研究表明效应(特别是效应CD8 T细胞+T细胞)可以调节部位的炎症感染产生il - 10在应对流感病毒感染。
太阳,J。,Dodd, H., Moser, E. K., Sharma, R. & Braciale, T. J. CD4+T细胞的帮助和innate-derived IL-27诱导Blimp-1-dependent il - 10生产抗病毒ctl。Immunol性质。12,327 - 334 (2011)。
Cretney、大肠等。转录因子Blimp-1和IRF4共同控制效应调节性T细胞的分化和功能。Immunol性质。12,304 - 311 (2011)。
Valitutti, S。穆勒,S。,Dessing, M. & Lanzavecchia, A. Different responses are elicited in cytotoxic T lymphocytes by different levels of T cell receptor occupancy.j . Exp。地中海。183年,1917 - 1921 (1996)。
Dolfi, d . v . et al .树突细胞维持病毒特异性CD8所需和CD28聚集有关+在效应T细胞反应阶段在活的有机体内。j . Immunol。186年,4599 - 4608 (2011)。
汉弗莱斯,i r . et al。这个理事会的一个关键角色co-stimulation免疫控制肺部感染流感病毒。欧元。j . Immunol。36,2928 - 2938 (2006)。
汉弗莱斯,i r . et al . OX40的关键作用在肺病毒感染T细胞介导免疫病理反应。j . Exp。地中海。198年,1237 - 1242 (2003)。
林,g . h . et al .内源性4-1BB配体从influenza-induced疾病保护发挥了至关重要的作用。j . Immunol。182年,934 - 947 (2009)。
斯奈尔,l . m . et al . CD8 T细胞内在GITR需要T细胞克隆扩张和老鼠生存严重的流感感染。j . Immunol。185年,7223 - 7234 (2010)。
麦吉尔,J。,Van Rooijen, N. & Legge, K. L. Protective influenza-specific CD8 T cell responses require interactions with dendritic cells in the lungs.j . Exp。地中海。205年,1635 - 1646 (2008)。
Snelgrove, r . J。,Godlee, A. & Hussell, T. Airway immune homeostasis and implications for influenza-induced inflammation.Immunol趋势。32,328 - 334 (2011)。
La Gruta n . L。,Kedzierska, K., Stambas, J. & Doherty, P. C. A question of self-preservation: immunopathology in influenza virus infection.Immunol。细胞生物。85年,85 - 92 (2007)。
坎贝尔,d . j . &科赫m·a·FOXP3的表型和功能专业化+调节性T细胞。启Immunol性质。11,119 - 130 (2011)。
Ohkura: &坂口s效应调节性T细胞的成熟。Immunol性质。12,283 - 284 (2011)。
科赫,m . a . et al .转录因子T-bet控制调节性T细胞体内平衡和功能在1型炎症。Immunol性质。10,595 - 602 (2009)。
Ruckwardt, t·J。,Bonaparte, K. L., Nason, M. C. & Graham, B. S. Regulatory T cells promote early influx of CD8+T细胞在肺部呼吸道合胞病毒感染的小鼠和减少immunodominance差距。j .性研究。83年,3019 - 3028 (2009)。
富尔顿,r . B。,Meyerholz, D. K. & Varga, S. M. Foxp3+调节性T细胞CD4限制肺免疫病理调节CD8 T细胞反应在呼吸道合胞病毒感染。j . Immunol。185年,2382 - 2392 (2010)。
李,d . c . et al . CD25+自然调节性T细胞天然免疫与适应性免疫的关键限制和解决疾病后呼吸道合胞体病毒感染。j .性研究。84年,8790 - 8798 (2010)。
安图内斯,即& Kassiotis g .抑制先天免疫病理学的调节性T细胞在免疫缺陷小鼠的甲型流感病毒感染。j .性研究。84年,12564 - 12575 (2010)。
帕默,e . M。,Holbrook, B. C., Arimilli, S., Parks, G. D. & Alexander-Miller, M. A. IFNγ-producing, virus-specific CD8+效应细胞获得的能力产生il - 10由于进入肺感染的环境。病毒学404年,225 - 230 (2010)。
太阳,j . et al。自分泌调节肺部炎症效应t细胞产生il - 10在呼吸道合胞病毒感染。公共科学图书馆Pathog。7e1002173 (2011)。
维斯,k。,Christiaansen, A. F., Fulton, R. B., Meyerholz, D. K. & Varga, S. M. Multiple CD4+T细胞产生免疫调节子集il - 10在呼吸道合胞病毒感染。j . Immunol。187年,3145 - 3154 (2011)。
Smit, J·J。,Rudd, B. D. & Lukacs, N. W. Plasmacytoid dendritic cells inhibit pulmonary immunopathology and promote clearance of respiratory syncytial virus.j . Exp。地中海。203年,1153 - 1159 (2006)。
泰特,m . d . et al .中性粒细胞改善肺损伤在流感感染和严重疾病的发展。j . Immunol。183年,7441 - 7450 (2009)。
Shirey说,k . a . et al . RSV-induced肺损伤的控制或者激活巨噬细胞是IL-4Rα,TLR4和IFN-β-dependent。粘膜Immunol。3,291 - 300 (2010)。这项研究表明或者激活巨噬细胞可能调解解决RSV-induced肺损伤。
突袭,j . i . et al . Macrophage-specific PPARγ控制替代激活和改善胰岛素抵抗。自然447年,1116 - 1120 (2007)。
威廉姆斯,a . e . et al . TGF-β防止嗜酸性肺病,但损害病原体间隙。微生物感染。7,365 - 374 (2005)。
卡尔森,c . m . et al .转变增长factor-β:激活神经氨酸酶和在高致病性H5N1流感发病机制中的作用。公共科学图书馆Pathog。6e1001136 (2010)。
她从来,j . A。斑点,k . M。,Williams, B. F., Liang, H. & Mirro, J. Jr. Increased influenza vaccination of healthcare workers at a pediatric cancer hospital: results of a comprehensive influenza vaccination campaign.感染。控制Hosp.论文。27,77 - 79 (2006)。
Morens, d . M。,Taubenberger, J. K. & Fauci, A. S. Predominant role of bacterial pneumonia as a cause of death in pandemic influenza: implications for pandemic influenza preparedness.j .感染。说。198年,962 - 970 (2008)。
包蒂斯塔、大肠等。临床方面的2009年大流行甲型流感(H1N1)病毒感染。心血管病。j .地中海。362年,1708 - 1719 (2010)。
博林格,m . n . & Standiford t . j . Postinfluenza细菌性肺炎:宿主防御失败。细胞因子Res j .干扰素。30.,643 - 652 (2010)。
杰米逊,a . M。Yu, S。,Annicelli, C. H. & Medzhitov, R. Influenza virus-induced glucocorticoids compromise innate host defense against a secondary bacterial infection.细胞宿主细菌7,103 - 114 (2010)。
Didierlaurent, a . et al .持续脱敏解决后细菌toll样受体配体呼吸道流感感染。j . Exp。地中海。205年,323 - 329 (2008)。
太阳,k & Metzger d . w .抑制肺抗菌防御康复期间,interferon-γ流感感染。自然医学。14,558 - 564 (2008)。这项研究表明IFNγ能促进继发性细菌感染流感病毒感染后的表达下调表达类对肺泡巨噬细胞清道夫受体马可。
高尔丁,j . et al。降低肺部先天免疫细胞的激活阈值改变对继发性细菌重复感染的易感性。j .感染。说。204年,1086 - 1094 (2011)。
中村,r . et al . Interleukin-15至关重要的甲型流感病毒诱导急性肺损伤的发病机制。j .性研究。84年,5574 - 5582 (2010)。
麦克纳米,洛杉矶& Harmsen, a·g·influenza-induced嗜中性粒细胞功能障碍和neutrophil-independent机制有助于增加对次要的链球菌引起的肺炎感染。感染。Immun。74年,6707 - 6721 (2006)。
库珀j . A . Jr Carcelen, r & Culbreth r .甲型流感核蛋白对多形核中性粒细胞功能的影响。j .感染。说。173年,279 - 284 (1996)。
Manicassamy, b . et al .分析在活的有机体内流感病毒感染小鼠使用绿色荧光蛋白动力学记者病毒。Proc。《科学。美国107年,11531 - 11536 (2010)。
Shahangian, a . et al . I型干扰素调节postinfluenza细菌性肺炎小鼠的发展。j .中国。投资。119年,1910 - 1920 (2009)。本研究表明,I型干扰素能促进继发性细菌感染流感病毒感染后通过抑制招募中性粒细胞的趋化因子的产生肺。
小,c . l . et al .流感感染导致后续细菌重复感染易感性增加肺损害NK细胞反应。j . Immunol。184年,2048 - 2056 (2010)。
郭,h . et al。自然杀伤细胞的功能障碍在流感病毒感染。Immunol。细胞生物。87年,579 - 589 (2009)。
麦金斯,缺k . k . et al . il - 10释放了一个流感特定Th17响应对高剂量和提高生存挑战。j . Immunol。182年,7353 - 7363 (2009)。
van der Sluijs k . f . et al . il - 10是一个重要的调停人的增强后肺炎球菌肺炎流感感染的易感性。j . Immunol。172年,7603 - 7609 (2004)。
帕·A . et al .流感抑制Th17-mediated主机防御在小鼠细菌性肺炎。j . Immunol。186年,1666 - 1674 (2011)。这项研究表明流感病毒感染抑制抗菌T的发展H17日通过I型干扰素诱导的细胞反应。
郑,t . et al .诱导针对IL-13成人肺引起基质金属蛋白酶和cathepsin-dependent肺气肿。j .中国。投资。106年,1081 - 1093 (2000)。
巴恩斯,p . j .细胞因子网络在哮喘和慢性阻塞性肺病。j .中国。投资。118年,3546 - 3556 (2008)。
卢卡奇,n . w . et al .微分引起的免疫反应和肺部病理生理学是两个不同的呼吸道合胞体病毒株。点。j .分册。169年,977 - 986 (2006)。
格雷森,m . h . et al .诱导的高亲和性IgE受体在肺部树突状细胞病毒感染导致粘液细胞化生。j . Exp。地中海。204年,2759 - 2769 (2007)。
金,e . y . et al。持续激活先天免疫反应的呼吸道病毒感染转换为慢性肺部疾病。自然医学。14,633 - 640 (2008)。
Wills-Karp, m & Finkelman f . d .先天淋巴细胞发挥一把双刃剑。Immunol性质。12,1025 - 1027 (2011)。
常,y . j . et al .先天淋巴细胞调节influenza-induced气道hyper-reactivity独立于适应性免疫。Immunol性质。12,631 - 638 (2011)。
)美国。,Noti, M. & Artis, D. Innate immune cell populations function as initiators and effectors in Th2 cytokine responses.Immunol趋势。31日,407 - 413 (2010)。
Monticelli,洛杉矶et al .先天淋巴细胞促进感染流感病毒后肺组织内稳态。Immunol性质。12,1045 - 1054 (2011)。
GeurtsvanKessel, c . h . et al .树突细胞是至关重要的三级淋巴结构维护的流感病毒感染小鼠的肺。j . Exp。地中海。206年,2339 - 2349 (2009)。
哈莉·s . et al。此外诱导淋巴组织作为一般启动网站T细胞,是由树突细胞。j . Exp。地中海。206年,2593 - 2601 (2009)。
Gereke, M。荣格,S。,Buer, J. & Bruder, D. Alveolar type II epithelial cells present antigen to CD4+T细胞和诱导Foxp3+调节性T细胞。点。j .和。暴击。保健医疗。179年,344 - 355 (2009)。
斯特里克兰,d . H。,Kees, U. R. & Holt, P. G. Suppression of T-cell activation by pulmonary alveolar macrophages: dissociation of effects on TcR, IL-2R expression, and proliferation.欧元。和。J。7,2124 - 2130 (1994)。
Daughety, t·W。Marrack, P。,Kappler, J. W. & Chiller, J. M. The capacity of murine alveolar macrophages to stimulate antigen-dependent T-lymphocyte activation and proliferation.细胞。Immunol。79年,374 - 382 (1983)。
GeurtsvanKessel, c . h . et al。传统和干扰素杀手树突状细胞抗原递呈能力在流感病毒感染。《公共科学图书馆•综合》4e7187 (2009)。
柳,j·K。,Galligan, C. L., Virtanen, C. & Fish, E. N. Identification of a novel antigen-presenting cell population modulating antiinfluenza type 2 immunity.j . Exp。地中海。207年,1435 - 1451 (2010)。
确认
我们感谢Braciale实验室的成员的社论援助和深刻的讨论,和他的同事在现场提供最近的出版物和个人通信。由于空间限制,我们道歉无法引用许多主要引用相关综述的主题。本研究支持赠款T.J.B.来自美国国立卫生研究院(RO1 ai - 15608, RO1 ai - 37293, RO1 hl - 33391和U-19 ai - 83024)。T.S.K.和J.S.二是接受来自美国肺脏协会的高级研究培训奖学金。
作者信息
从属关系
相应的作者
道德声明
相互竞争的利益
作者声明没有竞争的经济利益。
相关链接
术语表
- I型和II型肺泡上皮细胞
-
I型肺泡上皮细胞(也称为鳞状肺泡细胞和I型pneumocytes)形成肺泡壁的结构和负责肺泡的气体交换。II型肺泡上皮细胞(也称为伟大的肺泡细胞)不断地分泌肺表面活性剂降低肺液体的表面张力,从而提高气体交换。
- 急性呼吸窘迫综合征
-
(ARDS)。严重的肺部炎性疾病通常是由另一个肺部病理。不受控制的炎症会导致气体交换障碍,肺泡洪水和/或崩溃,和全身炎症反应综合征。
- 血浆DCs
-
(髓样)。定义的树突细胞(DC)亚型的表达CD11c B220和缺乏CD8 CD11b。髓是专业生产大量的I型干扰素在应对病毒感染,因此他们有一个重要的角色在病毒的免疫反应。
- 整合素
-
的成员的一组蛋白质调节细胞彼此的依恋(信息粘连)和周围的蛋白质和其他分子网络(cell-matrix附着力)。整合蛋白还传递化学信号,调节细胞生长和某些基因的活性。
- Sphingosine-1-phosphate
-
(S1P)。鞘脂类,参与信号。在免疫系统中,S1P诱发淋巴细胞的出口由绑定S1P受体在细胞淋巴器官。
- Cross-presentation
-
可以启动CD8机制+T细胞反应的抗原,抗原递呈细胞(apc)中不存在。这种外源性抗原必须被装甲运兵车,然后重新路由到的抗原MHC类我途径。
- Efferocytosis
-
凋亡细胞的吞噬清除之前进行继发性坏死。这个过程通常引发抗炎反应。
- 炎症状突
-
树突状细胞(dc)通常不出现在稳定状态,但由于炎症或微生物刺激发展。例如,其中一个子集是肿瘤坏死因子,诱导一氧化氮synthase-producing DCs (DCs)。炎症性单核细胞也可以引起炎症DCs。
- 效应T注册细胞
-
调节性T (T注册)细胞表达特定的转录因子,如T-bet,并遵循一个分化途径获得表型或函数有效地控制效应T细胞的特定子集,如TH1细胞。
- 或者激活巨噬细胞
-
(也称为M2巨噬细胞)。刺激的巨噬细胞il - 4或IL-13精氨酸酶1表达,甘露糖受体CD206和il - 4受体。可能有其分子模式表达的寄生虫,也可以选择激活的巨噬细胞。
- 先天淋巴细胞
-
(ilc;也称为自然辅助细胞和nuocytes)。细胞结合先天和适应性免疫功能和对粘膜感染的第一道防线。ilc是区别于自适应独立于recombination-activating淋巴细胞的基因和由此产生的缺乏特异性抗原受体。它们产生大量的2型细胞因子如IL-5和IL-13。
- 纤维细胞
-
成熟的成纤维细胞,不再产生纤维结缔组织或细胞间物质。成纤维细胞大,扁平细胞形成的胶原和弹性纤维和细胞间物质疏松结缔组织。
权利和权限
关于这篇文章
引用这篇文章
Braciale, T。,太阳,J。&Kim, T. Regulating the adaptive immune response to respiratory virus infection.Nat Immunol牧师12日,295 - 305 (2012)。https://doi.org/10.1038/nri3166
发表:
发行日期:
DOI:https://doi.org/10.1038/nri3166
进一步的阅读
管理COVID-19大流行期间的哮喘病人:病理生理学考虑应对的挑战
Beni-Suef大学基础和应用科学杂志》上(2022)
甲型流感病毒引起的转座子的描述揭示了一个群转座子可能拥有监管作为厄纳
科学报告(2022)
非常规COVID-19 T细胞的作用
爱尔兰医学科学杂志》(1971 -)(2022)
飞行员的审判病危COVID-19患者大剂量维生素C
年报的重症监护(2021)
动力学COVID-19 TCR曲目和T细胞功能的康复的人
细胞的发现(2021)