摘要
冠状病毒(包括导致严重急性呼吸综合征(SARS)的冠状病毒)的Spike (S)蛋白与细胞受体相关联,介导其靶细胞的感染1,2.在这里,我们鉴定了一种金属肽酶,血管紧张素转换酶2 (ACE2)。3.,4从SARS冠状病毒(SARS-COV) - 智能VERO E6细胞中分离,可有效结合SARS-COV S蛋白的S1结构域。我们发现一种可溶性形式的ACE2,但不是相关酶ACE1,封闭S1结构域与VERO E6细胞的关联。293T用ACE2转染的细胞,但不是用人免疫缺陷病毒-1受体转染的细胞,形成多核合胞苷,具有表达蛋白的细胞。此外,SARS-COV有效地在ACE2转染但未进行模拟转染293T细胞上。最后,抗ACE2但不是抗ACE1抗体阻断Vero E6细胞的病毒复制。我们的数据一起表明ACE2是SARS-COV的功能受体。
主要的
到目前为止,已经确定了两种冠状病毒表面受体5.第II族冠状病毒小鼠肝炎病毒(MHV)使用鼠癌胚抗原相关的细胞粘附分子(CEACAM),免疫球蛋白超家族的受体的成员6.许多I组冠状病毒,例如人类冠状病毒229E、传染性胃肠炎病毒和猫传染性腹膜炎病毒,需要锌金属蛋白酶氨基肽酶N(APN,CD13)进入其靶细胞7,8,9.最近,一种独特的冠状病毒被确定为SARS的病因。SARS是一种以非典型肺炎为特征的急性肺综合征,在近10%的病例中会导致进行性呼吸衰竭和死亡10.,11.,12.,13..SARS-COV基因组的分析表明,该病毒不属于三种定义的冠状病毒组中的任何一种,并且SARS-COV S蛋白类似地是不同的14.,15..类似于类似人类免疫缺陷病毒(HIV)和流感蛋白质,一些冠状病毒的S蛋白质 - 包括MHV和III族冠状病毒感染性支气管炎病毒通过在病毒产生的细胞蛋白酶中切割成两个亚基(S1和S2)细胞16.,17.。其他冠状病毒的S蛋白,包括I组和可能的SARS-CoV的S蛋白,在产生病毒的细胞中不被裂解14.,15.,18..尽管如此,可以通过与切割的冠状病毒S蛋白的S1和S2亚基的同源性来鉴定这些后者蛋白的S1和S2结构域。所有特征冠状病毒的S1结构域与各自的受体介导初始高亲和关联19.,20.,21..
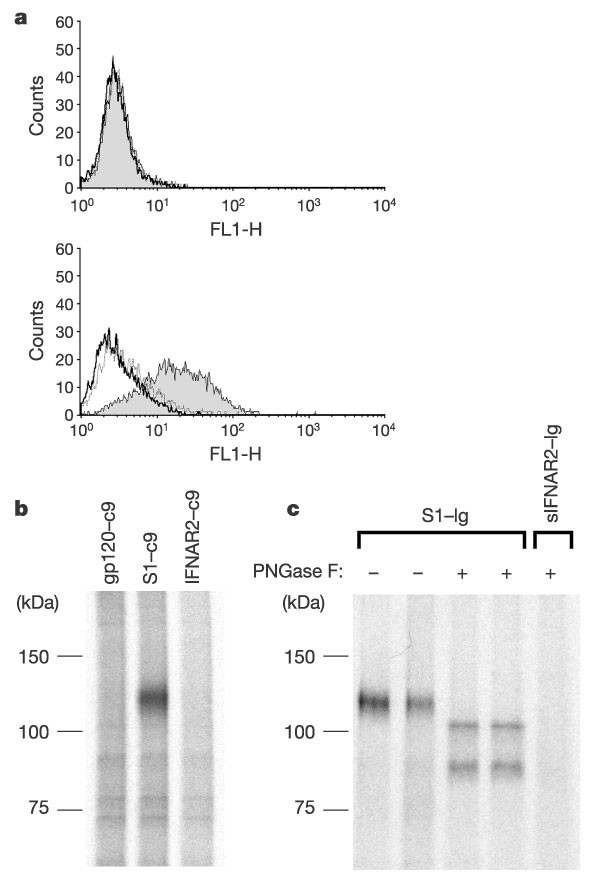
非洲绿猴肾细胞系Vero E6允许sars冠状病毒的复制10..我们首先研究了SARS-COV S蛋白的S1结构域是否可以与Vero E6细胞结合。图1一个结果表明,表达SARS-CoV S蛋白12-672残基的蛋白融合到人免疫球蛋白-γ1 (IgG1;S1-Ig),特异性识别了Vero E6细胞上的一部分,但不与人肾脏293T细胞结合。使用相同的融合蛋白(图1C.)或S1域的羧基终端标记形式(图。1B),一条约110的蛋白带 用0.3%溶解的代谢标记Vero E6细胞可免疫沉淀kDan-decyl-β-d- 在磷酸盐缓冲盐水中的MaltopyranoSide。当用Pngase F温育免疫沉淀的蛋白质时,一种去除的酶N-糖基化,在大约80–85和100处观察到两条带 kDa(图1C.,车道3和4)。
一个,S1结构域(S1-IG,阴影区域)的融合蛋白或该结构域的第一327个残基(S1(327)-IG,虚线),其单独使用人IgG1的Fc结构域或培养基(厚线)与293T(顶面板)或VERO E6(底部面板)细胞孵育。使用FITC标记的抗人IgG二次抗体流式细胞术测量融合蛋白与细胞的结合。b代谢标记的Vero E6细胞裂解液用HIV-1 gp120、SARS-CoV S1结构域或人IFNAR2的外结构域免疫沉淀,每个结构域在其C端包含一个标签(C9)和一个抗标签抗体。免疫沉淀用SDS-PAGE分析。c,用S1-Ig或可溶性IFNAR2-Ig免疫培养的Vero E6细胞裂解物。如所示,用PNGase F处理或不处理免疫沉淀,并用SDS-PAGE分析。
然后我们用胰蛋白酶消化和质谱分析了110 kDa波段。鉴定了3种人类蛋白,其序列与从该条带获得的大量胰蛋白酶片段一致。其中两种蛋白,肌凝蛋白1b和主拱顶蛋白,并不定位于细胞表面,而是普遍表达,因此我们没有进一步分析它们。同时鉴定出8个独立的胰蛋白酶片段,与人类ACE2的17%氨基酸序列一致(补充信息).因为ACE2的组织分布和亚细胞定位都适合sars冠状病毒的受体3.,22.,23.,我们从人类肺中获得的互补DNA中克隆了它,以供进一步分析。
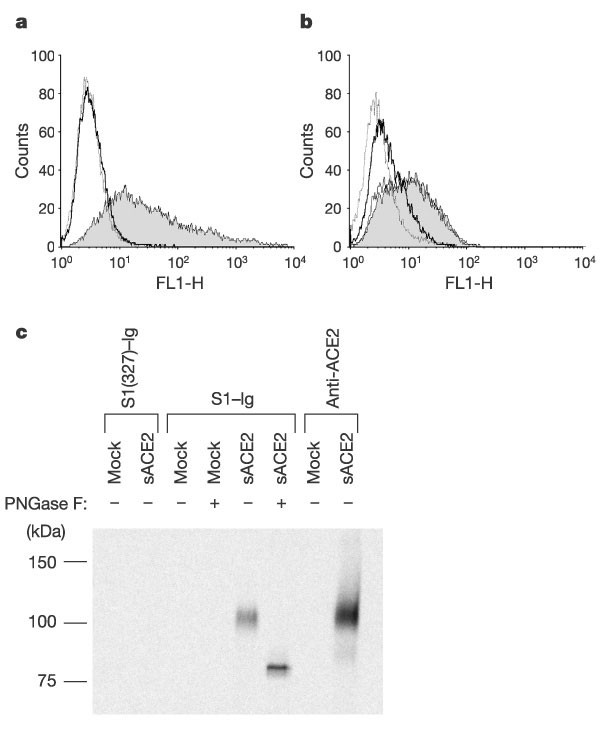
用αce2转染293t细胞,但单独用载体转染的细胞,特别是S1-Ig(图2A).一种可溶形式的ACE2,但不是相关酶ACE1的形式,阻断了S1-Ig与Vero E6细胞的关联(图。2B).此外,S1-Ig免疫沉淀了一种可溶性ACE2 (图2C.,由抗ACE2抗体(泳道8)识别的泳道5)。当与Pngase F温育大约110kDa可溶性形式的Ace 2时,观察到85kDa带(图2C.,泳道5和6),表明在PNGase-F处理的vero E6免疫沉淀物中观察到的下带是ACE2(图1C.这些数据表明,SARS-CoV S蛋白S1结构域与ACE2之间存在一种特殊的、高亲和力的关联。
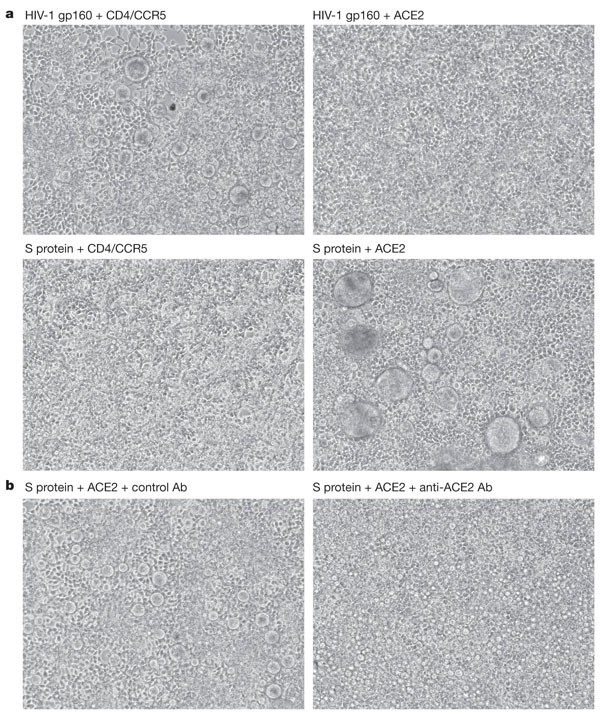
在某些情况下,介导病毒和细胞膜融合的蛋白质也可以在表达病毒融合蛋白的细胞和表达病毒受体的细胞之间介导融合。例如,表达HIV-1包膜糖蛋白gp160的细胞可以与表达HIV-1受体CD4和CCR5的细胞形成多核合胞体(参考。24.).因为在SARS-COV感染的灵感中感染了SARS-COV的VERO E6培养物中,在SARS-COV感染的灵长类动物和SARS患者中观察到Syncytia10.,12.,13.,我们研究了表达SARS冠状病毒S蛋白的293T细胞是否能与表达ACE2的293T细胞融合。图3A表明这些细胞能有效地形成合胞体。正如预期的那样,CD4和CCR5转染的293T细胞与表达HIV-1 gp160的细胞(左上)形成了许多合胞体,但与表达SARS-CoV S蛋白的细胞(左下)没有形成合胞体。而表达ACE2的293T细胞并没有与表达gp160的细胞形成合胞体(右上),而是与表达S蛋白的细胞形成了许多大的合胞体(右下)。表达S蛋白的293T细胞也能有效地与ACE2形成合胞体,但没有模拟转染的HeLa细胞(未显示)。抗ACE2的亲和纯化抗体可阻断S蛋白-与表达ACE2的细胞合胞形成95%以上,而对照抗体则不能(图3B.).这些数据表明,SARS-CoV S蛋白介导细胞-细胞融合的能力依赖于ACE2的存在。
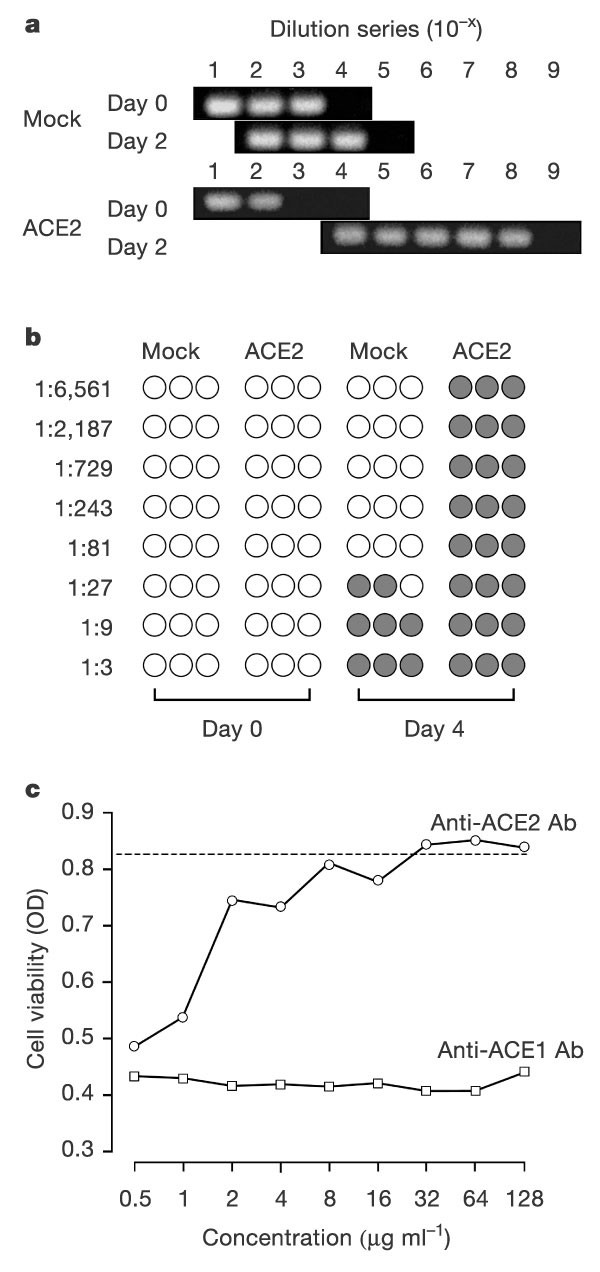
然后我们研究了ACE2介导病毒复制的能力。ACE2-和模拟转染的293T细胞在有或没有sars冠状病毒的情况下孵育。在培养2天后,在感染ace2的细胞(未显示)的培养中,观察到大量分离的、圆形的、漂浮的细胞,与病毒复制一致。相比之下,感染的模拟转染细胞和未感染的ace2转染细胞与未感染的对照细胞没有区别,这些细胞没有在感染的ace2表达细胞中观察到的细胞病变迹象。图4.结果表明,ACE2-而非模拟转染的293T细胞支持sars冠状病毒的有效复制。采用半定量反转录聚合酶链反应(RT-PCR)检测细胞上清中的病毒基因组RNA。我们发现,在转染ace2的细胞中,病毒基因组拷贝在最初48小时内增加了10万倍以上(图4A,下半部分)。相反,模拟转染细胞的基因组拷贝在同一时期增加了10倍(上图),表明在293T细胞上有一些基础复制。此外,用滴定法在Vero E6细胞上测定感染ACE2-和模拟转染细胞上清液中的病毒滴度。所示图4B.在此基础上,研究人员发现,从被ace2转染的细胞中提取的病毒在感染96小时后可在Vero E6细胞上有效复制,其可见细胞病变效应(CPE)可达或包括最高稀释倍数(1:6 561),而从模拟转染的细胞中提取的病毒无法诱导超过1:27稀释倍数的CPE。与两种感染试验中观察到的基础复制一致,随后用抗ACE2抗体检测到293T细胞上的少量表达(补充信息).我们还研究了抗ace2抗体抑制Vero E6细胞上病毒复制的能力。抗ace1抗体对病毒诱导的细胞病变无明显影响,而抗ace2抗体以剂量依赖性的方式抑制细胞病变(图4C.).统称,这些数据表明,ACE2大大贡献了SARS-COV复制的效率。
一个用sars冠状病毒感染293T细胞1 h,洗涤后0、48 h取细胞上清。在不同稀释的上清液中通过RT-PCR检测病毒RNA。每组均显示稀释终点。b,在96-孔微量滴定板上介在96-孔微量滴定板上的Vero E6细胞的一式三份,在指定的稀释液中在指定的稀释液中温育。由阴影圆圈表示的细胞病变效应,在VERO E6细胞感染后3天监测。c在感染SARS-CoV前,将Vero E6细胞的重复样本与亲和纯化的山羊抗ace1或抗ace2抗体在指定浓度下孵育。清洗细胞,用CellTiter 96检测细胞活力,显示490 nm波长下的平均光密度(OD)。虚线表示未感染细胞的活力。任一抗体的最大浓度处理未感染细胞均未观察到毒性。
我们在这里证明,ACE2可以通过SARS-CoV S蛋白的S1域从Vero E6细胞中免疫沉淀,它介导了与S蛋白表达细胞的融合,并且它促进了病毒在一个对SARS-CoV感染无效的细胞系中的复制。此外,抗ace2抗体还能特异性抑制合胞体的形成和病毒的复制。这些数据表明ACE2是sars冠状病毒的功能性受体。对72个人体组织进行了实时荧光定量PCR分析,证实了该蛋白的高效表达ACE2支气管、肺实质以及心脏、肾脏和胃肠道中的信使RNA23..肺和肾也是鼠ACE2表达的主要部位(参考文献。22.).这种组织分布与SARS的病理相符,SARS的特征是急性肺部感染10.,11.,12..在感染患者的肾脏组织中也发现了sars冠状病毒10.,它有效地复制了灵长类动物肾细胞系FRHK-4和VERO E6(参考文献10.,12.).在小肠和大肠中已观察到活跃的病毒复制25..在粪便中发现病毒11.可以反映这些组织中ACE2消息的表达23..ACE2在大多数这些组织中的生理作用尚未确定,尽管ACE2被认为是心脏功能的重要调节器26..已经鉴定了候选底物,其中一些调节血管缺陷性。27..目前尚不清楚SARS-COV是否干扰ACE2酶活性,以有助于SARS的发病机制。
CD13是许多冠状病毒的受体,像ACE2,一种锌金属蛋白酶;然而,除了这些共性之外,这两种受体还有很大的差异。这可能表明,这类蛋白酶的某些特性有助于病毒复制。然而,CD13催化位点的突变并不干扰传染性胃肠炎病毒的组织培养复制,该病毒以该酶为受体7,28..同样,我们的初步研究表明,当SARS-COV S蛋白介导的SARS-COV S蛋白介导的同种性形成当ACE2的两个有效部位被修饰至天冬酰胺时(补充信息).
许多抗体、肽和小化合物已被证明与ACE2结合(参考文献29.,30.).其中一些可以通过阻断S蛋白结合位点或通过诱导不利于结合或融合的ACE2中的构象来治疗SARS。或者,可溶性形式的受体本身可以在感染的个体中减缓病毒复制。作为SARS-COV受体的鉴定ACE2将促进S蛋白的受体结合结构域的描述,这可能是S1-蛋白基亚基疫苗的最有效的靶表位。此外,可能批准用于疫苗生产和允许ACE2表达的病毒复制允许的细胞系是全部杀死或减毒病毒的最有效的大规模生产商,以用作疫苗。人类的小鼠转基因ACE2可以用作SARS的动物模型。最后,研究SARS-COV S蛋白和其他动物ACE2之间的相互作用可以为病毒的起源提供见解。因此,如果SARS作为对人体健康的威胁归还,则这些研究可能有助于其控制。
方法
免疫沉淀和验证ACE2
用[35.S]半胱氨酸和[35.每100毫米培养皿中溶解1.5毫升的0.3%的蛋氨酸n-decyl-β-d-麦芽糖苷(DDM, Anatrace)在含蛋白酶抑制剂鸡尾酒(Sigma和Roche)和0.2 mM苯甲基磺酰氟(Sigma)的磷酸盐缓冲盐水(PBS)中。离心去除细胞碎片后,裂解液与2.5µg纯化的S1-Ig或人干扰素-α受体2 (IFNAR2) -Ig融合构建物和蛋白A Sepharose在室温下孵育1 h。或者,S1结构域的c -末端c9标记形式(S1 - c9)或对照蛋白(HIV-1 gp120-C9和IFNAR2-C9)与抗体1D4(国家细胞培养中心)与蛋白A Sepharose一起孵育。沉淀用0.3% DDM/PBS洗涤两次,单独用PBS洗涤一次。结合蛋白在55℃的还原Laemmli样品缓冲液中或在37℃的非还原缓冲液中洗脱10分钟。蛋白在8%三甘氨酸凝胶(Invitrogen)上用sds -聚丙烯酰胺凝胶电泳(PAGE)分离。使用这种方法大约是5 × 107未标记的Vero E6细胞用于产生一条不同的110条带 可通过考马斯染色观察到的kDa。从凝胶中切下该条带并与胰蛋白酶孵育,并通过基质辅助激光解吸电离飞行时间质谱测定胰蛋白酶片段的质量。使用Sequest软件将质量与GenBank数据库中可能的蛋白质胰蛋白酶片段进行比较。
Vero E6和293T细胞受体表达测定
编码CD5的信号序列的质粒和SARS-COV S蛋白(残基12-672)的S1结构域的融合,或该结构域(12-327)的第一个316个残基,与人IgG1的Fc区(将S1-Ig和S1(327)-Ig分别转染到293t细胞中,并在蛋白质A琼脂糖珠粒上纯化免疫球蛋白融合蛋白。总共5×105用15μgmL将用ACE2表达或对照质粒转染的293T细胞或相同数量的未转化的Vero E6细胞孵育-1在100µl的体积中加入S1 -Ig或S1(327) -Ig。在某些情况下,15µg ml-1也包括ACE1或ACE2的可溶性形式(R&D Systems)。细胞在含0.5% BSA和0.1% NaN的PBS中洗涤3.,与fitc标记的山羊抗人IgG Fc (Sigma)孵育,流式细胞仪分析。
合胞体形成
293T细胞在六孔板上融合约50%,用磷酸钙法转染,质粒编码SARS-CoV S蛋白或HIV-1包膜糖蛋白gp160 (ADA分离物)的密码子优化形式。同时,293T或HeLa细胞被编码ACE2或HIV-1受体CD4和CCR5的质粒转染。转染一天后,将细胞胰酶化,表达病毒包膜蛋白的细胞与表达受体的细胞按1:1比例混合,并置于12孔或24孔板上。混合后24-48小时,观察到多核巨细胞。有时10µg ml-1在细胞混合时添加山羊抗ACE2抗体或山羊抗ACE1抗体(研发系统)。
模拟和ACE2转染293T细胞的感染
由L. Anderson(美国疾病控制与预防中心)提供的sars冠状病毒(Urbani株)在Vero E6细胞上传代。293T细胞转染25cm2单独使用pcDNA3.1或表达ACE2的pcDNA3.1的烧瓶感染1小时 h带1.4×103.TCID50.(50%组织培养感染剂量),通过终点滴定法在Vero E6细胞上测量,或保持未感染,并在培养基中洗涤两次。监测细胞病变效应4天。收集0、48和96份细胞上清液 清洗后h。使用病毒RNA迷你制备试剂盒(Qiagen)回收RNA。半定量RT-PCR使用如ref所述的嵌套方案进行。11..阳性对照RNA由C. Drosten (Bernhard Nocht Institute for Tropical Medicine, National Reference Center for Tropical Diseases)提供。病毒滴定采用播种5 × 103.感染前1天,在96孔微量滴定板中每孔Vero E6细胞。将感染的293T细胞的培养上清液以一式三份的形式添加到第一组孔中,并连续稀释。感染Vero E6细胞3天后,对细胞进行CPE监测。通过读取492处的吸光度,测定亲和纯化的山羊抗-ACE1或-ACE2抗体对SARS-CoV诱导的细胞病变的影响 用细胞滴度96(Promega)孵育的细胞的nm。
参考文献
- 1
冠状病毒在病毒进入和发病机制中的峰值蛋白。病毒学279., 371–374 (2001)
- 2
Holmes,K.V.SARS相关冠状病毒。心血管病。j .地中海。348.1948 - 1951 (2003)
- 3.
Donoghue, M.等。一种新的血管紧张素转换酶相关羧肽酶(ACE2)将血管紧张素I转化为血管紧张素1-9。约。87,E1–E9(2000年)
- 4
Tipnis, S. R.等。血管紧张素转换酶的人类同源物。卡托普利不敏感羧肽酶的克隆和功能表达。生物。化学。275., 33238–33243 (2000)
- 5
Holmes,K.V.等人。冠状病毒受体特异性。高级实验医学生物学。342.,261-266(1993)
- 6
Dveksler,G.S.等。小鼠癌胚抗原相关糖蛋白家族的几个成员是冠状病毒小鼠肝炎病毒A59的功能受体。j .性研究。67.,1-8(1993)
- 7
Delmas,B.等人。氨肽酶N是肠致病性冠状病毒TGEV的主要受体。自然357.417 - 420 (1992)
- 8
猫氨肽酶N是所有I组冠状病毒的受体。高级实验医学生物学。44069 - 75 (1998)
- 9
叶格尔,C. L.等。人氨基肽酶N是人冠状病毒229E的受体。自然357.,420-422(1992)
- 10.
Ksiazek, T. G.等。一种与严重急性呼吸综合征相关的新型冠状病毒。心血管病。j .地中海。348., 1953–1966 (2003)
- 11.
Drosten,C.等人。重症急性呼吸综合征患者新型冠状病毒的鉴定。心血管病。j .地中海。348., 1967–1976 (2003)
- 12.
Kuiken,T.等人。新发现的冠状病毒是严重急性呼吸综合征的主要病因。柳叶刀362.263 - 270 (2003)
- 13.
Fouchier, R. A.等。病原学:科赫的假设满足SARS病毒。自然423,240(2003)
- 14.
等。一种与严重急性呼吸综合征相关的新型冠状病毒的特征。科学300,1394-1399(2003)
- 15.
Marra, m.a.等。sars相关冠状病毒的基因组序列。科学300, 1399–1404 (2003)
- 16.
Sturman, L. S. & Holmes, K. V.蛋白水解裂解MHV的peplomeric糖蛋白E2产生两个90K亚单位并激活细胞融合。高级实验医学生物学。17325 - 35 (1984)
- 17.
杰克伍德,M. W.等。传染性支气管炎病毒刺突糖蛋白裂解识别位点分析。禽女民。45.366 - 372 (2001)
- 18.
Spaan,W.,Cavanagh,D.和Horzinek,M.C.冠状病毒:结构和基因组表达。J. Gen.Virol。69.,2939-2952(1988年)
- 19.
Bonavia,A.,Zelus,B.D.,Wentworth,D. E.,Talbot,P.J.J.&Holmes,K。V.V。鉴定人冠状病毒HCOV-229E的穗糖蛋白的受体结合结构域。j .性研究。77,2530-2538(2003)
- 20.
Breslin,J. J.等人。人冠状病毒229E:受体结合结构域并通过可溶性受体在37℃下的中和。j .性研究。77,4435-4438(2003)
- 21.
小鼠冠状病毒刺突蛋白330个氨基酸末端的中和表位和受体结合位点的定位。j .性研究。68.5403 - 5410 (1994)
- 22.
小松等。小鼠血管紧张素转换酶相关羧肽酶(mACE2)的分子克隆、mRNA表达及染色体定位。DNA序列。13., 217–220 (2002)
- 23.
hamer, D., Gilbert, M., Borman, R. & Clark, K. L. ACE 2(一种新的血管紧张素转换酶同源物)的定量mRNA表达谱。费用。532,107-110(2002)
- 24.
Choe,H.等。β-趋化因子受体CCR3和CCR5促进原发性HIV-1分离株感染。细胞851135 - 1148 (1996)
- 25.
梁,W. K.等。严重急性呼吸综合征相关冠状病毒感染的肠道累及胃肠病学125.1011 - 1017 (2003)
- 26.
Crackower,M. A.等人。血管紧张素转换酶2是心脏功能的必要调节因子。自然417822 - 828 (2002)
- 27.
维克斯,C.等。人血管紧张素转化酶相关羧肽酶水解生物多肽。生物。化学。277.,14838-14843(2002)
- 28.
Delmas,B.等。传染性胃肠炎病毒受体相互作用的决定因素位于与酶位点不同的氨基肽酶-N结构域内。j .性研究。68.5216 - 5224 (1994)
- 29.
Huang,L.等。血管紧张素转换酶2的新型肽抑制剂。生物。化学。278.15532 - 15540 (2003)
- 30.
戴尔斯,n.a.等。基于底物的第一类血管紧张素转换酶相关羧肽酶(ACE2)抑制剂的设计。j。化学。Soc。124.,11852-11853(2002)
致谢
我们感谢J.Coderre进行RT-PCR,M. Kirk进行编辑,以及S. H. Wang,E.Kieff,J. Sodroski,C. Gerard和N.Gerard,用于指导和有用的对话。
作者信息
从属关系
通讯作者
伦理宣言
相互竞争的利益
作者宣称他们没有相互竞争的经济利益。
权利和权限
关于这篇文章
引用这篇文章
李,W.,Moore,M.,Vasilieva,N。et al。血管紧张素转换酶2是SARS冠状病毒的功能性受体。自然426年,450–454 (2003). https://doi.org/10.1038/nature02145
收到了:
接受:
发行日期:
进一步的阅读
SARS-CoV-2肺炎受体结合与肺免疫病理学:综述
急救护理(2021)
covid -19相关血栓栓塞并发症的影像学表现
埃及放射学和核医学杂志(2021)
天然产物为重症COVID-19的抗补体治疗提供了新视角:综述
中医(2021)
SARS-CoV-2:有神经侵犯吗?
CNS的液体和障碍物(2021)
Covid-19和癌症的交叉点:信号通路和治疗意义
分子癌(2021)