当前管理指南COVID-19反映假设危重患者感染SARS-CoV-2出现急性呼吸窘迫综合征(ARDS)。然而越来越多的新兴数据和临床报告表明另一种观点,即严重COVID-19反映了融合的血管功能障碍,血栓形成、炎症特异表达。
严重COVID-19有别于ARDS和cytokine-release综合症
公布的数据(1,2],坊间的观察和与同事的讨论表明,全球COVID-induced呼吸表型在几个方面是不同于典型的ARDS [2]。COVID-19患者出现深刻的血氧不足疾病早期在他们的课程。然而,公开在这些早期呼吸功能障碍是不寻常的。肺动脉插管COVID-19患者依从性似乎仅略有下降,因此病人相对容易通风(1]。Gattinoni et al。1)描述hyperperfusion通风不良的肺,也许由于血管舒张和缺氧性血管收缩的损失。而受益于低水平的窥视和容易定位已经指出的那样,这些作者认为他们比肺血液动力学的影响招聘结果1]。后来COVID-19过程中,一些患者出现表型更符合ARDS [1,2]。
的炎症反应报道COVID-19也不符合典型的ARDS或cytokine-release综合症(CRS)或“细胞因子风暴。“秦et al。3报告的意思是白细胞介素- 6水平25 (SD: 10 55) pg / mL(正常范围:7 pg / mL)。其他小COVID-19报道范围从7 - 125 pg / mL。这些发现与白细胞介素- 6海拔在典型ARDS和CRS。Sinha等人报告说282(111 - 600)的白细胞介素- 6水平pg / mL“hypoinflammatory”ARDS [9)和1618年(517 - 3205)pg / mL hyperinflammatory ARDS [4),10 - 60倍高于武汉数据报告。CRS患者,意思是白细胞介素- 6水平往往高达10000 pg / mL [5]。其他炎性细胞因子(例如,interleukin-8 interleukin-1β)展示类似的模式。总之,COVID-19只有轻微的炎症细胞因子海拔和相关演示了生理学和免疫学与ARDS或CRS很难协调。另一种机制因此疾病的可能。
血管病变和炎症在COVID-19特异表达
观察到的结合新兴病理生理学和证据都指向了血管疾病过程COVID-19发病机理中起作用的因素。肺分流与强烈的血管舒张和内皮功能障碍是一致的。观察,89%的住院病人在罗马显示subsegmental血管扩张他们的录取计算机断层扫描支持这一观点6]。的报道增加呼吸道死腔建议lung-vascular血栓形成血栓性微血管病或肺栓塞。后者最近被报道在40%的COVID-19住院患者(7]。在早期病人进行验尸报告确实是值得注意的lung-vascular拥堵(8]。血管疾病也可以解释大量的肺动脉栓塞海拔,antiphospholipid抗体在COVID-19[最近报告了9]。多系统器官参与的星座,轻度炎症,淋巴细胞减少,血凝过快,和异构微血管功能障碍是一个典型的描述许多系统性血管病变,如vasculitides(补充表)。
报告研究结果表明,免疫抑制内皮细胞激活,直接viral-mediated组织损伤,而不是hyperinflammatory受伤,调解COVID-induced器官功能障碍。例如,解剖最近的一项研究发现没有肾血管性或间质性炎症,但指出内皮激活,偶尔的弗兰克•坏死和大量的病毒粒子在肾组织(10]。如果直接感染硬盘损伤,维管组织预计将是高度敏感,因为它表达了血管紧张素转换酶2 (ACE-2),这对冠状病毒吸收是必不可少的。
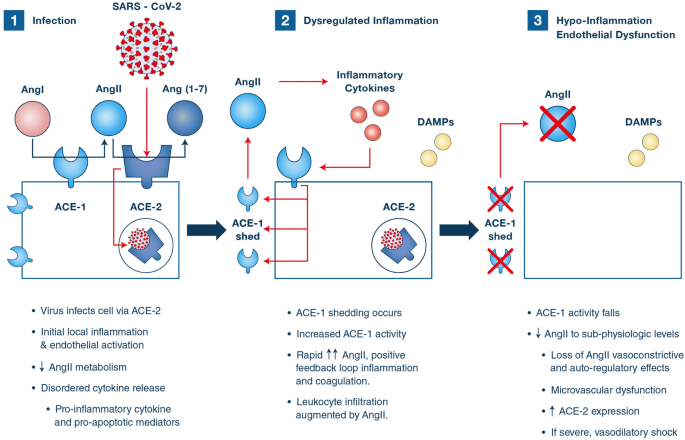
绑定ACE-2 SARS-CoV-2启动细胞感染的人类细胞的表面,包括内皮细胞(无花果。1)[11]。附件促进无序旁分泌细胞因子信号,包括支持和抗炎分子,pro-apoptotic介质(12]。Chemokine-mediated淋巴细胞招聘和随后的感染淋巴细胞,也表达ACE-2,可能导致淋巴细胞凋亡,自然杀伤细胞和B细胞抑制T细胞疲劳,注意到秦et al。3]。这些发现符合临床淋巴细胞减少,这与死亡率(3]。病毒损伤、无序细胞因子释放和有关分子模式(抑制)诱导局部微血管炎症,这引发内皮细胞激活,导致血管舒张和pro-thrombotic条件。
(1)SARS-CoV-2病毒感染的内皮细胞ACE-2绑定。细胞感染发起局部炎症,内皮激活,组织损伤,无序释放细胞因子。膜融合也中断AngII新陈代谢,导致AngII增加和减少和(1 - 7),增加炎症,内皮细胞激活,白细胞和血小板招聘。(2)肺动脉内皮细胞激活导致ACE-1脱落现象,ACE-1正迅速从细胞膜中解放出来。AngII这产生一个最初的迅速崛起,可以引起积极的反馈循环,增强局部炎症,凝固,毛细管泄漏。(3)是暂时性的增加ACE-1消散,导致subphysiologic AngII浓度。低AngII在这个阶段会导致血管舒张,恶化毛细管泄漏,受损的内皮电导和自动调整。低系统性AngII也上调ACE-2,可能增加易感性SARS-CoV-2在偏远的组织。血管,血管紧张素转换酶;安吉人,血管;AngII,血管紧张素ⅱ;和(1 - 7),血管紧张素(1 - 7);抑制,有关分子模式分子
血管紧张素ⅱ(AngII)主要是由内皮ACE-2常和代谢的抗炎肽血管紧张素(1 - 7)。在感染的早期阶段,ACE-2消费由病毒条目将预测当地AngII浓度增加。在已知的AngII血管收缩,影响内皮细胞激活和释放促炎细胞因子。血小板激活的AngII可能进一步加强pro-thrombotic环境。AngII还有强有力的趋化现象的影响,可能会加速淋巴细胞招聘和抑制。重要的是,承认AngII水平COVID-19病人据说是正常水平的两倍(13]。此外,肺血管炎症具体导致这种现象称为ACE-1“脱落”,内皮表面束缚ACE-1释放到间质(14]。这种现象最初产生急剧增加,当地AngII逐渐减少,直到浓度远低于生理水平(14]。因为AngII会使ACE-2表达式,过渡到状态AngII缺乏符合增加ACE-2表达式指出尸检[10]。值得注意的是,据说AngII增加微血管基底条件下渗透率但在炎症,降低渗透率的影响归因于inflammation-induced转变从1型,2型受体表达15]。
对治疗和研究的影响
假定COVID-19血管和hypoinflammatory疾病为正在进行的研究有重要意义。然而,还需要更多的证据来探讨血管损伤生物标志物,成像和组织学。如果COVID-19确实主要是血管疾病,早期侵入性机械通气应该开始谨慎。调查应该检查自由与限制的影响侵入性机械通气策略。
我们重申,没有证据表明COVID-19病人发展“细胞因子风暴。“这一发现表明,使用cytokine-blockade代理应该会见怀疑没有随机的证据。然而,抗凝应该是一个关键的优先事项的调查。同样,鉴于AngII缺乏公认的作用,血管紧张素ⅱ的随机试验治疗COVID-19休克病人的进展是必要的。疾病进展也可能影响改性剂,抗炎和血管紧张素的潜在益处封锁在之后的时间点早在关键的疾病和伤害。
结论
COVID-induced呼吸衰竭包括生理、临床和免疫表型不一致或ARDS cytokine-release综合症。COVID-19反映了免疫抑制和特征与血管疾病相一致。
引用
Gattinoni L,科波拉,Cressoni M, Busana M, Chiumello D (2020) Covid-19不会导致一个“典型”的急性呼吸窘迫综合征。J和保健。https://doi.org/10.1164/rccm.202003 - 0817勒
Gattinoni L, Chiumello D, Caironi P et al (2020) COVID-19肺炎:不同的呼吸治疗不同的表型?重症监护医学。https://doi.org/10.1007/s00134 - 020 - 06033 - 2
周秦C、L时,胡锦涛Z et al(2020)失调患者的免疫反应的COVID-19在武汉,中国。中国感染说。https://doi.org/10.1093/cid/ciaa248
阿,Sinha P卢基KL McAuley DF 'Kane厘米,Matthay MA Calfee CS(2020)简洁的算法的开发和验证分类急性呼吸窘迫综合征表型:随机对照试验的二次分析。柳叶刀和地中海8 (3):247 - 257
莫德SL,弗雷N,肖PA et al(2014)嵌合抗原受体T细胞白血病的持续缓解。郑传经地中海371 (16):1507 - 1517
卡鲁索D, Zerunian M, Polici M et al(2020)胸部CT特征COVID-19在罗马,意大利。放射学。https://doi.org/10.1148/radiol.2020201237
陈J、王X,张年代et al(2020)发现COVID-19患者急性肺栓塞(3/1/2020)。SSRN
田,胡锦涛W,妞妞L,刘H,徐H,肖SY 2019年早期阶段(2020)肺部病理学新型冠状病毒(COVID-19)在两个肺癌患者肺炎。J Thorac杂志。https://doi.org/10.1016/j.jtho.2020.02.010
肖张Y, M,张年代et al(2020)在Covid-19患者抗磷脂抗体抗体及严重性凝血障碍。郑传经地中海J。https://doi.org/10.1056/NEJMc2007575
苏H,杨M, Wan C et al(2020)肾组织病理学分析26中国COVID-19患者的尸检结果。肾脏Int。https://doi.org/10.1016/j.kint.2020.04.003
刘Z,魏小X, X et al(2020)的组成和散度冠状病毒高峰和主机ACE2受体蛋白质预测潜在的SARS-CoV-2中间宿主。J地中海。https://doi.org/10.1002/jmv.25726
菲尔AR,帕尔曼年代(2015)冠状病毒:概述他们的复制和发病机理。方法1282:1-23杂志
杨刘Y, Y,张C et al (2020) 2019 - ncov感染患者临床和生化指标与病毒载量和肺损伤。Sci中国人寿Sci 63 (3): 364 - 374
Nukiwa T,松岗R,高木涉H, Ishii Y, Arai T,基拉年代(1982)血清和肺血管紧张素转换酶活动的反应的早期阶段在犬油酸引起的肺损伤。我和牧师说126(6):1080 - 1086吗
Ereso AQ,拉米雷斯RM, Sadjadi J et al(2007)血管紧张素ⅱ2型受体提供了内生制动期间inflammation-induced微血管流体泄漏。J是科尔杂志205 (4):527 - 533
作者信息
从属关系
相应的作者
道德声明
的利益冲突
毫升收到法国卫生部科研基金研究支持从Shingotec演讲费从巴克斯特和费森尤斯公司和诺华公司的咨询费。其他作者没有利益冲突。
额外的信息
出版商的注意
施普林格自然保持中立在发表关于司法主权地图和所属机构。
电子辅料
下面是链接到电子辅料。
权利和权限
关于这篇文章
引用这篇文章
Leisman, D.E.,Deutschman, C.S. & Legrand, M. Facing COVID-19 in the ICU: vascular dysfunction, thrombosis, and dysregulated inflammation.重症监护医学46岁,1105 - 1108 (2020)。https://doi.org/10.1007/s00134 - 020 - 06059 - 6
收到了:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1007/s00134 - 020 - 06059 - 6