抽象
目的
选择性消化微生物净化(SDD)被假设为通过抑制来自结肠的革兰氏阴性潜在病原体而不影响厌氧肠道菌群,从而使重症监护(ICU)患者受益。本研究的目的是通过一项前瞻性临床试验,收集ICU患者的粪便样本进行肠道菌群分析,以进一步了解消化道和口咽部去污对肠道菌群的影响。
方法
收集来自ICU患者的粪便样本,进行多中心试验,研究SDD和选择性口腔去污(SOD)的效果,并与标准护理(SC)进行比较。采用荧光原位杂交技术(FISH)对粪便微生物区系进行分析。比较三种方案中不同菌群的菌数。
结果
每克粪便中细菌总数计数未方案有所不同。该F. prausnitzii组细菌,表示肠道微生物群中的重要基团,是在SDD方案相比,SC和SOD显著降低。该肠杆菌科SDD相比,无论SOD和SC期间显著抑制;肠球菌在SDD增加相比,无论其他方案。
结论
肠道微生物群的组成由重要SDD影响。该F. prausnitzii组SDD期间显著抑制。这一组微生物群是丁酸的主要生产者,对于结肠细胞的主要能量来源。该菌群的减少是一个重要的权衡,同时通过减少SDD革兰氏阴性菌。
介绍
消化道(SDD),采用免疫能力受损的动物模型开发的选择性(微生物)去污1,2],首先在临床上严重免疫妥协造血 - 肿瘤患者进行测试和后来施加到送进重症监护病房(ICU)的患者[3]。SDD的概念是选择性地抑制潜在的病原体,主要是革兰氏阴性菌,而不干扰厌氧肠道菌群。在头四天,口服不可吸收的抗生素与预防性的全身抗菌治疗(第三代头孢菌素)相结合,以根除潜在的病原体。为了保护厌氧菌群,不鼓励使用具有抗厌氧活性的抗生素。
早期研究是由设计缺陷[3或者缺乏统计能力来发现生存优势。荟萃分析显示了显著的生存优势[4,五]一个没有[6]。还单中心随机试验评价SDD显示死亡率降低[7,8]。
整个研究在ICU评估SDD的一致结果已经院内感染,尤其是呼吸道的发作次数的减少。作为预防呼吸机相关性肺炎(VAP)可能会起到降低死亡率SDD,SDD的口咽成分的称为选择性口咽去污(SOD)的主导作用,也已在临床试验中[分析9]。虽然VAP一个显著减少是由SOD [显示在死亡率,在历史上没有整体降低10]或非选择性口腔去污[11] 被观测到。
最近有报道SOD和SDD的大型多中心临床试验。在该试验中都SDD和SOD显示了相似的存活益处相比标准护理(SC)[12]。作为本研究的辅助,我们研究了SOD和SDD对肠道菌群的影响,并与SC进行了比较。
肠道微生物群是一个复杂的生态系统,其包括超过10个11每克粪便的细菌和超过400种不同的[13]。一些肠道菌群是有益的,如何促进他们的成长进行了研究[14]。随着SDD的使用,肠道微生物群被认为可以通过防止潜在病原体的增加定植来保护人类宿主[15],大多是厌氧细菌是难以分离和通过经典培养技术鉴定。基于培养的方法厌氧微生物群的定量是不可靠的:选择性培养基引入偏见;和许多属不能在体外培养。分子的方法,例如原位杂交(FISH)的荧光,收率微生物绝对数[16,17代替集落形成单位,其是定量读出培养的。
在本研究中,我们评估,首次用分子生物学方法,SDD和SOD对肠道菌群的影响相比,住进ICU科SC。我们测试的SDD(或SOD)可以通过离开厌氧肠道菌群的影响执行其声称的有益作用的假设。
患者和方法
所有患者连续住进了内科ICU在我们医院,和荷兰多中心SDD-SOD研究的框架内被评价[12],均符合要求。在这种SDD-SOD研究,参与中心的人跟着他们在非盲随机序列加护病房治疗的三种不同的方案:
- 1.
SC:没有预防性抗微生物剂,在使用抗生素没有限制
- 2.
SOD:预防性外用抗生素口咽,在使用抗生素没有限制。
- 3。
SDD:预防局部口咽部和肠道抗菌剂,在与前四天加静脉注射头孢噻肟。选择性使用抗生素的鼓励,以避免干扰与肠道菌群,按照定植抗力的概念。
这些课程分配给我们医院的顺序是SC-SOD-SDD。有关试验和使用抗生素方案的详情,请参阅原文[12]。所有列入患者均拿下他们与APACHE II分类系统疾病的严重程度[18]。据记载,其他的参数是人口统计(年龄,性别等),伴发疾病和使用的所有抗菌产品,包括用于预防协议(SOD和SDD)的抗菌剂。
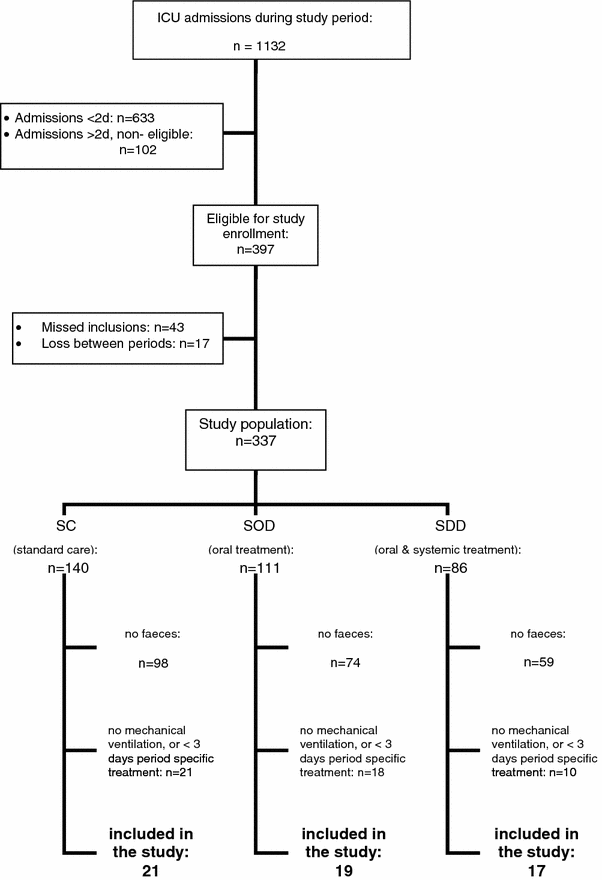
在所有三个连续试用期,粪便样品从所产生的粪便自发地或与使用泻药作为单独临床适应症的患者采集。对于每一个患者,为了仅使用,是由机械通气患者的时期特异性治疗的至少三天后通过了第一样本粪便,以避免数据的偏斜(参见图1)。
对于多中心SOD-SDD研究,从知情同意放弃由地方和国家伦理审查委员会提供的,因为不是病人,而是不同的标准治疗方案的随机的方式进行比较。样品和资料进行分析匿名。
材料和方法
所有的新鲜粪便样品储存在冰箱中和收集后24小时内处理用于分析。的处理过程如下:在均化后,从各粪便样品将1.0克(湿重)的一部分取出并且在PBS中稀释(8克/升的NaCl,0.2g / L的氯化钾,1.44克/升的Na2HPO4·2H2O,0.24克/ L KH2阿宝4,pH 7.4)中1:4或1:9根据粪便稠度。粪便稠度缩放的布里斯托尔粪便图表,其中粪便型1-6的稠度稀释1:9,类型7稀释1:4。如先前所描述。这些稀释液进行存储处理[19]。
粪便样品中的细菌,1cm的多张幻灯片的量化2如前所述,制备细胞计数和杂交孔[19]。杂交使用表中所列的16S rRNA靶向探针进行1。
这些探头由Eurogentec公司(比利时Seraing)制造。这些探针总共检测了大约90%的混合致病菌总数(Eub338) [17]。附加到用于检测的正常肠道菌群的探针组,三个探针被用于枚举的潜在病原体的基团。这些都是EC1531 [20.]探测的肠杆菌科Enfl84和Enfm93 [21]以检测肠球菌。
样品中的荧光细胞利用自动化显微镜系统[计计数22]。与此方法中使用的检出限为106细胞/ g的粪便。
结果表明,某型菌株对SDD/SOD抗生素的最低抑菌浓度为MICF. prausnitzii进行。在A2-165应变F. prausnitzii在上YCFA琼脂板厌氧柜中培养。YCFA培养基由(每100毫升)将1g酪胨,0.25g克酵母提取物,0.4克碳酸氢钠3,将0.1g半胱氨酸,0.045克ķ2HPO4,0.045克KH2阿宝4,0.09克氯化钠,0.009克硫酸镁4.7H2O,0.009克氯化钙2,0.1毫克刃天青,1个毫克氯高铁血红素,1个微克生物素,1个微克钴胺素,3微克p氨基苯甲酸,5微克叶酸和15微克吡哆胺。的短链脂肪酸(SCFA)在培养基中的终浓度分别为33 mM乙酸盐,9毫丙酸酯和每个异丁戊酸和戊酸盐的1毫米。
的MIC测试使用E-test®-strips含有妥布霉素,粘菌素和头孢噻肟,根据制造商的(AB Biodisk公司,索尔纳,瑞典)中的说明进行。
统计
结果采用SPSS三个病人群体之间的统计比较®16统计分析软件。对于连续变量年龄和apache评分进行方差分析,对于名义变量如抗生素使用,使用卡方交叉表与Fisher’s确切检验(见表)2详情)。
细菌数量的分析采用对数变换后的方差分析得到正态分布。正态分布通过Kolmogorov-Smirnoff试验和P-P作图的评价进行检验。
肠球菌的数量却仍然无法正常登录,改造后的分布,因此对于非参数检验(MWU)进行这些细菌群。
结果
患者:图1示出了患者样本选择的流程图。粪便样品收集从共21名患者在SC方案中,19名患者在SOD方案和17名患者在SDD方案分析。
患者的年龄分布并不三项学习发作之间显著不同;SC组,平均年龄为59.8,超氧化物歧化酶组63.7中和SDD组56.7英寸
APACHE-II评分均还组之间是相似:14.3,15.4和16.2分别用于SC,SOD和SDD基团,。Apache的预测(调整后)死亡率在SOD和SDD方案组双双走高。这些差异无统计学显著。此外肠内管饲和胃滞留没有三个方案组之间有统计学显著不同,见表2了解详情。
除了使用头孢菌素(其是SDD方案的一部分)使用抗生素没有的方案之间显著不同的。因为在人口特征差异无统计学发现,未进行进一步的多变量分析。
没有观察到对结肠菌群的细菌总数SDD的无显著影响(表3)。然而,有在不同方案的微生物群的组成的显著差异。有些差异是出现在分析方案之间的细菌群,但对数字F. prausnitzii在SDD-方案组被显著下相比,无论标准护理和SOD方案。该真杆菌rectale组显示出较低的细菌的数目在比SC方案的SDD方案。的一个子群E. rectale-The罗斯氏肠基还显示出较低的SDD方案编号。
SDD对与它的目标是在粪便菌群潜在革兰氏阴性病原体计数一个显著的影响。肠杆菌科与sc组和sod组相比,SDD组的数量明显减少。
革兰氏阳性潜在病原体如肠球菌与使用SDD的显著增加,在与两个其他方案比较(表4)。在一个显著上升粪肠球菌也被视为在SOD方案相比,SC方案。然而,数粪大肠在SOD方案仍然显著比较的数字时低于粪大肠在SDD方案。
的MIC值F. prausnitziiA2-165用于SDD / SOD抗生素分别为4微克/毫升为妥布霉素,> 32微克/ ml的头孢噻肟和> 256微克/毫升为粘菌素。
讨论
本研究的主要发现是,粪便分析证明,使用SDD会影响肠道菌群的组成:TheF. prausnitzii组相比,在两个其他方案的受试者在数量显著减少在接收SDD受试者的粪便。与SDD的假设,这一发现对比的是厌氧微生物不会受到影响[15]。
fprau探针检测到的菌群是健康志愿者体内的主要菌群之一,平均占肠道菌群的10-15% [17,23]。该F. prausnitzii因此,集团对维持定植抗力,一般保护人类宿主免受感染中起重要作用。F. prausnitzii还发现有可能在克罗恩病的发生发展中起主导作用的抗炎作用[24]。
此外,F. prausnitzii由于其主要发酵产物丁酸盐[23,25]。丁酸是短链脂肪酸是能量为结肠细胞的主要来源[26]。此外,丁酸盐促进结肠细胞的生长,防止粘膜萎缩。这似乎也降低结肠恶变的动物模型中的风险[27]。在体内,丁酸盐的最佳浓度尚不清楚,但在体外细胞培养中,丁酸盐浓度低于10mm时生长停滞[26]。在健康志愿者中,丁酸盐浓度也管饲期间减少[28],并且在这些粪便样品的盲重新分析,减少F. prausnitzii用丁这些粪便样品中测得的还原显示出很强的相关性(手稿提交)。
该F. prausnitzii细菌的-group难以在体外培养和SDD时首先被开发。因此,无法检测到。只有基于培养的方法被用来驴的肠道菌群是否留在SDD初期完好。因此,这种意想不到的效果不能预见,当第一次使用的方案。的SDD / SOD抗生素示出了MIC分析该F. prausnitzii仅容易在4至妥布霉素微克/毫升。妥布霉素的集中很容易与SDD的肠道净化方案达成。减少F. prausnitzii因此最有可能的妥布霉素在SDD-方案组肠道给药引起的。
我们表示损失F. prausnitzii通过增加其他重要丁酸生产菌,不补偿。Roseburia属,丁酸生产菌的另一组重要的,也存在于显著较低的数字时相比,SC方案中SDD方案。相似F. prausnitzii,减少从细菌的数量Roseburia属。关联到在其中产生的丁酸的量的减少[29]。因此,我们推测SDD患者的丁酸盐生产可能由于这些主要的丁酸盐产生菌群的丢失而受损。
明确的证据表明SDD方案根据方案给定的事实是,在一个显著减少肠杆菌科相比于其他两种方案的SDD方案被发现。数肠杆菌科在SC和SOD方案均显着高于健康人[高17]。
传统上,头孢噻肟一直是SDD方案的一个组份[8,12,三十]。尽管头孢噻肟已被证明对肠杆菌科[适中的抑制作用31,32],我们有理由相信,相比的大量的非吸收性抗生素的作用专门针对头孢噻肟的影响可忽略不计肠杆菌科。
头孢噻肟的消除几乎完全是通过肾脏排泄;只有5%的排除法是通过胆汁排泄,到达结肠的头孢噻肟的量与不可吸收的妥布霉素和粘菌素相比是极低的,这两种物质都有抗排除法的活性肠杆菌科。早期研究表明头孢噻肟几乎完全被粪便酶灭活[33]。这不是粘菌素和妥布霉素,这使得它最有可能看到的效果是由这些抗生素引起的,而不是这种情况。此外的头孢噻肟的对肠道微生物群的影响的早期研究是基于培养用选择性平板方法。尤其是使用抗生素的情况下,这些方法可导致细菌的实际数的低估。
第二个重要的发现是,SOD留下的粪便菌群相对未受影响相比,大便患者在研究的SC时期就读。如图所示,在多中心临床试验[12],有在SDD和SOD之间死亡率无显著差异,尽管定植和感染用肠杆菌科在SDD被显著相比减少SOD。这种减少的肠杆菌科在我们的研究中得到了证实。我们推测,没有进一步降低死亡率的部分原因是SDD对结肠微生物群有益菌群的负面影响。这些有益细菌为结肠细胞提供了重要的营养来源,它们的损失如何转化为临床显著影响,尤其是在危重病人中,目前尚不清楚。也许应该在动物模型中研究微生物群的作用,特别是丁酸盐的产生和摄入,以在包括脓毒症重症监护在内的一系列条件下维持结肠的完整性。
双歧杆菌显示,在SDD方案没有达到统计学显着性轻度增加。这些革兰氏阳性菌不容易在SDD中使用的抗生素。
与使用SDD的第三考虑是肠球菌的在粪便中的增加[34]。尽管粪大肠SOD方案也明显高于SC方案,SDD方案的肠球菌数量比其他两种方案高一个数量级。历史上已知,肠球菌在使用局部抗生素的情况下,数目会增加[35],因为这些革兰氏阳性细菌是到SDD-抗生素天然抗性。此外,革兰氏阴性肠道细菌通过刺激TLR4 [诱导抗微生物肽,REG3G,在肠细胞的腔表面36],对肠球菌的生长有限制作用。革兰氏阴性菌的消除导致Reg3g减少,随后肠球菌在小鼠模型中增加并移位[36]。
肠球菌被认为是无害的,当SDD在ICU中首次引入,并没有一个包括患者肠球菌血流感染。然而,我们都知道,肠球菌造成严重院内感染,容易传播,并获取增加抗生素耐药[37,38]。肠球菌是心内膜炎的第三大原因,和医院获得与预后不良相关联39,40]。此外,抗生素抗性基因转移已被证明在体内和肠球菌其它细菌物种[之间41]。
限制这项研究是病人和样本数量有限。另外,通过本研究的设计,可以得到没有基线样品也不可以在采样的定时被标准化,因为所有的样品自发产生。基于在表中提供的数据2我们认为,这并没有引起偏见的主要来源。
结论
我们发现重症监护病房患者粪便菌群的细菌总数不受SDD的显著影响。肠杆菌科在比SC和SOD方案的SDD方案在数量显著回落,符合市场预期。
SDD确实对厌氧菌群的组成有显著影响;的数量F. prausnitzii-与SC和SOD组相比,SDD组细菌明显减少。细菌来自肠球菌与SC组和SOD组相比,SDD组的数量明显增多。其他组的细菌也有一些变化,但在其他两种方案中都不显著。
SDD只通过减少而明确有益的假设肠杆菌科在不影响结肠微生物群的情况下,必须将其排出体外。
参考文献
-
1.
范德瓦Waaij d,Berghuis-德弗里斯JM,Lekkerkerk-范德Wees JE(1971)中常规和抗生素治疗的小鼠消化道的定植抗力。Ĵ潮霉素(林斯顿)69:405-411
-
2.
范德瓦Waaij d(1992)识别与消化道作一介绍选择性胃肠去污定植抗力的测定史。流行病学杂志传染109:315-326
-
3。
Stoutenbeek CP,面包车Saene HK,米兰达DR,Zandstra DF(1984)在多发伤患者定植和感染速率选择性消化道去污的影响。重症监护医学杂志10:185-192
-
4。
D’amico R, Pifferi S, Leonetti C, Torri V, Tinazzi A, Liberati A(1998)成人重症患者抗生素预防的有效性:随机对照试验的系统回顾。BMJ 316:1275 - 1285
-
5。
Liberati A, D 'Amico R, Pifferi, Torri V, Brazzi L(2004)在接受重症监护的成年人中,抗生素预防可减少呼吸道感染和死亡率。Cochrane数据库Syst Rev (CD000022)
-
6。
范登布鲁克 - Grauls CM,范登布鲁克JP(1991)上呼吸道感染和死亡率在重症监护病房的选择性消化道去污效果。柳叶刀338:859-862
-
7。
克鲁格WA,伦哈特FP,Neeser G,Ruckdeschel G,Schreckhase H,Eissner HJ,福斯特H,埃卡特克莱Ĵ,彼得K,Unertl KE(2002)合并静脉内和局部应用的抗生素预防对感染,器官功能障碍的发生率的影响,并且死亡率危重手术病人的前瞻性,分层,随机,双盲,安慰剂对照的临床试验。牛J和呼吸暴击护理医学杂志166:1029-1037
-
8。
de Jonge E, Schultz MJ, Spanjaard L, Bossuyt PM, Vroom MB, Dankert J, Kesecioglu J(2003)消化道选择性去污对重症监护中耐药菌死亡和获取的影响:一项随机对照试验。柳叶刀362:1011 - 1016
-
9。
Bergmans DC, Bonten MJ, Gaillard CA, Paling JC, van der Geest S, van Tiel FH, Beysens AJ, de Leeuw PW, Stobberingh EE(2001)口服去污预防呼吸机相关肺炎:一项前瞻性、随机、双盲、安慰剂对照研究。我的呼吸急救医学164:382-388
-
10.
Liberati A,达米科R,Pifferi S,托里V,Brazzi L,Gensini积分GF,Gusinu R(2006)抗生素预防,以防止病人院内感染重症监护病房:证据斗争说服执业医师。实习生Emerg(紧急)医学1:160-162
-
11.
科曼男,范德法师AJ,陈克勤E,Joore HC,Kaasjager K,迪斯AG,拉姆齐G,Dormans TP,AARTS LP,去倍儿EE,Hustinx WN,范德炉闸门我,Hoepelman AM,Bonten MJ(2006)用洗必泰口腔去污减少呼吸机相关性肺炎的发生率。牛J和呼吸暴击护理医学173:1348年至1355年
-
12.
迪斯梅特AM,Kluytmans JA,库珀BS,Mascini EM,Benus RF,范德华WERF TS,范德胡芬JG,Pickkers P,Bogaers-霍夫曼d,范德华米尔NJ,Bernards旅馆AT,Kuijper EJ,Joore JC,Leverstein-面包车霍尔MA,Bindels AJ,Jansz AR,韦塞林克RM,德Jongh BM,Dennesen PJ,面包车Asselt GJ,TE维尔德LF,Frenay 1H,Kaasjager K,博世FH,面包车Iterson男,Thijsen SF,克鲁格GH,Pauw的W,德弗里斯JW,卡安JA,ARENDS JP,AARTS LP,斯特姆PD,Harinck HI,沃斯A,Uijtendaal EV,勃洛克HE卷,Thieme格莱恩ES,Pouw ME,Kalkman CJ,Bonten MJ(2009)的消化道和口咽的去污在ICU的患者。新英格兰医学杂志360:20-31
-
13.
VANHOUTTE T,Huys酒店G,通过使用通用的和特定组的16S rRNA基因的引物变性梯度凝胶电泳在人类粪便微生物群的去勃兰特E,秋千Ĵ(2004)时间稳定性分析。FEMS微生物ECOL 48:437-446
-
14。
吉布森GR,Roberfroid MB(1995)的人结肠菌群的膳食调制:将益生元的概念。Ĵ营养学125:1401-1412
-
15。
范德瓦Waaij d,曼森WL,ARENDS JP,德弗里斯-霍斯珀斯HG(1990)临床使用选择性去污:概念。重症监护医学16(增刊3):S212-S216
-
16。
Harmsen HJ,吉布森GR,Elfferich P,Raangs GC,wildeboer的-Veloo AC,Argaiz A,Roberfroid MB,威灵GW(2000)的活细胞计数,并使用特定的荧光原位杂交比较rRNA基因为基础的探针人类粪便的量化菌。FEMS微生物学快报183:125-129
-
17。
哈马森HJ, Raangs GC, He T, Degener JE, Welling GW(2002)基于16S rrna的广泛的人类粪便细菌检测探针。应用环境微生物学68:2982-2990
-
18。
诺斯WA,Draper的EA,瓦格纳DP,齐默尔曼JE(1985)APACHE II:疾病分类系统的严重程度。暴击护理医学杂志13:818-829
-
19。
直率AH,Harmsen HJ,Raangs GC,詹森GJ,SCHUT女,威灵GW(1998)中通过荧光原位杂交与特定组的16S rRNA靶向寡核苷酸探针测定人类粪便细菌群体的变化。应用环境微生物学64:3336-3345
-
20。
波尔森LK,兰女,Kristensen的CS,Hobolth P,莫林S,Krogfelt KA(1994)在原位杂交从rRNA基因推导出的鼠标大肠大肠杆菌的空间分布。感染免疫62:5191-5194
-
21。
Waar K,德格纳JE,面包车Luyn MJ,Harmsen HJ(2005)荧光结合特定DNA探针提供足够的检测的原位杂交粪肠球菌和屎肠球菌临床样本英寸医学杂志微生物学54:937-944
-
22.
Jansen GJ, Wildeboer-Veloo AC, Tonk RH, Franks AH, Welling GW(1999)一种自动的、基于显微镜的肠道细菌计数方法的开发和验证。微生物学方法37:215-221
-
23.
索阿、罗切特V、斯吉尔A、格拉梅特G、布雷威伊斯S、苏特林M、里戈特蒂尔-戈瓦勒L、多尔J (2001)梭菌属prausnitzii和相关品种代表了人类粪便菌群中的优势群体。SYST应用微生物学24:139-145
-
24.
索科尔H,Pigneur B,Watterlot L,Lakhdari O,贝穆德斯-HumaránLG,Gratadoux JJ,Blugeon S,Bridonneau C,孚雷JP,Corthier G,Grangette酒店C,Vasquez的N,Pochart P,Trugnan G,托马斯G,BlottièreHM,金锭Ĵ,MARTEAU P,Seksik P,兰杰拉P(2008)Faecalibacterium prausnitzii是克罗恩病的患者的肠道菌群的分析,鉴定抗炎共生菌。国家科学院院刊USA 105:16731-16736
-
25.
Duncan SH, Hold GL, Harmsen HJ, Stewart CS, Flint HJ(2002)的生长要求和发酵产物梭菌属prausnitzii,并提议重新分类它作为Faecalibacterium prausnitzii根。十一月,梳子。十一月诠释J SYST EVOL微生物学52:2141至2146年
-
26。
普里德SE,邓肯SH,GL保持,斯图尔特CS,弗林特HJ(2002)在人结肠丁酸形成的微生物。FEMS微生物学快报217:133-139
-
27。
Koruda MJ,RH Rolandelli,布利斯DZ,赫斯廷斯Ĵ,Rombeau JL,Settle的RG(1990)肠外营养补充有短链脂肪酸:在正常大鼠小肠粘膜的效果。牛J临床营养学51:685-689
-
28。
Whelan K, Judd PA, Preedy VR, simr, Jann A, Taylor MA(2005)低聚果糖和纤维部分地阻止了健康人标准肠内配方所引起的粪便菌群和短链脂肪酸浓度的改变。J减轻135:1896 - 1902
-
29。
Duncan SH, Belenguer A, Holtrop G, Johnstone AM, Flint HJ, Lobley GE(2007)通过减少肥胖受试者从饮食中摄入碳水化合物导致粪便中丁酸盐和产生丁酸盐的细菌浓度降低。环境微生物学:73:1073-1078
-
30。
面包车Saene HK,Stoutenbeek CP,Zandstra DF(1988)头孢噻肟与长期重症监护病房患者选择性去污组合。几乎没有阻力的出现。药品35增刊2:29-34
-
31。
华拉德(1990)头孢噻肟对健康志愿者体内微生物定植抗性的影响。《抗肿瘤化学杂志》26:117-123
-
32。
Guggenbichler JP,科夫勒Ĵ,Allerberger F(1985)的第三代头孢菌素在需氧肠道菌群的影响。感染13(增刊1):S137-S139
-
33。
威灵GW,格莱恩G(1993)抗微生物剂和它的间差异的具体失活。旧草堂大学研讨会专着3本研究所微生物学和生物化学草堂莳萝,页47-54
-
34.
Pultz NJ,Stiefel的U,Subramanyan S,赫尔方MS,Donskey CJ(2005)的机制,通过该厌氧微生物群抑制由耐万古霉素肠球菌在肠道定居的小鼠建立。Ĵ传染病杂志191:949-956
-
35.
范·蒂尔夫,范·德·格斯,斯托贝林赫·伊(1995)殖民与感染粪肠球菌在重症监护病房:抗菌药物的作用。Antimicrob代理Chemother 39:2783年至2786年
-
36.
布兰德K,Plitas G,迷糊CN,乌韦达C,贾T,弗莱舍男,施纳布尔B,DeMatteo RP,Pamer EG(2008)万古霉素耐药肠球菌利用抗生素诱发的先天免疫缺陷。自然455:804-807
-
37.
Montecalvo MA, Horowitz H, Gedris C, Carbonaro C, Tenover FC, Issah A, Cook P,沃姆瑟GP(1994)万古霉素-、氨苄西林-和氨基糖苷耐药性的爆发屎肠球菌成人肿瘤科的菌血症。抗疟药:Chemother 38:1363-1367
-
38。
Willems RJ, Top J, van Santen M, Robinson DA, Coque TM, Baquero F, Grundmann H, Bonten MJ(2005)抗万古霉素的全球传播屎肠球菌从不同的院内遗传复杂。EMERG传染病杂志11:821-828
-
39。
费尔南德斯格雷罗ML,Goyenechea A,Verdejo C,Roblas RF,德GM(2007)肠球菌对本地和人工瓣膜性心内膜炎:临床和预后因素,重点是医院获得性感染的结果的主要因素进行审查。医学(巴尔的摩)86:363-377
-
40。
史蒂文斯MP,爱德蒙MB(2005)心内膜炎由于万古霉素耐药肠球菌病例报告和文献复习。临床传染病杂志41:1134年至1142年
-
41。
Netherwood T,鲍登R,哈里森P,O'Donnell的AG,帕克DS,吉尔伯特HJ(1999)在胃肠道中的基因转移。应用环境微生物学65:5139-5141
致谢
R.F.J.Benus已收到赠款“UMCG Stimuleringsgelden”。我们感谢M.坦维尔汗为的培养F. prausnitzii并进行MIC测试。
188滚球软件
本文采用知识共享署名非商业性许可证,它允许任何非商业用途,分配,并在任何介质再现的条款分布,所提供的原始作者(S)和源记。
作者信息
电子辅助材料
下面是链接到电子辅助材料。
权利和权限
188滚球软件这是在知识共享署名非商188滚球软件业性使用许可的条款发布的开放式访问文章(https://creativecommons.org/licenses/by-nc/2.0),其允许任何非商业使用,分发和在任何介质再现,提供的原始作者(S)和源记。
关于这篇文章
引用本文
Benus, r.f., Harmsen, h.j., Welling, G.W.等。消化道和口咽去污对ICU患者的肠道菌群的影响。重症监护医学36岁,1394 - 1402 (2010)。https://doi.org/10.1007/s00134-010-1826-4
收到:
公认:
发布时间:
发行日期:
关键词
- 菌,厌氧菌
- 分子诊断技术
- 抗生素预防,
- 重症监护
- 菌群,粪